Урок з теми: З історії вивчення атома
Фізика 10 клас.
Конспект заняття, складеного за навчальною програмою для закладів загальної середньої освіти «Фізика і астрономія 10-11» (рівень стандарту), авторського колективу під керівництвом Ляшенка О.І. Затверджена МОН України наказом №1539 від 24.11.2017 року.
Тема заняття. З історії вивчення атома.
Фізична змістова лінія: Сучасні теорії будови атомного ядра.
Соціокультурна змістова лінія: Навчання впродовж життя. Оргдіяльнісні
вміння: мотивування, цілевизначення, планування, досягнення цілей, рефлексія.
Очікувані результати: Сформувати в учня / учениці уявлення про будову атома і сучасні теорії будови атомного ядра.
Види навчальної діяльності: самостійна робота з підручником, аналіз тексту, тестові вправи, узагальнення висновків.
Ціннісні орієнтири: формування фізичної картини світу.
Тип уроку: засвоєння знань (формування наукової фізичної компетенції).
Обладнання уроку: презентація, текстові матеріали, ментальні карти для візуалізації знань.
Мотивація навчальної діяльності: Відкриття сучасної теорії будови атома є одним з найважливіших етапів становлення сучасної фізики, який позначився на наступному розвитку нових фізичних законів.
План заняття
I. Перевірка домашнього завдання.
II. Актуалізація опорних знань.
III. Оголошення теми, очікуваних результатів уроку, мотивація навчальної діяльності.
IV. Конструювання учнями предметної компетентності, формування власного ставлення до теми.
V. Узагальнення та систематизація учнями отриманої інформації.
VI. Рефлексія.
VII. Оголошення та коментар домашнього завдання.
Перебіг заняття
- Перевірка домашнього завдання
Ланцюжкове озвучення відповідей на тестові домашні завдання.
- Актуалізація опорних знань.
Метод мікрофон:
- З чого складаються тіла?
- Які найдавніші уявлення про атом ви знаєте?
- Які вчені внесли вклад в формування сучасних уявлень про будову атома?
- Що означає слово «атом» в перекладі на нашу мову?
- Чи справді атом неподільний?
- Будова атома.
- Які ще елементарні частинки ви знаєте?
- Оголошення теми, очікуваних результатів уроку, мотивація навчальної діяльності.
3.1 Цілевизначення.
Сьогодні на уроці ми познайомимося з історією становлення сучасної теорії будови атома.
3.2 Складання ментальної карти із цілевизначенням та очікуваними результатами.
3.3 Прийом «Знак питання»
Діти, що ви очікуєте від уроку?
-
Конструювання учнями предметної компетентності, формування власного ставлення до теми.
- Перегляд презентації: «Історія вивчення атома»
- Заслуховування доповідей учнів
- Дослідницька робота: класифікувати моделі будови атома і додавання інформації в ментальну картку.
- Сформулювати ідею сучасної моделі будови атома і атомного ядра. Додавання інформації в ментальну картку.
- Рефлексія.
Виконання здобувачами знань тестових завдань.
- Оголошення та коментар домашнього завдання.
- Використані джерела:
- Програма для закладів загальної середньої освіти «Фізика і астрономія 10-11» (рівень стандарту)
- Підручник Фізика 10, В.Д.Сиротюк
- https://www.google.com/url
- Фізика та астрономія. Електронний підручник.
Додаток 1.
Поняття “атом” вперше зустрічається у творах давньогрецьких філософів і означало найдрібніші, неподільні (гр. atomos – неподільний) частинки, з яких складається світ. Вважалось, що атоми вічні, здатні рухатись і мають настільки малі розміри, що виміряти їх неможливо.
Такі уявлення про атоми були поширені до початку ХХ ст. Перші докази складності будови атома були одержані при вивченні проходження електричного струму через рідини і гази (М. Фарадей). Було встановлено, що електрика існує у вигляді окремих одиничних зарядів, які під дією електричного поля у вакуумі відхиляються до катода (позитивний полюс). Ці “катодні промені” (У. Крукс, 1876 р.) – мали негативний заряд і були названі електронами (Дж. Томсон, 1907 р.). В. Рентген (1895 р.) відкрив новий вид випромінювання – електромагнітні промені (названі ним Х-промені, зараз – рентгенівське випромінювання), які випускає речовина при попаданні на неї катодних променів.
Ще одним свідченням складності будови атомів стало відкриття здатності атомів певних елементів самовільно розпадатись. Це явище дістало назву “радіоактивність” (А. Бекерель (1896 р.), подружжя Ж. Кюрі і М. Склодовська-Кюрі (1898 р.)).
Подальші відкриття ядра, протона, нейтрона, визначення зарядів елементарних частинок, надихнули вчених на створення моделей атома. Першу модель атома запропонував Дж. Томсон у 1903 р. Атом він уявляв як певну кількість позитивно зарядженої речовини – “тіло атома”, у яку вкраплені негативно заряджені електрони (як родзинки у булку) (рис. 4.1). Сумарний заряд електронів в електронейтральному атомі приймався рівним заряду позитивно зарядженого тіла атома.
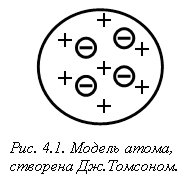
Подальше вивчення Е. Резерфордом (1907 р.) проходження a-частинок (ядра Не2+) через тонку металічну (срібну або золоту) фольгу показало, що більшість з них проходить через фольгу вільно і лише деякі змінюють траєкторію руху. Це навело вченого на думку, що атом побудований на зразок сонячної системи, тому запропонована ним модель атома була названа “планетарна модель будови атома” (рис. 4.2).
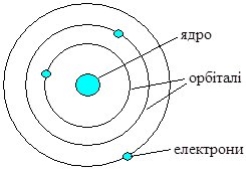
Рис. 4.2. Планетарна модель атома Е. Резерфорда
Згідно Резерфорду, у центрі системи (атома) розміщене маленьке позитивно заряджене ядро, в якому сконцентрована майже вся маса атома. Навколо ядра рухаються електрони (планети), кількість яких визначається зарядом ядра, який чисельно рівний порядковому номеру елемента у Періодичній системі Д.І. Менделєєва (Г. Мозлі, 1913 р.). Усі електрони утворюють електронну оболонку атома. Максимальна відстань від ядра атома до найдальшої точки траєкторії руху електронів визначає розмір атома – атомний радіус.
Однак, планетарна модель атома Резерфорда мала певні недоліки. Одним з найочевидніших було те, що при обертанні електрон має втрачати енергію і наближатись до ядра, врешті-решт впавши на нього, що призвело б до зникнення атома. Однак цього ніколи не відбувається.
Для усунення цієї та деяких інших суперечностей, Н. Бор (1913 р.) запропонував доповнити теорію будови атома Резерфорда постулатами (положення, які приймають без доведення):
- електрон може рухатись навколо ядра лише по певних колових – стаціонарних – орбітах;
- рухаючись по стаціонарній орбіті електрон не випромінює і не поглинає енергію.
Такі уявлення про будову атома були близькими до сучасних.
Додаток 2. Тести.
- Вчений, який відкрив існування в атомах електронів, частинок, що несуть негативний заряд
- Резерфорд
- Томсон
- Ленард.
- Фізик, який запропонував модель порожнього атома, усередині якого літають частинки , складені із взаємно врівноважених позитивних і негативних зарядів.
- Ленард
- Содді
- Кюрі.
- У дослідах Резерфорда і Содді з атомів Радію спонтанно випромінюються три види частинок, які:
- Всі негативно заряджені
- Два види позитивно і один негативно заряджені
- Негативно заряджені, нейтральні і позитивно заряджені
- Результати дослідів привели Резерфорда до
- Планетарної будови атома
- Встановлення будови ядра атома
- Суперечностей в теорії будови атома
- Для усунення суперечностей теорії будови атома Резерфорда були прийняті:
- Положення спеціальної теорії відносності Ейнштейна
- Постулати Бора
- Основні положення молекулярно-кінетичної теорії
- Явище радіоактивності вперше було відкрито:
- Резерфордом
- Подружжям Кюрі
- Беккерелем
- Яке з випромінювань відхиляється в магнітному полі?
- Потік нейтронів
- Потік протонів
- Гама випромінювання
- Атом у перекладі на нашу мову означає:
- Найменший
- Елементарний
- Неподільний
- Атом складається з:
- Ядра і електронів
- Протонів і нейтронів
- Електронів і протонів
- Порядковий номер хімічного елемента визначає:
- Кількість протонів у ядрі і тим самим кількість електронів навколо ядра
- Кількість нейтронів у ядрі
- Кількість електронів навколо ядра і тим самим кількість протонів у ядрі.
- Маса протона:
- набагато більша за масу електрона
- набагато менша за масу електрона
- приблизно дорівнює масі електрона
- Нуклони – це
- Ядра атомів
- Протони і електрони
- Протони і нейтрони.


про публікацію авторської розробки
Додати розробку
