Інтегрований курс "Паливо"
1
Міністерство освіти і науки України
НАН України Інститут педагогіки
Смілянська ЗОШ І-ІІІ ступенів №6
Інтегрований курс:
«Паливо і енергетика»
Роботу підготував:
вчитель хімії О. В. Бардадим


Даний посібник складається з двох частин: теоретичної та практичної, що включає авторські завдання до курсу.Мета курсу:
- інтегрувати знання з різних галузей науки;
- розвити природничий інтелект;
- переосмислити таке поняття як "паливо";
- осучаснити і оновити дидактичні матеріали.
Інтегровані дисципліни:
- астрономія
- географія(економіка)
- хімія,
- фізика,
- екологія,
- біологія,
- англійська мова
- математика,
- історія,
- інформатика.
Прогамовий матеріал
|
Автори |
Програмовий матеріал |
|
І. Дьоміна, В. Задоянний, С. Костик
|
Електромагнітне поле. Змінний та постійний електричний струм. Електрогенератор та електродвигун. ГЕС, ТЕС, АЕС. Географічні Чинники розміщення електростанцій. Державне підприємство “Національна атомна енергогенеруюча компанія (НАЕК) „Енергоатом“ — оператор усіх діючих атомних електростанцій України. Альтернативні джерела енергії. Вітрогенератор, сонячні батареї та інші. Біопаливо. Хімічні джерела струму Пасивні будинки (0-енергії або + енергія), тепловий насос, фреони. Енергозбереження у побуті, , класи енергоефективності побутової техніки. Проблеми енергозбереження державного рівня.
Досягнення українських вчених у галузі енергетики. Hyperloop - проект вакуумного потяга.
|
|
Авторський колектив під керівництвом Ільченко В. Р. |
– |
|
Авторський колектив під керівництвом Засєкіної Т. М.
|
Технології 11 клас Паливо та мастильні матеріали. Пальне для транспорту. Октанове число бензинів та цетанове число дизельного пального. Біопаливо. Естери та вуглеводи як сировина для добування біопалива. Вплив на довкілля вуглеводнів, їхніх похідних та продуктів їхньої переробки та згоряння. Транспорт. Історія розвитку транспортних засобів. Фізичні та хімічні принципи роботи сухопутного, водного, повітряного та космічного видів транспорту. Двигуни внутрішнього згорання та електродвигуни. Сучасні види транспорту їх переваги та недоліки. Проблеми і перспективи розвитку транспорту в Україні. Вплив транспорту на людину та навколишнє середовище. Подушки безпеки (фізичні та хімічні принципи роботи, біологічні наслідки).
|
|
Авторський колектив: Дмитро Шабанов, Олександр Козленко
|
V. Джерела енергії, які застосовує людство |
ЗМІСТ
Тема 1. Паливо: утворення, види палива, запаси палива, вплив на довкілля
Тема 6. Перетворення енергії. Принцип роботи двигуна
І.Проекти.
Представлення у вигляді круглого столу та конференції
|
№ |
Тема |
П.І.П. |
Кінцева дата виконання |
|
1 |
Алотропні модифікації Карбону |
|
|
|
2 |
Запаси нафти, газу і вугілля в Україні та в світі |
|
|
|
3 |
Колообіг Карбону у природі |
|
|
|
4 |
Крекінг та риформінг |
|
|
|
5 |
Керосин: історія створення, застосування |
|
|
|
6 |
Сланцевий газ |
|
|
|
7 |
Сланцева нафта |
|
|
|
8 |
Авіаційне та ракетне паливо |
|
|
|
9 |
Паливо майбутнього |
|
|
|
10 |
Добування нафти і газу |
|
|
|
11 |
Синтетичне паливо |
|
|
|
12 |
Спирт як паливо. Марка бензину Е-85 |
|
|
|
13 |
Як працюють дивигуни внутрішнього згорання |
|
|
|
14 |
Проблема вичерпних ресурсів |
|
|
|
15 |
Парникові гази |
|
|
|
16 |
Смог каліфорнійського та лондонського типів |
|
|
|
17 |
Біогаз |
|
|
|
18 |
Біодизель |
|
|
|
19 |
Історія нафтовидобування |
|
|
|
20 |
Історія компанії «Стандарт Оіл» |
|
|
|
21 |
Дж. Рокфеллер як «нафтовий король» 19 століття |
|
|
|
22. |
Вплив концентрації вуглекислого газу на роботу у кімнаті |
|
|
ІІ.Круглий стіл
Група А
- Походження торфу
- Склад торфу
- Використання торфу як палива
Група В
- Походження сланцевого газу і нафти
- Склад сланцевого газу і нафти
- Використання газу і нафти як палива
Група С.
Спирт як паливо
Група D. «Інформатори»
Оголошення останніх новин про «нафту», «природній газ», «слацевий газ», «сланцева нафта», «катастрофи », «глобальне потепління», «електромобілі».
III.Завдання
І.Запитання на пояснення явищ
- Чому бензин не можна гасити водою?
- Чому бензин утворює на воді райдужні плями?
- Чому булькає болото?
- Чому вода гасить вогонь?
- Чому зірки мерехтять, а планети світять рівним світлом?
- Чому вогонь буває різного кольору?
- Чому відбуваються виверження вулканів?
- Як злітає ракета?
- Звідки на Землі взялася нафта?
- Хто винайшов пластмасу?
- Що отримують з кам'яного вугілля?
- Що таке вогонь?
- З чого складається нафта?
- Може розкладатися пластик?
- Як вдається у холодильнику підтримувати низьку температуру? З якими особливостями газів це пов’язано?
- Чи реально зробити з графітового стержня, який міститься в олівці алмаз?
- Чому на міжнародних ринках нафту вимірюють барелем? Що називають барель?
- Якщо у Вас є декілька алмазів. Як зробити так, щоб алмази ніхто не зміг побачити?
- Чому кінцева трубка насоса для накачки м’яча нагрівається?
- Чому пише олівець?
- Як горить свічка?
- Чому людина пускає гази?
- Для чого використовується посудина Дьюара?
- Чому свічка не тоне?
- Чому М. Тетчер закривала шахта у 80-х роках. Чим це обумовлено?
- В чому відмінність в активованому вугіллі та білому по складу?
- Поясніть чому шахтарська професія вважається небезпечною?.
- Які гази називають парниковими?
- Як впливає велика концентрація вуглекислого газу на організм людини?
- Чому фреони небезпечні для навколишнього середовища?
- Чому у багатьох країнах забороняють поліетиленові пакунки?
32.Як впливає велика концентрація вуглекислого газу на організм людини?
33.Чому Шотландія забороняє випуск ватних паличок для чищення вух
34. Чому лупа запалює папір?
35. Як зробити деревне вугілля у ямі?
36. У чому різниця між цинантним та октановим числами? Навіщо потрібно?
37.Чи можна фреоном опалювати приміщення?
ІІ. Розвиток цифрових компетенцій
- Користуючись інтернет-ресурсами знайдіть 10 найбільших алмазів, які були знайдені?
- В яких одиницях вимірюють масу алмазу?
- Скільки містить 1 барель?
- Яку хімічну будову мають марки бензинів «А-90», «А-92», «А-95», «А-98»?
- Чим обумовлене забарвлення багатьох атмосфер планет Сонячної системи?
- Чи існує життя після нафти? Для відповіді на це запитання скористайтеся історією нафтової промисловості у м. Дрогобич.

7.Чому відбувається горіння газу?

https://www.youtube.com/watch?time_continue=41&v=NvJAKVnK4qM
8.Як транспортують банани? Чому банани у дорозі не пропадають?
9.Чи існують речовини, які здатні горіти під водою?
10.Чому заборонено спалювати побутові відходи вдома?
11.Побудуйте діаграму залежності кількості видику метану у живих представників: терміти, корови, верблюди, зебри, вівці, слони, лабрадори, людина, миші.
12.Які речі можуть вичерпаєтьсяться? Які запаси можуть вичерпається?
13.За фактами встановіть речовину:
- У 941 році візантійці за допомогою цієї зброї розгромили у м. Константинополі флот князя Ігоря Рюриковича.
- Була прообразом вогнемета
- Була на оснащенні флоту Візантії
- Це запальна суміш.
- Була використана при захисті Родоса
- Сирої нафти, сірки і масла
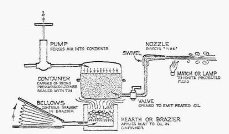

14.Встановіть об’єкт:
- Загущений бензин, горючий продукт, який застосовується в якості запальних і вогнеметних сумішей.
- Використовується як зброя.
- Використовувався під час Другої світової війни та під час В’єтнаму
- Перекладається як: англ. napalm - скорочення від англ. naphthenic acid - нафтенова кислота і англ. palmitic acid - пальмітинова кислота

15.Рідина ** представляла собою розчин білого фосфору використовувалася при війні в Іспанії
16.Що таке біогаз?
17. Як це можливо

ІІІ. Вміння ставити запитання до зображення та шукати відповіді
1.У всесвітній мережі блукає відео в якому експериментатор підпалює запа-льничку і утворюється наступний ефект. Поясніть цей ефект. Як це може бути

2. Африка + 35 градусів по Цельсію. Лід на трубах. Як це можливо?

3. Для чого використовують даний тип корабелю? Які речовини можна переплавляти ним?

4. Чи можна вважати машину, яка відображену на рисунку нижче паровою? Якщо так? То доведіть

5. Як водяна пара може запалити папір?Як це можливо?
6.Чи правильно роблять австралійці і чому?

7.Який контекст закладений у даному фото?

8.Як можливо це?

IV. Критичне мислення. Скептики.
- Чи існує глобальне потепління?
- Чи правда, що Всесвіт розширяється?
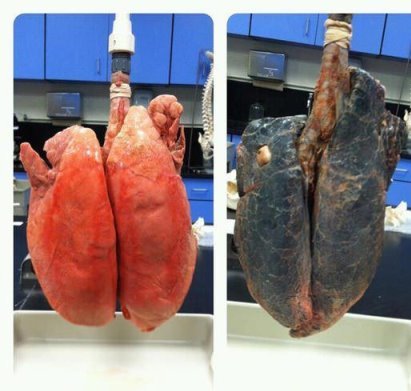
- Чи дійсно куріння погано впливає на здоров’я. Доведіть, що дане фото не фейк.
4.Чи зможуть сонячні батареї перекрити потреби в електроенергії.
5.Назвіть об’єкт, який відображено на рисунку
Діаметр циліндра цього суднового двигуна 960 мм, хід поршня - 2,5 метра! Робочий об'єм циліндра дизеля складає 1820 літрів.

6.Вкажіть формулу речовини

- Чому не видно полум’я?Як це можливо?


8.Поясніть причину інтерференції бензину

9.Чому алмаз переливається різними кольорами?

10.Навіщо і де використовується цей об’єкт? 
11.Як це можливо?

12.З чим пов’язано те, що вугілля має чорний колір?
13.Чи може існувати планета на якій атмосфера складається з алмазів?
14.Яка різниця між чорним та білим вугіллям?
15.За і проти розвитку індустріального суспільства?
16.Чи дійсного викиди СО2 від промисловості змінюють клімат Землі (1000 р тому Гренландія, зелена земля отже не було льоду?)
17.Чи можна вважати шахтарську професію небезпечною і чому? Які фактори на це впливають?
18.Чи існують речовини, які здатні горіти під водою?
19. Поясніть чому відбувається явище?

V. Запитання на рефлексію
- Яка різниця між поняттям «алмаз» та «бриліант»?
- Що таке «дьоготь»?
- Що таке антрацит?
- Що таке фракція?
- Як утворюється природній газ, нафта, вугілля?
- CO2 органічна чи неорганічна сполука?
- Чому екологи вважають природній газ більш екологічнішим, ніж вугілля?
- Порівняйте класів сполук алканів і алкенів на основі молекул метану та етану. Використання діаграми Вена
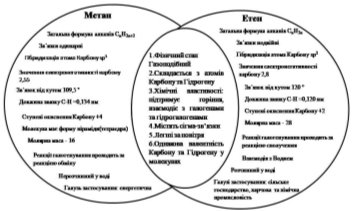
Наступні запитання:
- Опишіть метан за фізичними властивостями. Чим саме важливий метан для людини?
- Що таке звалищний газ? Із Яких газів він складається?
- Чим саме небезпечні звалищний газ для живих систем та навколишнього середовища? Що таке метаногенез?
- Як викидається сміття у Україні та в ЄС?
- Розрахуйте об’єм метану було викинуто за 2016 з побутових відходів. Скільки відсотків це складає від річної потреби біогазу, якщо в 2016 році було спожито 13 млрд. кубів природного газу.
- Метан можна отримати із 1 т біокультур метану, якщо основною речовину слід вважати глюкозу. Який об’єм метану можна отримати?
- Запропонуйте способи переробки звилищних газів. Схематично змоделюйте установку.
- Яка позитивка та негативна сторона біогазу?
- Який газ вигідніший той, що перероблений з відходів чи той, що добутий з надр. Для уявіть, що Ви стали підприємцем. Необхідно обрахувати вартість такого газу собівартість біогазу (метану), який отримають з твердих відходів.
VI. Завдання на сторітелінг
- Історія успіху Рокфеллера
- Історія успіху Менделєєва
- Історія успіху І. Маска
- Історія успіху Карнегі
- Історія успіху Г. Форда
- Історія успіху компанії «Стандарт оіл»
VII. Творчі завдання
1.Які необхідні умови для утворення нафти й газу?
2.Якими корисними копалинами володіє Ваш регіон, область?
3.Зробіть акаунт-сторінку одного з вчених Зразок..

VIII.Завдання прикладного значення
1.Як в домашніх умовах виявити витік газу?
2.Чому якщо покласти помідор і банан у поліетиленовий пакет і залишити на 2-4 дні, то він дозріє?
3.Як вдома побачити графен?
Унікальний матеріал був отриманий, можна сказати, дуже по-російськи, практично на кухні - за допомогою скотча і олівця. Скотч приліплювали до графіту і потім здирали, виходив шар графіту в атом товщиною. Потім скотч хімічно розчиняли і так був вперше отриманий графен. Нижче ви зможете навіть побачити відео, як це можна зробити в домашніх умовах.
4.Де швидше замерзне вода?
Для досліду необхідно взяти дві пляшки (об’єми двох пляшок мають бути однаковими) в одній пляшці має бути газована вода, а в іншій вода з-під крану. Поставити обидні пляшки у холодильник. Зробити висновок стосовно того, яка з пляшок швидше замерзне.
Куди дівається спирт?
Налити у посудину 10 см3 етилового спирту і залити на тиждень . Після цього виміряйте об’єм рідини. Що ви спостерігаєте? Поясніть дане явище?
5.Як отримати газ з дерева?
Покласти у горизонтальну укріплену пробірку небагато сухих шматочків дерева, закрити отвір пробкою з газовідвідною трубкою. Зараз нагріємо пробірку з деревиною (не можна нагрівати пробірку в одному місці). Із верхнього отвору газовідвідної трубки і починає втділятися білий дим, який може запалити. Отримане полум’я внизу голубе, зверху – жовте такий же вид має полум’я газової горілки. Аналогічно газ можна отримати із кам’яного вугілля.
6.Як отримати дьоготь?
Якщо газовідвідну трубку при нагріванні дерева газом опустити кінцем вниз в пусту пробірку, то там утворюється коричнева рідина з характерним запахом.
В пробірці, де нагрівалось дерево, після виділення газа і смоли залишається чорне вугілля. Ним можна малювати на білому листку, а при внесенні полум’я тліє.
7.Як отримати маслянисту лампу?
Рослинне масло трохи підігріти у фарфоровій чаші. Опустимо до неї вату, звернути у вигляді фітеля. Один кінець за допомогою пінцета підпалити на край чаші і обережно підпалити його. В нас отримається світильник або масляниста лампа. Якщо над полум’ям лампи потримати жерстяну кришку або чашку ми побачемо як кришка пориється сажою. Сажа – це вугілля.
8.Обвуглення цукру.
Взяти невичку кількість цукру покласти на жерстяну кришку, накриваючи ковпачком і сильно нагріти. Скоро із під колпачка почнемо виділяти їдкий дим, який горить на повітрі, якщо піднести сірник. Коли дим перестає виділятися, знімаємо колпачок на кришці і побачемо чорну масу. Це вугілля, яке входить в склад цукру це Карбон.
9.Ракета із пляшки
Для експерименту нам знадобиться пластикова пляшка ємністю 0,5 літра з невеликим отвором кришка, а також вата, змоченим спиртом.
Ракета з пляшки своїми руками
Покладемо вату в пляшку і почекаємо 10 хвилин, поки утворюються пари спирту. Потім вату потрібно витягнути з пляшки пінцетом. Після цього ракету можна запускати. Для цього необхідно вату намотати на дерев’яну паличку підпалити її і піднести її до кришки. Поясніть траєкторію руху ракети.
Можна аналогічно і зробити і содову ракету.
10.Поршневий запал
Взяти для цього необхідно шприц і відрізати кінець

Засунути в середину вату чи папір в середину.
Підкласти під шприц резину.
І натиснути на поршень
Поясніть дане явище.
11.Що буде з воднем, якщо набрати його у пляшку і закрити, залишивши на місяць?
12.Як покласти сірники в коробок лише за допомогою магніту?
13.Як вивести нафтову пляму на одязі?
14. Скільки потрібно взяти гліцерину для суміші антифризу, щоб двигун не замерз ?
15. 10 способів отримання сірників без сірки.
16.Запропонуйте лайдаки з свічкою.
17. Як зробити «вогнегасник» у домашніх умовах?(домашній експеримент) Які для цього необхідні реактиви? Принцип його дії
IX. Експерти-інженери. Висловіть думку чому кожен з двигунів не може існувати
- Колесо з перекочується кулями
- Ланцюжок куль на трикутній призмі
- «Пташка Хоттабича»
- Ланцюжок поплавців
- Архимедов гвинт і водяне колесо
- Машина Орфіреус
- Магніт і жолоби
- «Вічний водогін»
- Автоматичний заведення годин
- Масло, що піднімається по ґнотах
- Колесо з відкидними вантажами
- Установка інженера Потапова
- Місяць і планети.
Х. Нестандартні задачі
1.Старт або фініш?
Злітає або сідає космічний корабель, показаний на малюнку:
Старт або фініш?
Більшість вважає – це завдання жартом. Мовляв, автор сподівається, що читачі скажуть: «Оскільки реактивна струмінь спрямована вниз, то сам корабель рухається вгору і, отже, злітає». Але ми знаємо, що при посадці корабель також повинен направити струмінь вниз, щоб за допомогою її реакції (протидії) погасити свою швидкість зближення із Землею. Правда, часто посадка здійснюється за участю парашутів, без реактивного струменя. Якби на малюнку був парашут, то не було б ніяких сумнівів, що це посадка. А зараз малюнок не дає відповіді на поставлене запитання.
Звичайно ж, автор не будував задачу в розрахунку на такий явний промах з боку читача. Дійсно, орієнтація корабля соплом до Землі, клуби пилу, підняті реактивним струменем, - все це однаково характерно і для початкової стадії зльоту, і для кінцевої стадії приземлення. Проте наголошуємо, що на малюнку є достатньо даних для відповіді на питання.
Про що йде мова?
2. Куди летить повітряна куля?
Випущені з рук дитячі повітряні кулі кудись відлітають. Куди? Як високо можуть вони полетіти?
ХІ. Робота з текстами
Текст 1.
В атмосферу щорічно викидається 31-32 млрд тонн вуглекислого газу (CO2) в результаті людської діяльності. Внесок автомобілів в цей показник становить близько 20%, тобто приблизно 6 млрд тонн. Вулкани ж викидають в середньому всього 300 млн тонн CO2, тобто близько 1% від всіх антропогенних викидів та 5% від автомобільних викидів.
В історії Землі відомі катастрофічні виверження вулканів, які викидали сотні кубічних кілометрів порід і, відповідно, трильйони тонн речовини. І хоча CO2 становить лише незначну частину вулканічних викидів, настільки потужні виверження можуть скласти конкуренцію автомобільному забруднення, але тільки в межах річної норми. Такі виверження відбуваються вкрай рідко.
Крім того, 300 млн тонн вулканічних викидів у рік вже враховує усереднений ефект великих вивержень, які трапляються приблизно раз в 10 років. На них припадає менше 10% загальних вулканічних викидів CO2. Регулярні вимірювання рівня вуглекислого газу в атмосфері виявляють практично ніякого впливу великих вивержень.
Відповідь: Чи несе людина великий вклад у викиди атмосфери.
Текст 2.
Чи замислювалися ви про те, що там взагалі горить на Сонце? Сам термін «горіння» означає, що самопідтримується хімічний процес окислення, що протікає при високій температурі, з виділенням енергії, яка підтримує цю температуру. У земних умовах горіння без кисню неможливо. А ось у складі Сонця кисню дуже мало. Та й взагалі, хімічне горіння там неможливо, оскільки при таких температурах не можуть існувати молекули, які є продуктами такого горіння.
Енерговиділення Сонця забезпечується не хімічними, а термоядерними реакціями перетворення водню в гелій, які протікають в його ядрі.
Однак це теж високотемпературний процес, який підтримується за рахунок тепла, що виділяється. Тому про нього часто говорять як про горіння, але в переносному, не строго науковому сенсі. Кисень для термоядерного горіння водню не потрібно і як продукт реакції теж не утворюється.
Цікаво ще ось що: на пізніх стадіях еволюції Сонця (приблизно через 6,5 млрд років) горіння водню в його ядрі зміниться горінням гелію, який буде перетворюватися в вуглець, а в подальшому і в кисень. Сонце при цьому значно збільшить свою світність і виросте в розмірах, ставши червоним гігантом. Саме такі ядерні реакції в зірках попереднього покоління напрацювали той кисень, яким ми дихаємо. В кінці життя цих зірок частина їх речовини, збагаченого киснем, була розсіяна в навколишньому середовищі і увійшла до складу зірок і планет, які утворилися з нього надалі.
Запитання: «Які хімічні процеси відбуваються на Сонці».
3.Що це за речовина?
***** є твердою формою вуглецю з атомами вуглецю, розташованими в унікальній кристалічній структурі. Він має найвищу твердість і теплопровідність будь-якого природного матеріалу, що робить його надзвичайно корисним у великих промислових областях, таких як інструменти для різання та полірування. Природні алмази надзвичайно рідкісні, і більшість **** формуються на глибині від 150 до 250 кілометрів у мантії Землі при дуже високій температурі і тиску. Тим не менш, алмази також можуть бути виготовлені в лабораторії, щоб задовольнити зростаючий попит на промислові та гемологічні пушки. В останні роки стало можливим виробництво синтетичних *****, які настільки візуально подібні до природних *****, що тільки геолог зі спеціальним обладнанням може визначити різницю. Крім ювелірних виробів та прикрас, ***** використовуються як промислові абразиви для різання та шліфування твердих матеріалів. **** також використовуються в ***** осередках ковадла, пристрої високого тиску, що дозволяє стискати невеликий шматок матеріалу до екстремальних тисків до 7,7 млн.
Про яку речовину йдеться?
. Продовжіть ланцюг
C6H6 → С6H3-X
Вільбранд створив першу партію ***(вибухової речовини широко відомого як ТНТ), спочатку призначався для використання в якості жовтого барвника в 1863 році. Цей, здавалося б, невинний жовтий барвник розташовувався на столі протягом приблизно 40 років до початку 1900 років, коли лабораторні вчені виявили його ефективність як вибухова речовина. *** був досліджений, випробуваний, і застосовувався протягом Першої та Другої світових воєн. ***(Тротил) використовується як для конструктивних - підривання старих будівель для створення нових, так і для деконструктивного цілей - воєн, тероризму. Причина включення його в цей список пов`язана з прикрим помилкою містера Вільбранда, який не зумів зрозуміти, що жовтий барвник, який мав успіх тільки в розфарбуванні німецьких прапорів, міг би заробити для нього величезну суму грошей від багатьох військових світу, які, в той час, застосовували порівняно примітивну вибухівку. Джерело: http://uayakfaq.ru/rizne/17389-10-girshih-vinahodiv.html
Підказка «тротіл»
1 кг цієї речовини виділяє 4,2 млн Дж по https://www.youtube.com/watch?v=5jA3j_x4uYo скласти діаграму найбільших вибухів.
Про яку речовину йде мова?
ХII. Вікторина. Вогонь. Безпека
1. За яким номером телефону потрібно звертатися у випадку виникнення пожежі? (101).
2. Чому не можна гасити пожежу на електроприладах водою? (буде замикання або пораження струмом).
3. Що слід зробити, якщо в квартирі чути запах газу?
4. Що може статися через витік газу? ( Вибух ).
5. Чи можна вибивати вікна при пожежі? (Ні, бо у приміщення почне поступати свіже повітря, яке прискорює горіння).
6. Чому у дитячих закладах двері приміщень відчиняються назовні? (Тому, що у такому випадку при евакуації не створюється велике скупчення людей).
7. Чому не можна кидати у вогонь аерозольні упаковки? (Аерозольні упаковки — вибухонебезпечні).
8. На що необхідно лити воду під час гасіння : на вогонь чи на палаючий предмет? (На палаючий предмет).
9. Що треба робити, якщо під час перегляду телевізора з нього пішов дим? (Вимкнути телевізор. Викликати пожежну службу, позвати на допомогу дорослих або самому накинути на телевізор щільну тканину, ковдру).
10. На що можна встановлювати електропраску? (На металеву підставку)
11. Головна вогнегасна речовина (Вода)
12. Де в задимлених приміщеннях потрібно шукати дітей? (У шафі, під ліжком, під столом).
13. Що потрібно зробити перед тим, як вийти з дому? (Все вимкнути з мережі).
ХІІІ. Задачі для ерудитів
1. Ви знаходитеся на третьому поверсі будинку, що горить. Вихід на сходи — відрізан. Затримка хоч на хвилину — і ви отруїтесь чадним газом. Ваші дії? (Взяти простирадла, зірвати гардини, міцно зв’язати їх між собою на 2-3 вузли, міцно прив’язати до батареї опалення, спустити кінець у вікно і спуститися по цій мотузці скільки зможете, відпустити її і стрибнути на землю).
2. Яка діжка представляє більшу небезпеку: наповнена бензином чи порожня після нього? (Порожня: в ній може створитися вибухонебезпечна концентрація прів бензину з повітрям).
3. Чи можна вмикати світло, якщо у квартирі відчувається запах газу? (Ні, через те, що при вмиканні світла може виникнути іскра, що при наявності газу може спричинити вибух).
4. Чому на пожежному щитку відро конусоподібне? Відповідь : Справа в тому, що такими відрами зручніше черпати пісок з пожежного ящика (адже вогонь гасять не тільки водою, але і піском). Щоб зачерпнути пісок, треба взятися однією рукою за рукоятку відра, а іншою - за його дно. З плоского днища звичайного відра рука в громіздкій пожежній рукавиці зісковзує. Набагато зручніше триматися за кінець конуса. До того ж конусоподібне відро легше занурювати в пожежну бочку з водою і виймати з неї вже наповненим. Крім того, взимку вода в бочці може перетворитись на лід. Кінчиком конуса пробити його легше. Пожежні також стверджують, що з відра-конуса воду можна виплеснути далі і точніше, ніж зі звичайного.
5. Влітку 1811 р. Києві. Найбільш жахлива пожежа всю історію міста, врезультаті цього економічний центр Києва став згарищем. Чи могла б трапитися подібна трагедія в м. Черкаси у 1811р. Якщо так, то вкажіть основну причину пожежі Відповідь обгрунтуйте. (так, причина це містобудування бо як Київ складалися з деревянной застройки (деревянным было даже уличное покрытие, тому були дуже незахищиними від пожеж) і тому були буже вразливі до пожеж.
6. Каліфорнія – це багатий штат на гроші та ресурси. Але біда його в тому, що він є вразливий на пожежі (сухий клімату) і від цього страждає сільськегосподарство. За для збереження власних угідь від горіння фермери викристовують «дідівський спосіб» захисту ферм від пожежі. Увага питання. Про який саме «дідівський спосіб» захисту йдеться мова? ?Чому саме раціонально викристовувати даний спосіб.Відповідь обгрунтуйте. Відповідь : У каліфорнії використовують кіз. Чому тому, що вони знищуть підлісок, цим самим зменшують потенційну площю пожежі.
XIV.Кросворд
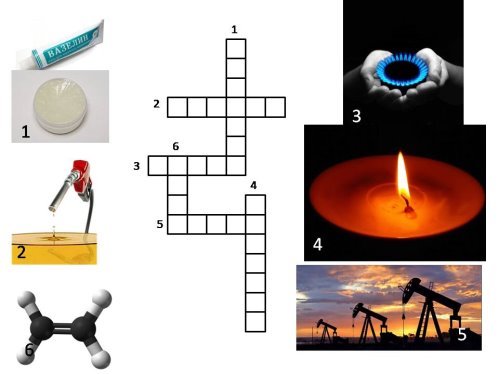
Відповіді:
- Вазелін
- Дизель
- Метан
- Парафін
- Нафта
- Етен
2.Заповність схему
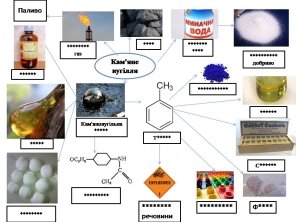
3. Знайдіть відповідність між наступними термінами: «аміачна вода», мінеральне добриво, «кокс», «коксовий газ», «толуен», «ультрамарин», «аналін», «кам’яновугільна смола», «сахарин», «бензен», «нафталін», «фанацетин», «пластмаса», «вогненебезпечні речовини». Замість * позначено кожну букву.
XV.Робота з підручником та іншими джерелами (Пізнання через порівняння, групова робота на семінарському(лекційному) занятті)
І.Порівняння у будові молекул Карбону(графіту), Алкану(на прикладі гомологічного ряду), Алкенів (на прикладі етену), Алкінів (на прикладі етину), Аренів
|
Ознака порівняння |
Карбону (графіту) |
Алкану |
Алкенів |
Алкінів |
Арени |
|
Загальна формула |
|
|
|
|
|
|
Утворення назви |
|
|
|
|
|
|
Формула молекули |
|
|
|
|
|
|
Електронегативність атому Карбону і Гідрогену |
|
|
|
|
|
|
Валентність атома Карбону і Гідрогену |
|
|
|
|
|
|
Форма молекули |
|
|
|
|
|
|
Довжина зв’язку С-H |
|
|
|
|
|
|
Ступінь окиснення атома Карбону і Гідрогену |
|
|
|
|
|
|
Тип зв’язку між атомами С і H |
|
|
|
|
|
|
Кількість σ і π-зв’язків |
|
|
|
|
|
|
Кратність зв’язку |
|
|
|
|
|
|
Полярність |
|
|
|
|
|
|
Диполі (відобразити на молекулах) |
|
|
|
|
|
|
Направленість ковалентного зв’язку |
|
|
|
|
|
|
Валентний кут |
|
|
|
|
|
|
Енергія зв’язку |
|
|
|
|
|
|
Тип гібридизації |
|
|
|
|
|
|
Тип кристалічної градки |
|
|
|
|
|
|
Часткові заряди на атомах |
|
|
|
|
|
|
Молярна маса, г/моль |
|
|
|
|
|
|
Характерні ознаки |
|
|
|
|
|
Висновок.
- Передбачення будови молекули фізичних і хімічних властивостей кожного класу сполук на основі типу кристалічної градки: розчинність у воді, запах, температура плавлення та кипіння.
- Спільні і відмінні властивості
ІІ.Порівняти фізичні властивості у будові молекул Карбону(графіту), Алкану, Алкенів, Алкінів, Аренів
|
Ознака порівняння |
Карбону (графіту) |
Алкану |
Алкенів |
Алкінів |
Арени |
|
Агрегатний стан за н.у. |
|
|
|
|
|
|
Колір |
|
|
|
|
|
|
Запах |
|
|
|
|
|
|
Відносна густина за повітрям |
|
|
|
|
|
|
Т. плав |
|
|
|
|
|
|
T кип. |
|
|
|
|
|
|
Густина г/см3 |
|
|
|
|
|
|
Розчинність у: а) воді б) органічних розчинниках |
|
|
|
|
|
Висновок.
- Спільні і відмінні властивості
- Змоделюйте хімічні властивості Алканів, Алкенів, Алкінів та Аренів на основі будови молекули.
- Обумовленість якого фактора сприяє на розчинність у воді та органічних розчинниках?
ІІІ. Хімічні властивості Карбону (графіту), Алкану, Алкенів, Алкінів, Аренів
|
Взаємодія з |
Карбону |
Алкану |
Алкенів |
Алкінів |
Арени |
|
Киснем |
|
|
|
|
|
|
Приєднання: а) воднем б) галогенами |
|
|
|
|
|
|
Ізомеризація |
|
|
|
|
|
|
Термічний розклад (крекінг) |
|
|
|
|
|
|
З водою* |
|
|
|
|
|
|
З нітратною кислотою* |
|
|
|
|
|
|
Взаємодія з KMnO4* |
|
|
|
|
|
|
Якісні реакції |
|
|
|
|
|
|
Полімеризація |
|
|
|
|
|
Висновок.
- Спільні і відмінні властивості
- Обґрунтуйте хімічні властивості Алканів, Алкенів, Алкінів та Аренів на основі будови молекули.
4. Добування Карбону (графіту), Алкану, Алкенів, Алкінів, Аренів
|
№ |
Карбону |
Алкану |
Алкенів |
Алкінів |
Арени |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Висновок. Створити взаємозв’язок між класами вуглеводнями за допомогою схеми: а) реакції крекінгу; б) хлорування; в) добування.
5. Порівняти поширеність, фізіологічну дію на організм, біологічну роль, вплив на екологію Алканів, алкенів, алкіні, аренів.
. Добування Карбону (графіту), Алкану, Алкенів, Алкінів, Аренів
|
Ознака порівняння |
Карбону |
Алкану |
Алкенів |
Алкінів |
Арени |
|
Поширеність у природі |
|
|
|
|
|
|
Фізіологічна дія на організм |
|
|
|
|
|
|
Біологічна роль |
|
|
|
|
|
|
Вплив на екологію |
|
|
|
|
|
Висновок. Встановити: а) речовини, які впливають на екологію та організм людини; б) проаналізувати поширеність у природі
6. Застосування:
- Перелічити основні представники алканів, алкенів, алкінів та аренів;
- Зробити схему із галузями застосування алканів, алкенів, алкінів та аренів.
Складіть схему колообігу метану.
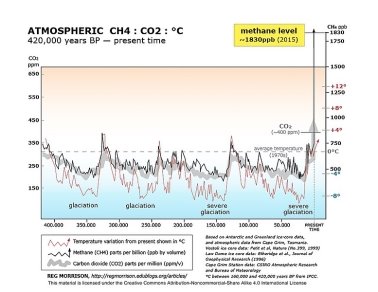
Метан і атмосфера: утворення природнє та антропогенне. Оцінка результатів. Висновок.
- Цикл Мілінковича
- Венера і парниковий ефект
- Нафта це отрута?
XVI. Інтерактивні вправи
1.За допомогою спеціального хімічного годинника. Назвіть гомологічний ряд метану
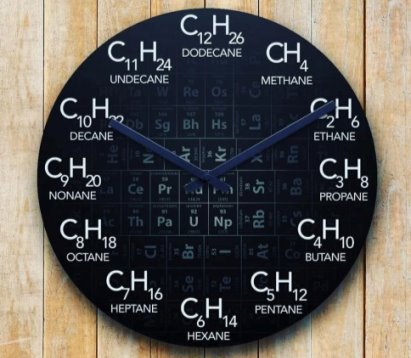
Рис. Хімічний органічний годинник
2. Знайдіть у таблиці десять представників гомологічного ряду метану(слова читають зліва-направо, зверху-вниз, справа-наліво, знизу-наверх). Наприклад, етан.
Таблиця 2
|
М |
К |
н |
О |
П |
р |
С |
т |
л |
н |
|
Н |
М |
е |
Т |
А |
н |
Д |
в |
а |
д |
|
Т |
Й |
б |
У |
Н |
п |
Р |
о |
п |
е |
|
Я |
А |
н |
Т |
А |
н |
Н |
н |
а |
н |
|
П |
Н |
а |
Р |
І |
и |
Н |
а |
ц |
й |
|
Й |
Е |
т |
З |
Г |
н |
К |
т |
ш |
д |
|
О |
К |
т |
К |
Е |
б |
О |
б |
а |
щ |
|
К |
А |
н |
П |
К |
н |
О |
н |
р |
п |
|
Е |
Г |
е |
Р |
С |
г |
Н |
а |
о |
б |
|
Д |
У |
п |
Н |
А |
е |
Н |
а |
п |
з |
|
Г |
Б |
т |
А |
Н |
б |
М |
е |
т |
ф |
3.Утворіть правильні слова
натем, утбан, натко, теан, ропна, етнгпае, олмгоог
4. «Біла ворона».Знайдіть у ряді зайве слово та поясніть чому
а) метан, етан, пропан, бутан, лактан
б) етен, етан, етин
в) октан, манган, метан
г) пропан, бутан, октан
д) меркаптан, метан, октан,
е) метан, етан, пропан… це
5. Знайдіть зайву формулу, яка не відноситься до гомологічного ряду метану
- CH4, C2H6, С3H7, C4H10
- C6H14, C8H18, C10H22, C11H23
6.Утворіть назви сполук. Можна у таблиці змінювати стовпчики місцями
|
Г |
е |
П |
т |
а |
н |
|
Н |
п |
К |
с |
о |
р |
|
О |
к |
Т |
а |
н |
|
А |
н |
Н |
е |
д |
|
Н |
о |
Н |
а |
н |
|
А |
н |
К |
е |
д |
XVII. Бліц-запитання. Відповідь так або ні.
- Запропонував назву «органічні речовини» −Й.-Я. Берцеліус.
- Яку речовину Веллер назвав як «життєва сила» − це сечовина?
- Вітаїзм – це вчення вітаміни.
- Карбон в органічній хімії має валентність 3.
- У чому різниця між зв’язками: одинарним, подвійними та потрійним.
- У літературі органічну хімію називають«хімієюГідрогену».
- За якими спільними властивостями було об’єднано органічні речовини.
- Насичені органічні речовини, які мають одинарний зв'язок.
- Ненасичені органічні речовини, які мають подвійний та потрійний зв'язок
- Продовжіть речення. «Органічні речовини застосовують у галузях народного господарства:…..»
- Вкажіть спільні ознаки для органічних та неорганічних сполук.
12.Горіння на Сонці відбувається без участі кисню?
13.Терміти найбільше виділяють метану серед всіх живих організмів?
14. Чи може гексан розчини гуму?
15. Чи може коштувати 1 л нафти дешевше, ніж 1 л води?
16.Може пропан-бутанова суміш загасити свічку?
17.Капля нафти важить менше, ніж вода?
XVII.Інфографіки
Створіть інфографіки про:
- використання нафтопродуктів та нафта;
- природній газ;
- вугілля;
- вуглеводні: застосування;
- альтернативне паливо;
- біодизель та біопаливо.
Складіть інфографіку про склад побутових відходів. Дослідження свідчать, що склад побутових відходів приблизно такий :папір 41%, харчові відходи 21%, скло 12%, залізо та його сплави 10%, пластмаси 5%, деревина 5%, гума та шкіра 3%, текстильні матеріали (тканини) 2%, алюміній 1%, інші метали 0,3%.
XVIII. Як влаштовані об’єкти
Таблиця 1
|
Об’єкт |
Суть роботи об’єктів / Принцип роботи |
|
Поршень |
|
|
Двигун внутрішнього згорання |
|
|
Паровоз |
|
|
ТЕС(ТЕЦ) |
|
|
Пароплав |
|
|
Повітряна куля |
|
|
ГЕС |
|
|
Заправка |
|
|
ГТС |
|
|
Ядерний реактор |
|
|
Водневий реактор |
|
|
ВЕС |
|
|
Вентилятор Скрилінга |
|
|
Факел |
|
Таблиця 2.
|
Об’єкт |
Суть роботи об’єктів / Принцип роботи |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ХХ. З яких компонентів складаються наступні об’єкти
- Автомобіль,
- Поясніть, як працює холодильник
XXI. Логічні завдання
1.Повний стакан з водою важить 900 г. А наповнений рівно на половину стакан важить стільки ж, скільки і два порожніх. Скільки важить порожній стакан?
2.Скільки є варіантів взаємодії?
|
|
C2H2 |
C2H6 |
O2 |
H2O |
H2 |
T=1500 ° C |
T=1000 ° C |
|
СH4 |
|
|
|
|
|
|
|
3. Умови загадки: вугілля з алюміній оксидом разом важить 10 кг. Пісок разом з вугіллям - 20 кг. Пісок з алюміній оксидом 24 кг. А скільки в цьому випадку будуть важити всі сполуки разом: вугілля, алюміній оксид та пісок.
4. Дайте відповідь на запитання
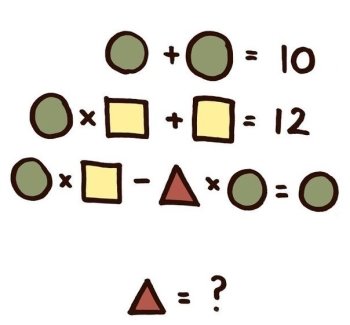
5.Про яку речовину йдеться?
• Тепер уявімо, що вам, як хіміку потрапив в руки зразок палива «Валькірії» (назвемо його паливо Х), і ви, з'ясувавши, що це паливо є індивідуальна речовина, а не суміш (як зазвичай, без певного припущення такі завдання не вирішуються), вирішили розшифрувати формулу палива.
• Відомо, що при кімнатній температурі паливо Х являє собою безбарвну рідину з кислуватим запахом, кипить при 61 ° C. При 100 ° C і нормальному атмосферному тиску щільність парів палива Х складає 2,06 г/л правда, працювати з паливом Х при такій температурі небезпечно: воно самозаймається на повітрі.
• Єдиними продуктами згоряння 6,3 г палива Х в кисні (або на повітрі) є 8,1 г води і 17,4 г твердого при кімнатній температурі оксиду А, що містить 68,94% кисню (по масі). З гарячим водяною парою паливо Х реагує з виділенням водню і утворенням кислоти Б, що є похідним оксиду А.
• Визначте молекулярну формулу палива Х. Запишіть рівняння його реакції з киснем і водяною парою.
XXII. Розвиток навичок роботи із комп’ютерними засобами. Моделювання процесів
|
Посилання |
Що містить дане посилання |
|
Машина Карно |
|
|
Дослід Резерфорда |
|
|
Ізобарний процес |
|
|
Цикл Отто |
|
|
Вимірювання тиску газу |
|
|
Охолодження повітря при адіабатному розширенні |
|
|
Ізотермічний процес |
|
|
Кипіння рідин |
|
|
Робота газа |
|
|
https://phet.colorado.edu/en/simulation/legacy/gas-properties |
Властивості газу |
|
https://phet.colorado.edu/sims/html/states-of-matter/latest/states-of-matter_en.html |
Матерія |
|
https://phet.colorado.edu/sims/html/energy-forms-and-changes/latest/energy-forms-and-changes_en.html |
Перетворення енергії |
|
https://phet.colorado.edu/en/simulation/energy-forms-and-changes |
Форми енергії |
|
|
Моделювання ядерних процесів |
XXIII. РОЗВИТОК ПРАКТИЧНИХ НАВИЧОК.
Розкриття явищ речовин
Дослід 1. «Як загасити свічку на відстані від неї?».
Реактиви та обладнання:свічка, харчова сода, оцет (w = 9%), стакан об’ємом 100 см3, обідня тарілка.
Методика виконання
1. Поставити на стіл глибоку обідню тарілку; 2. Взяти свічку та підпалити її за допомогою сірників; 3. Тримати свічку над поверхнею тарілки під кутом 45° так, щоб зібрати 3-4 краплі розплавленого парафіну та поставити на нього запалену свічку; 4. Перевірити пальцями міцність тримання свічки; 5. В стакан об’ємом 100 см3 засипати 20 г харчової соди та налити 20 см3 оцту (w = 9%); 6. Після проходження реакції в стакані між оцтом та содою взяти його в руку; 7. Підняти стакан на відстань 5-7 см над свічкою та нахилити його під кутом 45° над вогнем.
Запитання: «Чому згасає свічка?»
Дослід 2. «Горіння свічки»
Реактиви та обладнання: свічка з підставкою, сірники
Методика виконання
Поставити на поверхню свічку з підставкою та підпалити її. Потушіть свічку дмухнувши на неї. Як тільки свічка згасла піднесіть відразу до неї запалений сірник. Що ви спостерігаєте? (експериментальний чинник).
Дослід 3. Перевірка властивостей свічки
Реактиви та обладнання: папір, банка з під концервів свічка з піставкою, сірники.
Методика виконання
З допомогою жерстяної банки на папері можна віддрукувати полум'я свічки. Для цього банку потрібно щільно обмотати шматком паперу і помістити в полум'я. Залиште банку на кілька секунд і не бійтеся, що папір згорить (чому?) А без нього не може відбуватися процес горіння .Якщо потім вийняти папір, то полум'я буде на ній чітко видрукувано.
Відбиток полум'я на папері. Іноді залишаються чорні лінії. Це зовсім не продукти згоряння папери. Лінії виходять, якщо ви доторкнулися папером до гнота. У місцях зіткнення відбивається кіптява у вигляді ліній.
Запитання: «Чому утворюється кіптява?» Поясніть
С18H38 + 9,5O2 = 18C + 19H2O
Кіптява утворюється в наслідок горіння продуктів згорання парафіну.
Папір не загорається тому, що так як вона притиснута до металевого циліндру, то позбавлена доступу кисню.
Дослід 4. Відбиток пальців.
Реактиви та обладнання: графіт, скотч, папір.
Методика виконання
Подрібніть графіт з олівця. На скотчі зробіть відбиток пальця. На поверхню паперу висипте графіт. Приклейте скотч до паперу.(вдавіть достатньо сильно) Отримуються відбитки пальців. Де використовують відбитки пальців? (комунікативна та дослідницька комппенетність).
Дослід 5. «Чи може вода сама підійматися на верх?»
Реактиви та обладнання: вода, свічка (довжина 5-6 см), склянка об’ємом близько 500 см3, глибоку обідня тарілка, сірники, ніж.
Методика виконання
Увага! Даний дослід проводити за присутності дорослих! Пам’ятати основні правила пожежної безпеки.
1.Від свічки, за допомогою ножа, відрізати шматок довжиною 5-6 см; 2.Поставити на стіл глибоку обідню тарілку; 3. Взяти свічку та підпалити її за допомогою сірників; 4. Тримати свічку над поверхнею тарілки під кутом 45° так, щоб зібрати 3-4 краплі розплавленого парафіну та поставити на нього запалену свічку; 5. Перевірити пальцями міцність тримання свічки; 6. Налити в глибоку обідню тарілку 30 см3 води; 7. Накрити свічку склянкою об’ємом 500 см3.
Запитання: «Що Ви спостерігаєте? Поясність, чому в склянці піднявся рівень води?»
Досвід № 6. Дивовижний свічник
Прилади й матеріали: свічка, цвях, стакан, сірники, вода.
Етапи проведення досвіду
Чи не правда, дивовижний свічник - стакан води? А цей свічник зовсім не поганий. Погіршити кінець свічки цвяхом.
Розрахувати величину цвяха так, щоб свічка вся поринула в воду, тільки гніт і самий кінчик парафіну повинні виступати над водою. Запалити гніт.
Досвід № 7. Свічка за пляшкою
Прилади й матеріали: свічка, пляшка, сірники
Етапи проведення досвіду
Поставити запалену свічку позаду пляшки, а самому стань так, щоб особа відстояло від пляшки на 20-30 см. Варто тепер дути, і свічка згасне, ніби між тобою і свічок немає ніякої перешкоди.
Дослід 8. Вертиться змійка
Прилади й матеріали: щільний папір, свічка, ножиці.
Етапи проведення досвіду
З щільного паперу вирізати спіраль, розтягнути її трохи і посадити на кінець зігнутої дроту.
Тримати цю спіраль над свічкою в висхідному потоці повітря, змійка буде обертатися.
Досвід 9. Парафіновий мотор
Прилади й матеріали: свічка, спиця, 2 склянки, 2 тарілки, сірники.
Етапи проведення досвіду
Щоб зробити це мотор, нам не потрібно ні електрики, ні бензину. Нам потрібно для цього тільки .свічка. Розжарити спицю і увіткнути її їх головками в свічку. Це буде вісь нашого двигуна. Покласти свічку спицею на краю двох склянок і врівноважити. Запалити свічку з обох кінців.
Дослід 10.Вогнетривкі кулька
Знадобиться: 2 кульки, свічка, сірники, вода.
Дослід: Надуйте кульку і потримайте його над запаленою свічкою, щоб продемонструвати дітям, що від вогню кулька лопне. Потім у другій кулька налийте простої води з-під крана, зав'яжіть і знову піднесіть до свічки. Виявиться, що з водою кулька спокійно витримує полум'я свічки.
Дослід 11. Знадобляться: Сірники, ліхтарик.
Досвід: Запаліть сірник і тримайте на відстані 10-15 сантиметрів від стіни. Посвітити на сірник ліхтариком, і побачите, що на стіні відбивається тільки ваша рука і сама сірник. Здавалося б, очевидно, але я ніколи про це не замислювався.
Дослід 12. Горіння солей у полум'ї свічки
Розплавте трохи парафіну.
Кристалики сульфату міді CuSO4 прилипають до парафіну.
Додайте ще шар парафіну, щоб кристалики прилипли надійніше.
Охолодіть верхній шар водою.
Утилізація
Утилізуйте відходи експерименту зі звичайними побутовими відходами.
Що сталося
Чи замислювалися ви, яким чином в феєрверки виходять іскри самих різних кольорів - зелені, червоні і навіть рожеві? Ключ до розгадки - в досвіді, який ви тільки що провели. Неможливо просто взяти і «пофарбувати» полум'я кольоровим речовиною. І чорне вугілля, і коричневе дерево, і білий папір - все горять однаковим жовтим полум'ям. Навіть в цьому досвіді блакитний сульфат міді CuSO4 пофарбував полум'я в зелений колір, а не голубий.
І все ж, є щось в речовині CuSO4, що робить полум'я зеленим. Це його мідний компонент Cu2+. Виявляється, іони металів, наприклад, міді Cu2+, при сильному нагріванні можуть випромінювати світло певного кольору. Мідь світиться зеленим, рубідій Rb червоним, натрій Na (міститься в кухонної солі NaCl) жовтим. Це властивість металів використовується не тільки в різнокольорових феєрверки. За допомогою спеціальних технік хіміки можуть визначити наявність металів в зразку, вивчаючи колір полум'я.
Дослід 13. «Чи можуть чайні пакетики літати?»
Реактиви та обладнання: чайні пакетики, сірники, металева пластина, ножиці
Методика виконання
Увага! Даний дослід проводити за присутності дорослих! Пам’ятати основні правила пожежної безпеки.
1.Розрізати чайний пакетик зверху та знизу; 2. Висипати з чайного пакетику чай; 3. Поставити чайні пакетики вертикально на металеву пластину, розрізами догори; 4. Запалити сірник та підпалити верхню частину чайного пакетику. (Дослід можна повторити з декількома чайними пакетиками.).
Запитання: «Чому підпаливши чайні пакети підіймаються догори?»
Дослід 14. Запалена свічка
1. Щоб досвід гарантовано вийшов, яйце краще добре підготувати. Постарайтеся його не переварити. Зварене яйце потримайте в холодній воді: після зняття шкаралупи білок повинен бути гладким, щоб щільно прилягати до шийки пляшки, не пропускаючи всередину повітря. Очищене яйце занурте в воду. У мокрого (і слизького) яйця більше шансів пролізти в пляшку, ніж у сухого.
2. Підберіть в магазині пляшку, діаметр горлечка якої приблизно відповідає діаметру яйця. Підійдуть пляшки з-під кисломолочних продуктів, соків, кетчупу. Однак дуже старатися не варто: вакуум створює достатню силу, щоб сильно деформувати яйце і протягнути його навіть через вузьке горлечко.
3. Опустити палаючу свічку на дно пляшки може виявитися непросто. Це легше зробити, встромивши прямо в парафін шматок дроту або в'язальну спицю, щоб використовувати її як рукоятку.
Дослід 15. Свічка горить у воді
Напевно ваш малюк вже знає, що погасити вогонь можна заливши його водою або засипавши піском / землею. У нашому досвіді свічка буде горіти в воді. Для цього плавимо кінець свічки і зміцнюємо його на дні чарки. У склянку наливаємо воду, залишаючи 2-3 мм парафіну над водою. Свічку підпалюємо і спостерігаємо. Вже скоро весь парафін над поверхнею води згорить, але свічка не згасне, а буде горіти «з води».
Так може тривати досить довго, в залежності від крихкості парафіну. Весь фокус полягає в тому, що навколишнє вода охолоджує розплавлений парафін і свічка горить як би в циліндрі. Якщо парафіновий циліндр трісне, вода відразу ж заллє полум'я.
Дослід 16. повелитель полум'я
Якщо на свічки не дути, вона буде горіти рівно. Як змусити полум'я відхилитися, чи не впливаючи на нього? Для цього нам знадобиться коктейльна трубочка. Якщо подути з трубочки поруч з полум'ям, то вона відхилиться в сторону потоку повітря.
Дослід 17. «Згораючі маючі кульки»(робоча назва)
Реактиви та обладнання: вода, рідке мило, балон з газом для запальничок, металічна посудина, сірники.
Методика виконання
Налити у металічну посудину води та додати мила. Занурити балон з газом під воду. Натиснути на балон руками та випустити газ (дивитися по бульбашкам). Утворені бульбашки підпалити
Дослід 18. Пінопласт і уайт-спирт. (10 клас).
Реактиви та обладнання: уайт-спирт, пінопласт, склянка об’ємом 50 см3, гумові рукавиці.
Методика виконання
Увага! Даний дослід проводити за присутності дорослих! Пам’ятати основні правила пожежної безпеки!
1.Одягнути гумові рукавиці;2. Поставити склянку на стіл та налийте 20 см3 уайт-спирту; 3. Погрузіть шматочок пінопласту в уайт-спирт.
Запитання: Опишіть кінцевий результат та чому так відбувається?
На наступний урок учитель перевіряє виконання домашнього завдання у 7 та 10 класі. І заносить кількість тих, хто виконав у таблицю 3.3.
Налийте налийте у склянку 10 см3 води та 10 см3 спирту. Поясніть чому виділяється тепло?
Дослід 19.Кипіння води в сірниковій коробці.
Прилади й устаткування: дві сірникові коробки, свічка,
Хід роботи:
1. Взяли 2 сірникових коробки і розібрали їх на частини. Нам знадобилися 2
зовнішніх корпусу і 1 внутрішній. 2. Зовнішні корпусу поставили вертикально на відстані трохи меншому, ніж довжина внутрішнього корпусу.
3. Сам внутрішній корпус поставили на варті зовнішні корпусу зверху. Вийшло щось на зразок столика, ніжками якого служать зовнішні корпусу коробок, а стільницею - внутрішній корпус. Причому внутрішній корпус потрібно поставити поглибленням вгору і налити в це поглиблення воду. 4. Під внутрішній корпус поставили свічку, запалили її і почекали, поки вода в коробці скипить.Теплоємність води набагато більше теплоємності картону з якого зроблені коробки, а це значить, що вода буде відбирати тепло у картону швидше, ніж полум'я буде його гріти.
Висновок: Все тепло полум'я буде йти на нагрівання води, а не на горіння
Дослід 20. Фокус з сірниками
Мета: показати різну температуру в полум'я свічки.
Прилади й устаткування: сірники, свічка.
Хід роботи:
1. Взяли сірник і швидко провели її крізь полум'я, направляючи голівку сірника
через центр полум'я. Сірник не займеться.
Дослід 21. Кільце Ньютона. Для цього досвіду потрібно видути великий мильна бульбашка і посадити його на край склянки,
або чарки, змастивши попередньо край гліцерином.
Позаду мильної бульбашки треба запалити свічку.
Мильна бульбашка заграє чудовими переливами фарб.
Якщо в 80 см від мильної бульбашки поставити запалену свічку, а з іншого боку, в 10 см від нього,
поставити рамку, обтягнуту тонким папером або, калькою, то на паперовому екрані
можна буде розгледіти зображення мильної бульбашки.
А через кілька миттєвостей на екрані з'являться чітко видимі кольорові "кільця Ньютона". Кільця різного кольору будуть переміщатися зверху вниз.
Один колір буде змінювати інший в певному порядку, про який ви, ймовірно, здогадуєтеся!
Дослід 22. Свічка з мила
Свічка з мила
У давні часи свічки виготовляли з стеарину, тому логічно припустити, що роздобув його, ми зможемо виготовити свічку самостійно. Стеарин можна легко отримати з усім відомого господарського мила. А потім візьмемося за свічку. Це цікаве заняття, до того ж свічка з мила, виготовлена самостійно - відмінний подарунок! Отже, приступимо.
Отримання стеарину з мила
Для того щоб з мила виділити стеарин потрібно взяти:
•господарське мило,
• непотрібна каструля,
• столовий оцет,
• дерев'яна ложка для розмішування.
Підготовлене господарське мило (достатньо половини шматка) досить дрібно настругати ножем в якусь стару непотрібну (але чисту) каструлю. Потім додамо води з таким розрахунком, щоб мильна стружка була покрита їй. Починаємо розтоплювати вміст каструлі на водяній бані. Для кращого розчинення час від часу помішуйте суміш дерев'яною ложкою. Коли мило повністю розчиниться в воді зніміть каструлю з вогню.
Тепер обережно вливаємо в суміш оцет. Поступово на поверхні суміші буде з'являтися жовтувата маса. Це і є стеарин. Після охолодження ложкою зберіть його з поверхні. Потім сполосніть його під струменем води і загорніть в паперовий рушник, щоб пішли надлишки вологи.
Виготовлення свічки з мила своїми руками
Тепер приступимо до виготовлення свічки. Розплавте стеарин (як це зручніше зробити вирішуйте самі). Потім візьміть досить товсту мотузку і занурте її в розплав. Зачекайте поки стеарин на гніт застигне. Повторіть процедуру до тих пір поки свічка з мила не придбає бажану товщину. Свічка з мила готова! Спосіб, який ми привели, звичайно вимагає посидючості, але саме таким способом раніше і виготовляли свічки!
Виготовлення свічок з стеарину на заводі Havi Oy Ab (Виборг, 1830-ті рр)
Свічка з мила може бути і фігурної. Але для її виготовлення знадобиться форма. Готуємо форму, просочуємо гніт парою шарів стеарину, закріплюємо гніт і заливаємо розплавлений стеарин, який повністю заповнює форму. Після застигання вийде фігурна свічка з мила. Як бачите теж нічого складного!
Чи знаєте ви, що?
Стеарин - це суміш різних жирних кислот, в основному стеаринової, пальмітинової, олеїнової та ін.
В даний час більшість свічок виготовляють не з стеарину, а з парафіну, який добувають з нафти. З парафіну також отримують вазелін.
Дослід 23. Досліди з активованим вугіллям
Реактиви, які необхідні для досліду:
• зеленку;
• метиленовийсиній;
• аміак;
• воду;
• кілька баночок для дослідів;
• воронку;
• вату.
По краплі зеленки і метиленового синього капнули в воду, щоб вийшли злегка забарвлені розчини. Потім розчавили в ложці п'ять таблеток активованого вугілля і висипали в банку з зеленкою. Така ж кількість подрібнених таблеток аптечного вугілля висипали в розчин метиленового синього. Гарненько перемішали і дали постояти п'ять хвилин.
А через п'ять хвилин відфільтрували за допомогою воронки і вставленого в неї шматочки вати. Ось що вийшло після фільтрування розчину зеленки:
А тут був метиленовий синій:
Як бачите, після фільтрування розчини стали абсолютно прозорими і прозорими. Активоване вугілля має дуже гарні сорбційні властивості і ввібрав в себе весь барвник, зробивши розчин прозорим. На цій властивості ґрунтується використання самих різних вугільних фільтрів - від очищення питної води до очищення нафти від домішок.
Наступний досвід не такий видовищний і особливого враження на сина не справив, але, сподіваюся, хоч щось в голові у дитини залишиться після його проведення. Експеримент полягав в поглинанні запаху за допомогою вугілля.
Ми взяли ще одну баночку, насипали в неї п'ять подрібнених таблеток вугілля, капнули дві краплі розчину аміаку і щільно закрили банку. Через п'ять хвилин запах аміаку зник.
Як бачите, домашні досліди з вугіллям - дуже прості і легкі. До того ж, для їх проведення можна використовувати найрізноманітніші речовини. Наприклад, я взяла зеленку і синьку, а можна взяти йод або чорнило (класичний досвід).
Якщо не подобається запах аміаку, візьміть крапельку духів або туалетної води, якщо не шкода
Загалом, тут є, де проявити фантазію, дерзайте! Успіхів вам і вашим дітям в вивченні навколишнього світу!
XXIV. Класичні задачі
І.Тип задач. Виведення молекулярної формули за відомими масовими частками елементів
1.Виведіть молекулярну формулу вуглеводню, масова частка Карбону в
якому становить 82, 75%, а Гідрогену – 17,25%. Відносна густина пари цього вуглеводню за повітрям дорівнює 2.
- Масова частка Карбону в органічній речовині складає 82,76%, Гідрогену
17,24%. Визначте формулу речовини, якщо відносна густина її за воднем становить 29.
- Знайдіть формулу алкану, якщо: а) молярна маса рівна 100 г/моль, б) якщо відносна густина за повітрям рівна 1,52.
- Визначте формулу бром похідного метану, якщо відносна густина за гелієм складає 23,75
- Знайдіть формулу алкану, якщо: а) молярна маса рівна 78 г/моль, б) якщо відносна густина за повітрям рівна 2,68
- Знайдіть формулу алкану, якщо: а) молярна маса рівна 68 г/моль, б) якщо відносна густина за повітрям рівна 2,34.
- Невідома сполука, яка містить 25 % гідрогену та 75% карбону. Відносна густина за воднем складає 8. Яка ця сполука? Який вплив на навколишнє середовище чинить повний продукт згорання даної речовини(СH4, CO2, глобальне потепління).
- Невідома сполука, яка містить 20 % Гідрогену та 80 % Карбону. Відносна густина за повітрям складає 1,034. Яка ця сполука? Який повний вплив на людину чинить не повний продукт згорання даної речовини(етан, негативний вплив).
- Невідома сполука, яка містить 81,81 % Гідрогену та 18,18 % Карбону. Яка ця сполука? Чи можна вважати дану речовину парниковим газом? (пропан)
- Невідома сполука, яка містить 15,78 % Гідрогену та 84,21 % Карбону. Яка ця сполука? Відома, що ця сполука є одним компонентів нафтових продуктів. У 2012 році сталася катастрофа, розлився танкер з нафтою. Чим для навколишнього середовища це небезпечно, зокрема для мешканців водойм.(октан, задуха риби, нестача повітря)
- Невідома сполука, яка містить 92,03 % Карбону та 7,69 %Гідрогену. Яка ця сполука? Відносна густина за воднем складає 13. ацетилен
- Невідома сполука, яка містить 85,71 % Карбону та має певний відсоток Гідрогену. Відносна густина за повітрям складає 1,44. Знайдіть сполуку.
ІІ.Виведення молекулярної формули за відомими масою, об’ємами
або кількістю речовини продуктів згоряння. Закон Гей-Люссака.
- При спалюванні 30 мл газу було витрачено 150 мл кисню і одержано 90 мл карбон (ІV) оксиду та 120 мл водяної пари. Що це за сполука? Пропан
- Унаслідок спалювання вуглеводню масою 1,5 г утворились
карбон(ІV)оксиду об’ємом 2,24 л (н.у.) та вода масою 2,7 г. Виведіть формулу вуглеводню, якщо відносна густина його за повітрям становить 1,0345.
- У результаті спалювання 7,2 г органічної сполуки, густина парів якої за
воднем дорівнює 36, утворилось 22 г карбону (IV) оксиду і 10,8 г води.
Визначте формулу вихідної сполуки.
- При спалюванні вуглеводню, кількість речовини якого дорівнює 0,1 моль,
утворились карбону (IV) оксид об’ємом 6,72 л (нормальні умови) та вода
масою 72 г. Визначте формулу вуглеводню.
- При повному згоранні вуглеводню 0,1 моль вуглеводню утворюється 0,4 моль вуглекислого газу та 0,5 моль кисню.
- При спалюванні 30 мл вуглеводню було витрачено 60 мл карбон (ІV) оксиду та 90 мл водяної пари.
- При спалюванні 50 мл вуглеводню було витрачено 1500 мл карбон (ІV) оксиду та 200 мл водяної пари.
- Знайдіть формулу вуглеводню, якщо при повному згоранню деякої його маси утворюється 22 г вуглекислого газу і 11,25 г води. Відносна густина за воднем становить 29.
- Знайдіть формулу ненасиченого вуглеводню, якщо при повному згоранню 10 мл утворюється по 30 мл. вуглекислого газу та води.
- Який об’єм вуглекислого газу утворюється внаслідок згорання пропіну об’ємом 30 мл.
- Знайдіть формулу вуглеводню, якщо після його згорання утворилося 0,6 моль вуглекислого газу та 0,3 моль води. Відносна густина за повітрям складає 2,69.
- Обчисліть об’єм газової суміші, яка складається з 8 г метану та 22,5 г етану.
- Який об’єм вуглекислого газу утвориться в наслідок згорання 120 л суміші (н.у.), що містить 20% етану та 80 % бутану.
- Спалили 100 л еквімолярної суміші метану та етану (за н.у.). Який об’єм кисню витратився?
- Який об’єм повітря витратися при згорання 5 л метану?
- У наслідок спалювання 18 г невідомого вуглеводню одержали 26,88 л вуглекислого газу (н.у.). Відомо, що 5,33 л (н.у.) цього вуглеводню мають масу 7,14 г. Установіть молекулярну формулу вуглеводню.
- Який об’єм повітря необхідний для повного спалювання (об’ємна частка кисню рівна 21 %) а) 40 л. бутану; б) 200 л суміші метану і етану, обємна частка якого в якій 40%; в) 30 мл пропану; г) 1,6 кг метану;
- Масова частка Карбону у вуглеводні рівна 85,71 %, відносна густина парів який рівна за повітрям 2,414. Установіть формулу вуглеводню.
- У наслідок спалювання 6,2 г невідомого вуглеводню одержали 19,46 г вуглекислого газу і води 7,97. Густина парів вуглеводню якого складає 2,414. Установіть молекулярну формулу вуглеводню.
- Спалили 0,5 моль невідомого вуглеводню. Я утворилося 22,4 л СО2 та 1 моль води. Установіть формулу сполуки.
- На спалювання 200 мл невідомої органічної речовини витратили 900 мл кисню. Утворилося 600 мл карбон(ІV) оксиду і 600 мл водяної пари. Усі виміри виконані за н.у. Установіть формулу вуглеводню.
ІІІ.Здійснити перетворення
1. Продовжіть схему:
C → CH4 → C2H2 → C6H6
C+2H2 → CH4
CH4→C2H2+H2↑
3C2H2 → C6H6
1.Як називаються речовини CH4, C2H2, C6H6?
2.Продовжіть ланцюги:
а)Х →CH4 → Y
б)Х → C2H2 → Y
в)Х → C6H6 → Y
Напишіть, всі можливі речовини Х та Y.
XXIV.Компетенсні задачі
Як впливає на здоров’я людини речовина C6H6. Чому бензен маркують? Що означають ці зображення? 

XXV. Компетентнісні задачі
Задача 1.Скільки видходів зробить середньостатистична людина за 1хв. і який об’єм СО2 при цьому виділиться. Якщо для визначення вмісту пропонується розчину V(NaOH) = 40 см3 з об’ємною часткою 96 %, який вуглекислий газ поглинає. Прийняти, що середня об’ємна частка вуглекислого газу складає 4 %. Цикл «вдих-видих» складає в середньому об’єм який вдихається рівний 500 см3, а об’єм видихуваного складає 150 см3 Прийняти, що за 1хв. в середньому робить 16 вдовів.
Намалюйте схему установки та запропонуйте схему визначення.
Пропишіть хімізм даного процесу.
2.В чому суть механізму газообміну у легенях? 2.Поміряйте пульс у стані спокою та при фізичних навантаженнях. Чому збільшується кількість вдовів, Чому фізичній активності людина пітніє? З чим це пов’язано? Пояснісніть це з хімічної точки зору.
3.Чому при руховій активності та коли, людина хвора підвищується кількість вдохів?
Задача 2.Петренко Петром Петровичем хоче придбати собі автомобіль, але в нього вникло питання яке авто йому придбати. Вибір ліг між електромобілем чи авто з бензиновим двигуном. В нього є два критерії це, щоб автомобіль екологічний та економічний. До цього Петренко не мав авто в нього виникли ряд запитань. Він хоче задати запитання до фахівця. Допоможіть Петренку і розібратися у даній проблемі?
Петренко зупинив вибір на двох машинах це БМВ xDrive35i та машині «Тесла моторс». Проконсультуйте Петренка серед питаннях і порекомендуйте машину, яку йому варто взяти.
Консультативні питання:
1. З чого складається бензин?
2.Що таке октанове число?
3. Що таке цитатне число?
4.В чому різниця між марки бензинів А-76, А-80, А-86, А-92, А-95, А-98.
5.Який транспорт екологічні ший той, що на бензиновому паливі чи той, що електромобілі?
6.Який з автомобілів є екомішніше вихідніший електротраспорт чи електротранспорт.
7.Чи відповідає дане дизельне паливо стандартам?
8. Чи можна використати етиловий спирт для палива.
9. Які речовини ще окрім бензину використовують як томливо?
10. Який з рештою придбати автомобіль (згідно двома критеріями).
Задача 3.Проблема екологічності автомобілів виникла ще в середині ХХ століття, коли машини стали масовим продуктом. Європейські країни, перебуваючи на порівняно невеликій території, раніше інших почали застосовувати різні екологічні нормативи. Вони існували в окремих країнах і включали різні вимоги до вмісту шкідливих речовин у вихлопних газах у автомобілів.У 1988 році Європейською економічною комісією ООН був введений єдиний регламент (так званий Євро-0) до вимог знизити рівень викидів окису вуглецю, оксиду азоту та інших речовин в автомобілях. Раз на кілька років вимоги посилювалися, інші держави також стали вводити подібні нормативи. З 2015 року у країнах ЄС діють норми по викидам шкідливих речовин в атмосферу відомі як Євро-6.
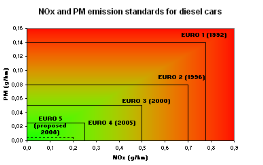
Проаналізуйте графік і встановіть відмінність між різними стандартами Євро 1,2,3,4,5.
Задача 4. На 100 км машина БМВ xDrive35i споживає 10,9 л. Машина споживає бензину з октановим числом А-95. Прийняти, що одним із кінцевих продуктів згорання є СО. Скільки кілометрів проїде машина при повному заповненому баку і який об’єм при цьому виділився СО? Прийняти, що густина бензину 0,71 г/см3.
Задача 5. Відомо, що у Швеції не вистачає сміття для переробки і вона закупляє його в інших країнах. Цей процес можна назва «гроші із сміття». Дослідження свідчать, що склад побутових відходів приблизно такий :папір 41%, харчові відходи 21%, скло 12%, залізо та його сплави 10%, пластмаси 5%, деревина 5%, гума та шкіра 3%, текстильні матеріали (тканини) 2%, алюміній 1%, інші метали 0,3%. Навіщо переробляти сміття? З яких продуктів можна отримувати природний газ? Чим загрожують сміттєві звалища? Чим небезпечний звалищний газ? До яких простих речовин розкладаються органічні речовини? Скільки виділять метану на звалищах в Україні?
Задача 6. Уявіть, що ви присутні на наземному випробуванні ядерної бомби. Оглядовий майданчик знаходиться в 16 км від місця вибуху, а вибухова хвиля доходить до неї приблизно за 40 секунд. Легкі шматочки паперу, кинуті в момент проходження ударної хвилі, падають на землю, відхилившись від своєї початкової позиції приблизно на 2,5 метра через ударної хвилі. Можна вважати, що вітру немає, а атмосферний тиск - нормальне. Виходячи з цих даних визначте потужність вибуху в тротиловому еквіваленті.
Задача 7. Який відсоток вміст пропан-бутанової суміші у балоні 50 л, якщо при 273 К густиною 580 кг/м3, бутану 392 кг/м3 і тиску 101,425 кПа. Розрахувати об’єм. Чому у газових балонах зріджують газ, наприклад, пропан та бутан. Відповідь підтвербте обрахунками.
Задача 8. Скільки потрібно дерев засаджених на футбольному полю, щоб поглинути такуто кількість 300 л СО2, якщо:
1 дерево в середньому протягом 1 року поглащает 120 кг СO2, і приблизно стільки ж виділяє кисню
1 автомобіль поглинає цей же об'єм кисню (120 кг) приблизно при спалюванні близько 50 літрів бензину, і виробляє різні вихлопні гази (їх склад зазначений в таблиці)
Задача 9.Яке з видів палива природній газ чи нафта(бензин та дизельне паливо) чинить на навколишнє середовище більше. Відповідь підтвердьте обрахунками. Для простоти прийміть об’єм кожного з палив по 10 л.
Задача 10.Яке з видів палива природній газ чи нафта(бензин та дизельне паливо) чинить на навколишнє середовище більше. Відповідь підтвердьте обрахунками. Для простоти прийміть об’єм кожного з палив по 10 л.
Задача 11. Чому газовий балон з пропаном

Як правильно зберігати газові балони? Чи можливо п'ятидесятилітровий балон повністю заповнити газом? Якщо ні, то скільки приблизно відсотків зможе зайняти газ (пропан)? 2. І чи можливо заправити більше, якщо потрясти балоном?
Задача 12. Проаналізуйте дане зображення:
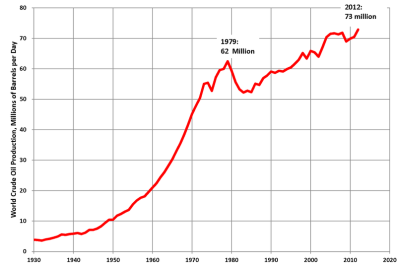
Про яке паливо йде мова?
Чому споживання його збільшується
Задача 13. Фреон-114 хладоагент відомий як тетрафтордихлороетан. Напишіть його структурну формулу та всі можливі ізомери (екологічна та предметна компетентність).
Задача 14. Тетрафтордибромоетан – дуже ефективний засіб боротьби з вогнем. Напишіть всі можливі способи ізомери даної сполуки. (предметна та екологічна компетентність).
Задача 15. Як відомо, що на Землі на останні 40 років зростала велика кількість парникових газів. Поцікавтеся хто на найбільше виділяє вуглекислого газу. Чи правда, що терміти виробляють більше вуглекислого газу, ніж вся людська промисловість за рік? (екологічна компетентність).
Задача 16. Існує проблема з великою кількістю вуглекислого газу. На щастя не все так песимістично є в хімії речовини, які поглинають СО2. Допоможіть вирішити проблему масового викиду СО2, запропонуйте реактиви, що зможуть про взаємодіяти з ним (екологічна, предметна).
Задача 17. Під час очищення стічних вод, які містять органічні речовини, методом бродіння виділяється газ з відносною густиною за киснем 0,5. Його використовують на водоочисних станціях як паливо. Що це за газ? (хімічний та екологічний)
Задача 18. У присутності каталізатора метан може частко окислюватися, утворюючи карбон(IІ) оксид. Що при цьому утворюється і чи може дана реакція мати практичне значення.(екологічний компонент).
Задача 19.Невідома сполука, яка містить % гідрогену та % карбону. Яка ця сполука? Цим газом заправляють машини на автозаправках. Кінцевим продуктом цього вуглеводу є згорання до утворення СО2. Підберіть хімічні реакції, які могли б поглинути велику кількість СО2. (бутан, натрій гідрооксид, вода, натрій гідроген карбонат).
Задача 20. Завдання містять компетентнісну складову як в умові задачі так і її формулюванні. Закріплення екологічних знань було дано завдання за допомогою онлайн-калькулятора розрахувати свій власний екологічний вплив на Земля за допомогою веб ресурсів:
https://footprintcalculator.henkel.com/ru
http://jalajalg.positium.ee/?lang=RU
Задача 21.Яка різниця між поліетиленом та ПВХ у будові, хімічних властивостями. 1.Опишіть за зовнішнім виглядом два матеріали. 2. Де використовуються поліетилену та ПВХ. 3.Який пакет доцільніше використовути: виготовлений з целюлози чи поліетиленовий, зважже екологічний та економічні аспекти. 4. Чи перероблюються поліетилену та ПВХ? 5. Як відрізніти поліетилену та ПВХ чи впливають на здоров’я людини продукти, які фасують поліетиленом
Задача 22. В результаті згорання цигарок, утворюється побічний продукт із гібридизацією sp, гарно взаємодіє з гемоглобіном. Що це за газоподібна речовина?
Задача 23. Невідома сполука, яка містить 18,18 % Гідрогену та 81,82% Карбону. Яка ця сполука? Який повний вплив на людину чинить не повний продукт згорання даної речовини(етан, негативний вплив).
Задача 24. «Операція И» зокрема новелу («Операція И») в епізоді Трус дістає з аптечки речовину, яку вмокав на хустинку і тренерувався на Бувалому та Балбесу Яку речовину дістав з аптечки Трус? Знайдіть формулу цієї речовини та намалюйте її структурну формулу. Поясніть чому Трусу використав саме цю речовину. В: хлороформ, анестетик)
Задача 25. Тетрафтордибромоетан – дуже ефективний засіб боротьби з вогнем. Напишіть всі можливі способи ізомери даної сполуки. Дайте відповідь на наступні запитання:
1.Чому валентність Карбон не може бути більша, ніж чотири?
2.Визначте тип гібридизації метану, етану та етину.
3.Що називають π-зв’язком?(предметна компететність)?
Задача 26. Моделювання молекул деяких органічних сполук. Для цього спочатку моделюють будову молекул етену (див. рис. 4) з пластиліну та порівнюють із зробленою моделлю етину (див. рис.).

Задача 27. Хтось називає, що це «гроші з повітря». Громадяни Швеції ЙОГО купляють і повністю переробляють і заробляють мільйони, в Японії ЙОГО використовують як будівельний матеріал. В середньому один українець в 2016 році викинув його 350 кг. Про йде мова? Звичайно ж мова йти про сміття. В Європейському союзі дану проблему давно було вирішено. Лише 7% відходів від згаданого числа відсортовуються і спалюються на сміттєспалювальному заводі. А решта 93% (тобто 13,02 тон сміття) потрапляє на сміттєзвалища, які на сьогодні займають 5% території країни, тобто — цілу область! З 1 тонни побутових відходів можна отримати 150-250 м3 звалищного газу з вмістом метану 60-80%. Оцініть скільки метану можна отримати з 8,5 тон сміття (за приблизними даними за 2017 рік).
Задача 28. Обчислити масу карбон діоксиду, яка поступила в атмосферу в 1965 роцi i визначити, яку частку складають техногеннi рiчнi надходження цiєї речовини вiд її загального запасу в атмосферi. Умови розрахункiв: а) протягом 1965 р. на планетi спалили вугiлля масою 2241 млн. тонн, нафти (з октану) – 1867 млн.тонн, деревини (прийняти, складається з целюлози) – 974 млн.тонн i природного газу(прийняти, що складається з бутану) – 880 млн.тонн; б) масовi частки карбону у вугiллi, нафтi дорiвнюють 0,80; 0,85 i 0,50 вiдповiдно; в) маса СО2 в атмосферi складає 2,4*1012 т.
Задача 29. Карбід кальцію розміром 50 × 80 мм розкладається повністю протягом 13 хв, невідомо. За який час розміром 8 × 15 мм згорить шматочок карбіду?
Задача 30. За годину легені людини поглинають 600 л повітря. Знайдіть об’єм та об’ємну частку СО2 у класній кімнаті, якщо об’єм класної кімнати рівний 280 м3, кількість учнів, що навчається у класі 24, об’ємна частка CO2 у повітрі, що видихається складає 4 %, температура класної кімнати складає 20 градусів. Який об’єм CO2 припадає на одного учня?
Задача 31. За годину легені людини поглинають 600 л повітря. Обчисліть об’єм та об’ємну частку СО2 у класній кімнаті за температури 20 °С, якщо об’єм класної кімнати рівний 280 м3, кількість учнів, що навчається у класі 24, об’ємна частка CO2 у повітрі, що видихається складає 4 %. Який об’єм CO2 займе при температурі 25 °С, якщо можна прийняти, що тиск при 20 °С і 25 °С однаковий. Який об’єм CO2 припадає на одного учня при температурі 20 °С? Дайте відповідь на наступні запитання
1.Як впливає збільшення вмісту СО2 на організм людини.
2.Запропонуйте хімічні речовини, які поглинають СО2.
Задача 32. Визначте кількість тепла що виділиться при спалюванні 18 барелів (н.у.) пентан-гексанової суміші, якщо її густина за гелієм складає 15, а теплота згорання пентану рівна 202 кДж/моль, а гексану – 240 кДж/моль
Задача 33.
1936 році сталася катастрофа. Як потім встановила комісія внаслідок загорання пристрою загинуло багато людей. Дерижабль – це про образ перших літаючих засобів. Дерижабль складається з водню та генію. Чому на Вашу думку сталася катастрофа


Задача 34. Об’єм Свiтового океану 1370 млн.км3(при н. у. ),а воднiй краплi води (0,03 см 3)мiститься 250 млрд .атомiв урану –235.Оцiнiть масу урану в Свiтовому океанi i порiвняйте його запаси в океанiчнiй водi з запасами в розвіданих родовищах насушi–18млн.т.
Задача 35.Гранично допустима концентрація фенолу з місць водокористування складає 0,001мг/л. Обчислiть у скiльки разів концентрація фенолу буде перевищувати гранично допустиму,якщо у водоймище ємкістю 100м3зводними стоками коксо хімічного виробництва буде скинуто фенол масою 34 кг?
Задача 36. Пiд час експлуатації заводу протягом 15 рокiв водн iстоки скидалися у водоймище мiсткiстю 10000м3.Чи можна вважати цей завод екологічно чистим, якщо за цей перiод скинуто 10 кг фенолу, гранично допустима концентрація якого дорівнює 0,0001мг/л?
Задача 37.На заправках АЗС в Україні за 2017 рік було придбано 1,44 мільйона тонн бензину та пропан–бутанової суміші 713 тисяч тонн.Прийняти,що бензин складається з октану.Яке з даних видів палива найбільше викидає вуглекислого газу(прийняти за н.у.)та має най більший вплив навколишнє середовище?
ХХVI.Мікрофон. Дайте визначення.
Горіння, полум'я, займання, загоряння, спалахування самоспалахування самозаймання,тління, продукти горіння, горючий матеріал,негорючий матеріал, важкогорючий матеріал гасіння пожежі, вогнегасна речовина, вогнезахист, вогнезахисна речовина (суміш) вогнестійкість, межа вогнестійкості ступінь вогнестійкості.
XXVII.Прекладіть на англійську мову терміни
|
Укр |
Англ. |
|
Паливо |
Fuel |
|
Нафта |
|
|
Газ |
|
|
Етан |
|
|
Закон Хаббла |
|
|
Вугілля |
|
|
Перетворення енергії |
|
|
Сланцевий газ |
|
|
Свічка |
|
|
Вуглекислий газ |
|
|
Чадний газ |
|
|
Кисень |
|
|
Горіння |
|
|
Самозаймання |
|
|
Неповне горіння |
|
XXVIII.Руйнівники міфів. Відповідь так або ні
- Стрілянина по бензобаку приведе до вріву
- Чим можна заткнути вихлопну трубу
- При стрільбі можна ховатися за дверима автомобіля
- Цукор в бензобаку буде заважати роботі автомобіля
- Якщо монетку засунути у карбюратор вона його зламає
- Якщо смішать відбілювач і машинне масло, то зламає двигун
- Розлитий бензин можна підпалити сигаретою.
ХХІХ…
Додаток
Етюд «Мы богаты»
— Это пластмасса! Настоящая пластмасса. Господи, Лили, мы богаты! ТЫ богата!
Под безжалостным солнцем пустыни переливалась и сверкала мутноватыми гранями самая настоящая пластиковая бутылка из-под “Кока-Колы”.
Знал ли я получасом ранее, что моя младшая сестра играя в песочнице найдет сокровище ушедшей эпохи? И подумать не мог. С утра я проснулся обычным жителем граничащих с пустыней трущоб, а к вечеру моя младшая сестричка уже тащила меня в самый дорогой ресторан округи. И всё благодаря одной несчастной пластиковой бутылке.
Безумно, правда?
Когда-то человечество исчерпало все запасы нефти. Лучшие умы принялись искать решение проблемы недостатка топлива. Одно за другим появлялись альтернативные решения: биотопливо, солнечная энергия, сверхпроизводительные микросхемы и механизмы, обратное преобразование продуктов нефтепереработки в топливо, но всего этого было недостаточно. Слишком поздно люди задумались о том, чем же заменить такую привычную, но, как выяснится позже, внезапно истощаемую нефть.
Все попытки предотвратить энергетический кризис были тщетными. Тот подкрался и медленно задушил почти всё: промышленность, транспорт, коммуникации. Последняя капля нефти на планете вот-вот должна была сгореть.
Остановились роботизированные заводы, застигнутые врасплох нехваткой электричества. Не выехал на привычные рейсы городской транспорт.
Города, порожденные изобилием магазинов с охлажденной едой и офисов с охлажденными клерками, сначала вспыхнули войнами за ресурсы, а затем, когда консервы и менее удачливые искатели пропитания были съедены, просто прекратили существовать. Человечество искало способы выжить и находило их в натуральном хозяйстве. Неохотно оскопленная вырубкой лесов земля давала своим детям какие-то плоды.
Ученые же, по иронии судьбы лишившиеся электроснабжения в лабораториях, занимавшихся разработкой новых источников оного, были вынуждены приостановить, а то и закрыть свои опыты. Кто-то продолжил работать у себя в гараже, а кто-то просто бросил бесполезную войну против истории и просто попытался жить дальше. Разве что почти сразу после Кризиса, через месяц или два, один гений изобрел двигатель, способный работать на пластике.
Свалки сразу же наполнились искателями топливных сокровищ, словно во времена золотой лихорадки. В первые же месяцы весь пластик на континенте был собран и преобразован в топливо. Впрочем, и этого хватило ненадолго: цена пластмассы только продолжала расти, и вскоре та сравнялась с золотом, а затем и перевесила его.
С тех пор прошло много лет. Двести пятнадцать, если быть точным. На сто девяносто пятый год после кризиса родился я, а на двести восьмой — эта светловолосая непоседа Лили, моя сестра. Не знаю, как было раньше, но в нашей семье не происходило чего-то плохого, сколько себя помню. Небольшой участок земли приносил скромные урожаи, а мы, дети, кое-как играли всем, на что хватит воображения.
Я не могу сказать, что мое детство было плохим. И по малышке Лили такого тоже не видно. Когда-то я, как и она, бегал по округе с друзьями и собирал себе игрушки из запчастей от старых бензиновых машин. Барахтался в песочнице в нашем дворе, устраивая там окопы для игры в войну за супермаркет.
Но я не был так увлечен играми и весельем, как моя сестренка. Она, наверное, была даже слишком целеустремленной в своем детстве. Когда-то, в порыве педагогического усердия отец сказал Лили, что каждое утро нужно делать зарядку, если она хочет вырасти сильной и ловкой.
С тех пор моя сестра не пропустила ни одной утренней зарядки.
Как бы вы назвали ребенка, который планирует, как именно и во что будет играть на неделю вперед?
Лили Мастерс.
Кто выучил тригонометрию просто потому, что “захотелось узнать что-то новое, всего-то”?
Лили Эвелин Мастерс.
Сегодня у Лили по плану была “Машштабная защитная операцыя по укреплению стротегически важного бьекта “Песочница”
И именно этим она занималась всё утро — размахивала маленькой детской лопаткой, словно заправский солдат, роющий свой окоп. Яма в песочнице прибавляла в размерах и уже была явно глубже, чем я когда-либо закапывался вместе с друзьями.
И вот, очередной удар лопаты о сухую почву отдался глухим треском вместо привычного шороха.
— Макс? — неуверенно позвала Лили, — я что-то нашла.
Я напрягся. Смутные времена после Кризиса принесли много неприятных сюрпризов: неразорвавшиеся снаряды прошлых столетий, пехотные мины и множество механических ловушек, изобретенных в мире, где что-то взрывать было непозволительно дорого.
Приблизившись к внушительной траншее, вырытой сестренкой, я увидел на дне что-то… гладкое?
Округлые формы переливались в почти полуденном солнце мутноватыми отсветами.
Это точно была не ловушка. Но что?
Я протянул руку и дернул из земли… бутылку.
Пластиковую, мать ее, бутылку.
— Это пластмасса! Настоящая пластмасса. Господи, Лили, мы богаты! ТЫ богата!
Под безжалостным солнцем пустыни переливалась и сверкала мутноватыми гранями самая настоящая пластиковая бутылка из-под “Кока-Колы”.
— Что? У нас во дворе была?... — челюсть сестренки отвисла, а она сама так и села посреди ямы, моментально утрачивая вид “Ребенка, у которого всё уже спланировано”.
— Да! Да, черт возьми! Пап, пааап, — я спешил поделиться хорошей новостью с отцом, но тут же осекся. Нельзя так просто кричать что ты нашел целую пластиковую бутылку. Об этом мог услышать кто-нибудь лишний…
— Так, Лили, беги в дом вместе с бутылкой, она твоя. Только постарайся не сильно её светить, ладно?
— Ладно, — кивнула сестра и, запихнув находку под кофту, рванула в дом.
Через считаные мгновения я уже захлопывал входную дверь и задвигал шторы.
Еще полчаса спустя мы вместе с отцом весьма выгодно продали бутылку и направлялись домой. Денег было не то, что много, а очень много. Настолько, что даже дети Лили смогут иметь по собственному дому с рождения. То, что деньги были именно её даже не обсуждалось.
— Макс, — позвала Лили посреди очередной игры в “Траншею Обороны Торговых Центров”. Поскольку она была самой организованной из нас, именно ее вещи были сложены в сумки первыми и полностью готовы к переезду в новый дом.
— Да?
— Кажется, мы не будем переезжать, — голос сестренки звучал обеспокоенно.
Я бросил удивленный взгляд в ее направлении.
— Что такое? Ты передумала?
— Нет… — озадаченно ответила Лили, — просто тут…
Приблизившись к ней, я увидел, что было “тут”. Из очередной траншеи торчал уголок пластмассового контейнера с дюжиной бутылок всё той же Кока-колы.
Перекажіть суть тексту.
Ресурси цікаві для розвитку
- док фільм «Люди, построившие Америку»
- худ фільм «Нефть»
- книга «Добыча: Всемирная история борьбы за нефть, деньги и власть»
- док. Фільм «Разрушители легенд»
- док. Фільм «Як ето работает?»
- Inventions That Shook The World
- Journey to the Edge of the Universe (National Geographic)
Тема 1. Паливо: утворення, види палива, запаси палива, вплив на довкілля
Рух – це життя
Спалювати нафту, все одно, що топити піч асигнаціями
Д.І. Менделєєв.
Доброго дня! Діти!
Які умови необхідні для існування людини первісної? (вогонь, вода, зброя)?
Які умови необхідні для існування сучасної людини?
Який компонент важливий у економіці ?
Чи може машина поїхати без бензину?
Звісно мова сьогодні йтиме про паливо?
Сьогодні на уроці ми розглянемо (див. рис)

Альтернативні малюнки


Відповідь: паливо.
Навіщо потрібне паливо?
Все своє життя людина намагається покращити свої умови життя. Для цього необхідно постійно розвиватися і еволюціонувати. Якщо ви зробили, щось нове удосконалили його це вже можна вважати технологією, яка переходить у більш широке значення як цивілізація.
Паливо в широкому сенсі слова – це речовина, здатна виділяти енергію в ході певних процесів, яку можна використовувати для технічних цілей Призначенням будь-якого пристрою для спалювання палива є перетворення хімічної енергії палива в теплову енергію продуктів згоряння, яка, в свою чергу, або передається іншим робочим тілам (вода, пар), або перетвориться в механічну енергію (газова турбіна, реактивний двигун). Хімічне паливо виділяє енергію в ході екзотермічних хімічних реакцій при горінні, ядерне паливо в ході ядерних реакцій.
Які існую види палива?
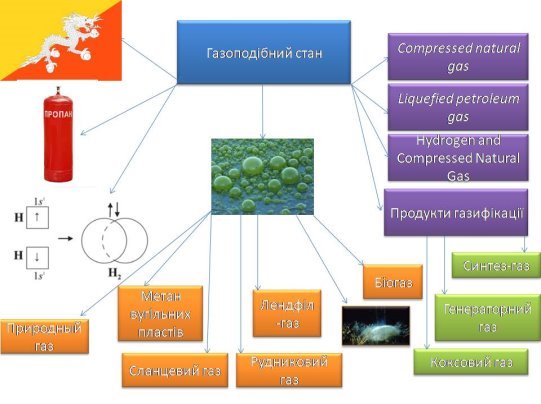
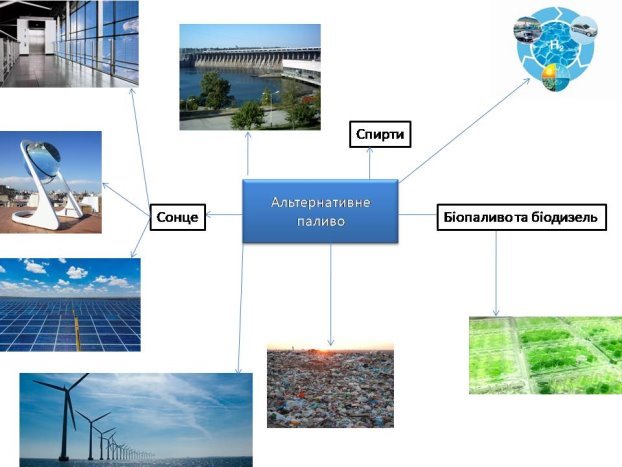
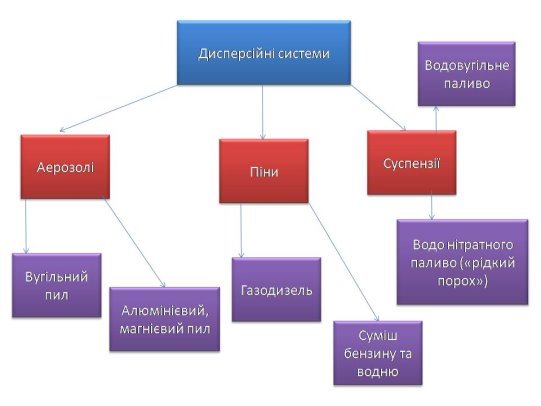
Як утворилося паливо?
Основними природними джерелами вуглеводнів є природні гази, нафта та кам'яне вугілля.



Усі природні джерела вуглеводнів утворювалися протягом багатьох мільйонів років із решток відмерлих організмів, які, при потраплянні на великі глибини, втрачали здатність окиснюватися та вступати у взаємодію з іншими речовинами
ПРИРОДНИЙ ГАЗ. Його поклади утворюються внаслідок розкладання решток відмерлих організмів в умовах відсутності кисню, тож він існує лише на великих глибинах.

НАФТА (АБО Ж ПЕТРОЛІУМ — “СКЕЛЬНЕ МАСЛО”) Утворення нафти є результатом тиску тонн піску та бруду на рештки морських рослин і тварин, чия маса перетворювалася на темну рідину, яка, в свою чергу, проникала в пори скель.
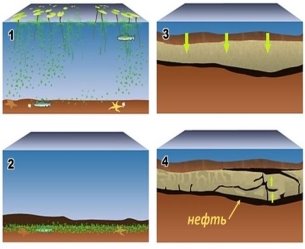
КАМ'ЯНЕ ВУГІЛЛЯ. Поклади кам'яного вугілля утворилися з величезної кількості рослинної маси, яка, не встигнувши повністю розкластися в болотах, спресовувалася ґрунтами, перетворювалася на пласт торфу, а той, у свою чергу, на вугілля.
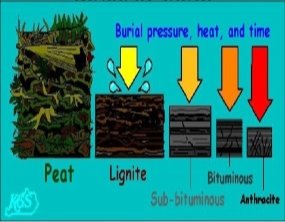
Резюмуюючи: Отже, всі природні вуглеводні, які допомагають нам комфортно жити в цьому світі, утворилися протягом багатьох мільйонів років і для їхнього відновлення потрібно не менше. Тож бережімо природу!
Що ми знаємо про основні джерела вуглеводнів?
Основними природніми джерелами вуглеводнів є природні гази, нафта та камяне вугілля. Склад пририроднього газу є різним
Як утворюється метан?
МЕТАНОГЕНЕЗ.
Метаногенез у мікробів є формою анаеробного дихання. Метаногени не використовують кисень для дихання; насправді кисень пригнічує зростання метаногенів. Кінцевий акцептор електрона в метаногенезі – не кисень, а вуглець. Вуглець може відбуватися в невеликій кількості органічних сполук, всі з низькою молекулярною масою. Два найкращі описані шляхи включають використання оцтової кислоти або неорганічного діоксиду вуглецю в якості кінцевих акцепторів електронів:
CO2 + 4 H2 → CH4 + 2H2O
CH3COOH → CH4 + CO2
Під час анаеробного дихання вуглеводів утворюються H2 і ацетат у співвідношенні 2: 1.
Ацетокластичний метаногенез – артея розщеплює ацетат, що утворюється під час анаеробної ферментації для отримання метану і вуглекислого газу.
H3C-COOH → CH4 + CO2
Гідрогенотрофний метаногенез – археї окислюють водень діоксидом вуглецю з отриманням метану і води.
4H2 + CO2 → CH4 + 2H2O
Хоча ацетокластичний метаногенез і гидрогенотрофний метаногенез є двома основними вихідними реакціями для атмосферного метану.
Однак, в залежності від рН і температури, було показано, що метаногенез використовує вуглець з інших дрібних органічних сполук, таких як мурашина кислота (форміат), метанол, метиламіни, тетраметиламоній, диметилсульфід і метантиол.
Зворотний метаногенез
Деякі організми можуть окислювати метан, функціонально змінюючи процес метаногенезу, також називають анаеробним окисленням метану (АОМ). Організми, що виконують АОМ, були знайдені в багатьох морських і прісноводних середовищах, включаючи метан, гідротермальні отвори, прибережні відкладення і зони переходу сульфатно-метанових. Зворотний метаногенез відбувається за реакцією:
SO42− + CH4 → HCO3− + HS− + H2O
Значення в циклі вуглецю
Метаногенез є заключним етапом розпаду органічної речовини. Під час процесу розпаду акцептори електронів (такі як кисень, тривалентне залізо, сульфат і нітрат) виснажуються, а водень (H2) і діоксид вуглецю накопичуються. Легкі органічні речовини, отримані при ферментації, також накопичуються. На передових етапах органічного розпаду всі акцептори електронів виснажуються, за винятком вуглекислого газу. Вуглекислий газ є продуктом більшості катаболічних процесів, тому він не виснажується, як інші потенційні акцептори електронів.
Тільки метаногенез і ферментація можуть відбуватися за відсутності інших акцепторів електронів, крім вуглецю. Ферментація дозволяє лише розщеплення більших органічних сполук і виробляє невеликі органічні сполуки. Метаногенез ефективно видаляє напівфабрикати розпаду: водень, дрібні органіки і вуглекислий газ. Без метаногенезу велика кількість вуглецю (у вигляді продуктів бродіння) накопичуватиметься в анаеробних середовищах.
Утворення у
У жуйних
Кишкове бродіння відбувається в кишечнику деяких тварин, особливо жуйних тварин. У рубці анаеробні організми, включаючи метаногени, перетравлюють целюлозу у форми, які живильні. Без цих мікроорганізмів такі тварини, як худоба, не могли б споживати трави. Корисні продукти метаногенезу поглинаються кишечником, але метан звільняється від тварини головним чином шляхом відрижки (відрижки). Середня корова виділяє близько 250 л метану на добу. Таким чином, жуйні тварини вносять близько 25% антропогенних викидів метану. Одним з методів контролю виробництва метану у жуйних тварин є їх подача 3-нітрооксипропанолом
У людини
Деякі люди виробляють газоподібний газ, що містить метан. В одному з досліджень фекалій дев'яти дорослих п'ять зразків містили археї, здатні виробляти метан. Аналогічні результати знайдені у зразках газу, отриманих з прямої кишки.
Навіть серед людей, у яких газові склади містять метан, кількість знаходиться в межах 10% або менше від загальної кількості газу
У рослинах
Багато експериментів показали, що тканини листя живих рослин виділяють метан. Інші дослідження показали, що рослини фактично не виробляють метан; вони просто поглинають метан з грунту і потім випускають його через свої тканини листя.
Грунти
Метаногени спостерігаються в безкисневих грунтах, сприяючи деградації органічної речовини. Ця органічна речовина може бути розміщена людьми через полігон, похований як осад на дні озер або океанів як відкладення, і як залишкові органічні речовини з опадів, що утворилися в осадових породах.
Антропогенні джерела атмосферного метану
Трохи більше половини загальної емісії відбувається за рахунок людської діяльності. З часу промислової революції люди мали значний вплив на концентрації атмосферного метану, збільшуючи атмосферні концентрації приблизно на 250%
Екологічна конверсія
Перетворення лісів і природних середовищ на сільськогосподарські ділянки збільшує кількість азоту в ґрунті, що пригнічує окислення метану, послаблюючи здатність метанотрофних бактерій у ґрунті діяти як поглиначі. Крім того, змінюючи рівень водної маси, люди можуть безпосередньо впливати на здатність грунту діяти як джерело або раковина. Взаємозв'язок між рівнями грунту та викидами метану пояснюється у водно-болотних угіддях природних джерел.
Тварини з ферми
У звіті ФАО ООН за 2006 рік було зазначено, що тваринництво виробляє більше парникових газів, що вимірюється еквівалентами CO2, ніж весь транспортний сектор. На тваринництво припадає 9% антропогенного CO2, 65% антропогенного закису азоту та 37% антропогенного метану. Високопосадова особа ООН і співавтор доповіді, Хеннінг Штайнфельд, сказав: "Тваринництво є одним з найбільш значних вкладників у найсерйозніші екологічні проблеми сьогоднішнього дня".
Останні дослідження NASA підтвердили життєво важливу роль кишкового бродіння в тваринництві на глобальне потепління. "Ми розуміємо, що сьогодні інші парникові гази, крім діоксиду вуглецю, є важливими для зміни клімату", - заявив Гавін Шмідт, головний автор дослідження та дослідник Інституту космічних досліджень "Годдард" у Нью-Йорку, Нью-Йорку та Колумбійському університеті. Системні дослідження. Інші недавні рецензовані дослідження NASA, опубліковані в журналі Science, також показали, що внесок метану в глобальне потепління був недооцінений.
Ніколас Стерн, автор огляду Стерну 2006 року про зміну клімату, заявив, що "люди повинні повернути вегетаріанство, якщо світ переможе зміни клімату". Президент Національної академії наук Ральф Цицерон (вчений-атмосфер) вказав на внесок метану в метеоризм худоби і відривання до глобального потепління є "серйозною темою". Цицерон стверджує, що "метан є другим найбільш важливим парниковим газом в атмосфері. Населення м'ясної худоби та молочної худоби зросло настільки, що метан у корів зараз великий. Це не тривіальна проблема".
Приблизно 5% метану вивільняється через газоподібний газ, тоді як інші 95% вивільняються через відрижку. Вакцини знаходяться на стадії розробки, щоб зменшити кількість, що вводиться через відрив.
Рисове сільське господарство
Завдяки постійно зростаючому населенню світу, сільське господарство рису стало одним з найбільш значних антропогенних джерел метану. З теплою погодою і ґрунтовим ґрунтом рисові риси діють як водно-болотні угіддя, але створюються людьми з метою виробництва продуктів харчування. Через болотне середовище рисових полів, ці поля вносять 50-100 мільйонів метричних тон викидів метану щороку. Це означає, що сільське господарство рису відповідає приблизно за 15-20% антропогенних викидів метану. Стаття, написана Вільямом Ф. Руддіманом, досліджує можливість виникнення викидів метану внаслідок антропогенної діяльності 5000 років тому, коли стародавні культури почали осідати і використовувати сільське господарство, зокрема, зрошення рису, як основне джерело їжі.
Звалища
У зв'язку з великими колекціями органічної речовини та наявністю анаеробних умов, звалища є третім за величиною джерелом атмосферного метану в Сполучених Штатах, що становить приблизно 18,2% викидів метану в глобальному масштабі в 2014 році. Коли відходи спочатку додаються на звалище, кисень є рясним і таким чином піддається аеробному розкладанню; за цей час утворюється дуже мало метану. Однак, як правило, протягом одного року рівень кисню виснажується, а анаеробні умови домінують на полігоні, що дозволяє метаногенам захоплювати процес розкладання. Ці метаногени викидають метан в атмосферу, і навіть після закриття полігону масовий обсяг розкладаються речовин дозволяє метаногенам продовжувати виробляти метан протягом багатьох років.
Очищення стічних вод
Установки для очищення стічних вод діють для видалення органічних речовин, твердих речовин, патогенів та хімічних небезпек в результаті забруднення людини. Викиди метану в очисних спорудах відбуваються внаслідок анаеробної обробки органічних сполук і анаеробної біодеградації шламу.
Спалювання біомаси
Неповне спалювання як живої, так і мертвої органічної речовини призводить до викиду метану. Хоча природні лісові пожежі можуть сприяти викидам метану, переважна більшість спалювання біомаси відбувається внаслідок людей– у тому числі від випадкових спалювань цивільних осіб до свідомих спалювань, які використовуються для очищення від спалювання відходів землі до біомаси.
Метан на Марсі
Метан був запропонований в якості можливого ракетного палива на майбутніх місіях Марса, що частково пояснюється можливістю його синтезу на планеті шляхом використання ресурсів на місці. Адаптація реакції метанізації Sabatier може бути використана зі змішаним шаром каталізатора і зворотним зсувом водяного газу в одному реакторі для отримання метану з сировини, доступної на Марсі, використовуючи воду з марсіанського надра і вуглекислий газ в марсіанській атмосфері.
Метан може бути отриманий небіологічним процесом, який називається серпентинізацією, що включає воду, вуглекислий газ і мінерал олівін, який, як відомо, є поширеним на Марсі.
Що таке природній газ?
Природній газ. Природний газ або природний - це назва газів різного походження, як, наприклад, пов'язаних з вулканічною діяльністю, з дією грязьових сопок, процесами обвуглювання і бітумінізаціі. Це можуть бути гази: вуглекислий, сірководень, сірчистий, вуглеводневі, в тому числі болотний, і так далі.
Зазвичай під назвою природний газ розуміють горючий вуглеводневий газ, який часто є супутником нафти. Однак, відомо багато чисто газових родовищ, абсолютно не пов'язаних з наявністю нафти. У тих випадках, коли природний газ в 100 м3содержіт 16 л газоліну і більш, він називається «жирним», при меншому вмісті газоліну - «сухим».
Склад природного газу
Типовий склад «жирного» і «сухого» газу наведено нижче.
Жирний газ:
Метан 36,8
Етан 32,8
Пропан 21,1
Бутан 5,8
Гексан 3,5
Азот 0,0
Сухий газ:
Метан 84,7
Етан 9,4
Пропан 3,0
Бутан 0,0
Гексан 1.3
Азот 1,6
Використання природного газу
Крім того, до складу природного газу входять: етилен, який надає яскравість газовому полум'я, окис вуглецю; вуглекислота, кисень, водень. У газі зустрічаються також, зазвичай у вигляді слідів, сірководень, фосфористий водень та інші.
Теплотворна здатність природного газу полягає в межах 5.800 - 11.400 калорій на 1 м3. У надрах газ залягає в пластах і лінзах пористих порід (пісковиків і пісків). Газові поклади часто бувають в сводових елементах антиклінальних куполів і складок. При наявності в нафтових родовищах газу природного його тиск обумовлює приплив нафти до забою свердловин і при достатній величині викликає фонтанні явища.
Природний газ і його застосування.
Природний газ використовується як паливо для двигунів внутрішнього згоряння, в домашніх плитах і печах, в котельних топках, для освітлення, для виробництва сажі, для отримання газоліну і потім бензину. З 100 м3 газу виходить близько 1,44 кг сажі вищого сорту. Газолін витягується з газів шляхом стиснення або абсорбції (поглинання). Видобувається природний газ за допомогою бурових свердловин. Тиск, при якому виділяється газ, що визначає швидкість його виділення з свердловин і дебіт їх, коливається в дуже широких межах.
Цікаво знати, що….

Моря Титана: Великі метанові озера
На Титані, супутнику Сатурна, виявлені великі водойми, імовірно складаються з вуглеводнів. Раніше там вже знаходили невеликі озерця, однак на цей раз мова йде про самих справжніх морях, розташованих в північних широтах супутника. Відкриття дозволяє пояснити, чому у Титана настільки щільна і активна атмосфера.



Титан, найбільша місяць Сатурна, є другим за величиною супутником у всій Сонячній системі, після Ганімеда, однією з юпитерианских місяців. Його діаметр становить 5 150 км - приблизно в 1,5 рази більше нашої Місяця. На Титані вже були помічені невеликі озерця, але настільки великі водойми вчені бачать там вперше. Площа найбільшого зі знайдених утворень перевищує 100 тис. Км2, воно перевершує за розмірами найбільше з Великих американських озер і займає приблизно 0,12% поверхні Титану. Для порівняння: найбільша з внутрішніх морів Землі - Чорне - займає лише 0,085% площі нашої планети. На думку фахівців з команди Cassini, цей факт говорить про те, що найбільший водойму Титана слід назвати саме морем, а не озером.
Насправді, поки немає прямих доказів того, що темні плями, обнаруженниена поверхні супутника за допомогою радара Cassini, є рідкими морями. Однак форма кордонів і гладка поверхня переконливо свідчать на користь саме цієї версії. Швидше за все, моря ці складаються з рідкого метану і етану: обидва газу в достатку присутні в атмосфері супутника і періодично утворюють щільні хмари. Астрономи вже висловлювали припущення про те, що головним джерелом атмосферного метану і етану повинні бути рідкі моря, вірніше, їх випаровування, однак в ході попередніх досліджень апарат знаходив на поверхні тільки невеликі «калюжки» і канали.
Тепер з'ясувалося, що великі моря і озера зосереджені в північній частині планети, за 65-м градусом північної широти. Відкриття означає, що питання про джерело постійного поповнення атмосфери Титана можна вважати більш-менш рішенням. Вчені мають намір детально дослідити знайдені об'єкти в ході наступного прольоту Cassini поблизу від супутника, який відбудеться в травні.
Про даних, зібраних на Титані спусковий апарат Hyugens, читайте: «За туманом».
За повідомленням BBC
Скільки палива взагалі?
Про це йдеться у звіті "BP Statistical Review of World Energy. June 2017".
У першу п'ятірку газових гігантів світу потрапили Іран(33,5 трлн м куб. газу, або 18% від світових запасів), Росія (32,3 трлн м куб. газу, або 17,3%), Катар (24,3 трлн м куб. газу, або 13%), Туркменістан (17,5 трлн м куб. газу, або 9,4%) та США (8,7 трлн м куб. газу, або 4,7%).

Мал. 1. Газові гіганти
Як показує статистика, найбільші поклади газу зосереджені у країнах Середнього Сходу – 79,4 трлн м куб. Далі йдуть країни Єропи та інші країни Євразії – в загальному обсязі 70,7 трлн м куб. В африканськи країнах зосереджено 14,3 трлн м куб газу. В кінці материкового рейтингу – Північна і Південна Америки та Австралія.
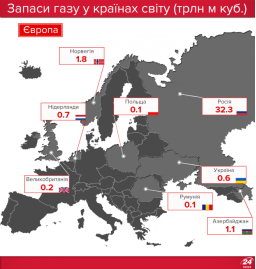
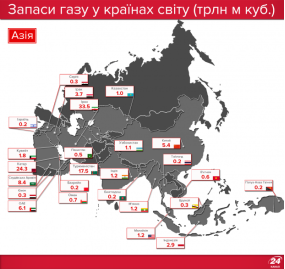
Мал.2. Оцінка запасів газів у Євразії
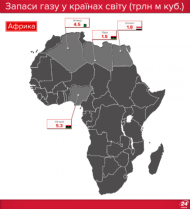
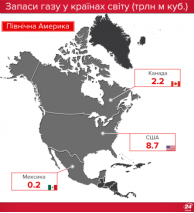
Мал.3. Запаси палива у Африці та Північній Америці
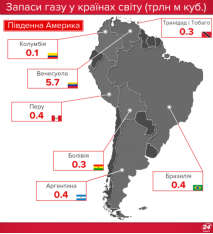
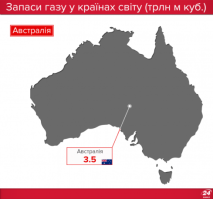
Мал.4. Запаси палива у Австралії та Південній Америці
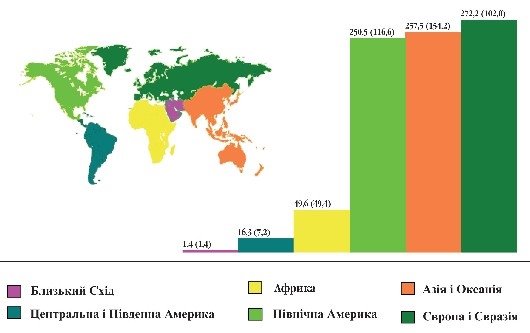
Мал. 5. Регіональний розподіл світових запасів вугілля (у дужках вказані запаси антрацитів і бітумінозного вугілля) на 01.01.2008 р., трлн. Т
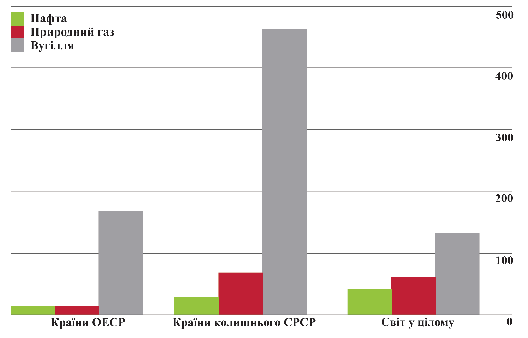
Мал. 6. Відношення доведених запасів органічного палива до їх добування в 2007 році в регіонах світу, років
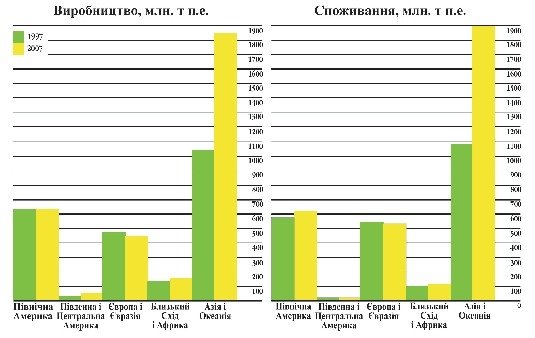
Мал. 7. Виробництво і споживання вугілля в регіонах світу в 1997 і 2007 рр.
Запаси палива в Україні. В Україні вдало поєднуються основні групи корисних копалин. Це насамперед паливні корисні копалини, до яких належать вугілля, нафта, газ, горючі сланці, торф. Друга група — рудні, що охоплюють родовища заліза, марганцю, нікелю, титану, урану, хрому, золота. До третьої групи — нерудних — належать кам'яна сіль, каолін, вогнетривкі глини, ц ементна сировина, флюсові вапняки тощо.
Паливні (горючі) корисні копалини. На території України знаходяться Донецький і Львівсько-Волинський кам'яновугільні та Дніпровський буровугільний басейни. Донецький басейн у межах України (Великий Донбас) займає площу понад 50 тис. квадратних кілометрів. (Тут коксівне, газове вугілля, антрацит.) Донецький басейн залишається одним з основних у вугільній промисловості країни. Запаси вугілля оцінюються в 109,0 млрд тонн в шарах потужністю 0,6—1,2 м. З 1949 р. освоюється Західний Донбас, розташований на північному сході Дніпропетровської області і частково в Харківській області. Нині в Донбасі розвідано більш як сто ділянок, загальні запаси яких становлять 12 млрд тонн і більше. ЛьвівськоВолинський басейн знаходиться на Заході України, має площу близько 10 тис. квадратних кілометрів. Максимальна потужність кам'яновугільних шарів — 2,8 м, вугілля сірчисте, використовується як енергетична сировина і для коксування. Звичайним шахтовим способом тут можна добувати лише 30% запасів вугілля. Тому потрібно розширювати добування шляхом підземної газифікації в районах з малопотужними шарами вугілля та дніпровський буровугільний басейн займає площу близько 150 тис. квадратних кілометрів. Його родовища знаходяться в Кіровоградській, Дніпропетровській і Житомирській областях. Загальні розвідані запаси становлять 6 млрд тонн. Родовища бурого вугілля відомі також в Полтавській і Харківській областях, в Придністров'ї, Передкарпатті і Закарпатті. Родовища горючих сланців є в Карпатах, на Поділлі, в Кіровоградській області (найбільше Бовтишське родовище). Торфові родовища знаходяться переважно на Поліській низовині, в річкових долинах. В Україні виявлено за останні роки до 150 нових нафтових, нафтогазових, газоконденсатних і газових родовищ. Родовища нафти і газу зосереджено в трьох регіонах: Карпатському, Дніпровсько-Донецькому, Причорноморсько-Кримському. Карпатський нафтогазоносний регіон охоплює родовища Передкарпаття, Українських Карпат і Закарпаття. Більшість нафтових і газових родовищ знаходиться у Львівській та ІваноФранківській областях і приурочена до Передкарпатського прогину. Тут виявлено більш як 30 родовищ газу, багато з яких в результаті тривалої експлуатації майже повністю вичерпано. Найбільшими нафтовими родовищами є Долинське, Бориславське. Газові родовища Закарпаття промислового значення не мають. Більш як 80% добутих нафти і газу припадає на ДніпровськоДонецький нафтогазоносний регіон. Найбільшими газовими родовищами є Шебелинське, Західнохрестищенське і Єфремівське (сумарні запаси більше 970 млрд кубічних метрів), нафтовими — Леляківське, ГлинськоРозбишівське, нафтогазовими — Гнідинцівське, Качанівське, Яблунівське. ПричорноморськоКримський нафтогазоносний регіон займає територію на південь від лінії Одеса — Херсон — Бердянськ, західна межа проходить по меридіану м. Одеси, східна — вздовж берега Азовського моря, південна — по широті м. Євпаторії. У ній розвідано більш як 60 родовищ нафти і газу. Вважаються перспективними щодо газу і нафти глибинні ділянки земної кори та підводні надра Чорного моря. Є перспективними щодо газу ділянки Чорного моря на глибинах 700—750 м. На ділянках з глибинами 300-350 м існують умови для утворення сумішей вуглеводневих газів. Про можливість їх добування свідчить досвід інших країн. На думку прихильників небіологічного походження нафти і газу, перспективною є найстаріша (за часом відкриття і експлуатації) Карпатська нафтогазоносна провінція, що охоплює смугу від родовищ нафти поблизу Коханівки, Судової Вишні у Львівській області до родовищ неподалік від Лопушної і Таталова в ІваноФранківській області.
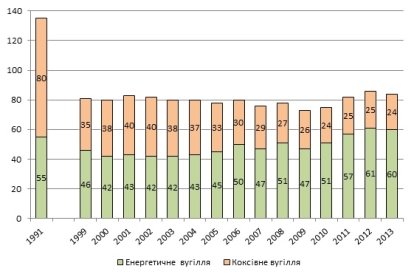
Мал. 8. Видобуток в Україні вугілля
Безперервно зростаюче споживання паливноенергетичних ресурсів вимагає раціонального і економного використання палива. Це одна з найважливіших проблем нашого часу.
Сукупні резерви природного газу у світі. Загальний обсяг доведених запасів природного газу в світі обмежений і становить 186 трильйонів кубометрів. Чи означає це, що в доступному для огляду майбутньому ці запаси вичерпаються? Можна сміливо припускати, що це не так. Адже доведені запаси це ті резерви, які при нинішньому технічному та економічному розвитку суспільства з максимальною ймовірністю будуть витягнуті з вже освоєних родовищ.
Але існує ще дві категорії: ймовірні запаси – це резерви, рівень інформації про яких недостатній, щоб з упевненістю стверджувати можливість їх видобутку при нинішньому рівні розвитку суспільства; Можливі запаси – резерви, спосіб вилучення яких з надр Землі та економічні витрати на цей процес можна оцінити лише приблизно.
До того ж технічний прогрес не зупиняється, рівень технологій у газодобувній галузі постійно підвищується. Це дозволяє сподіватися на те, що в найближчому майбутньому як ймовірні так і можливі запаси поступово будуть переходити в доведені.
Крім того, чисто газові родовища не єдине джерело покладів природного газу.Вугільні пласти, якщо оперувати світовими масштабами, за попередніми оцінками геологів містять близько 500 трильйонів кубометрів метану. Підземні води за обсягами розчинених в них газів перевершують всі світові газові запаси в традиційному вигляді. Наприклад, в пластових водах родовища Галф Кост (США) розчинено близько 700 трильйонів кубометрів природного газу.Один кубометр газового гідрату містить від 160 до 180 м³ чистого газу. А за оцінками вчених, газові гідрати зберігаються в 90% площі Світового океану. Все вищенаведене дозволяє сподіватися на те, що природний газ як паливо ще довгий час буде приносити користь мирному існуванню і розвитку цивілізації.
Енергетика. Мінімум енергії, необхідний для підтримки життєдіяльності людини ( в первісному і сучасному світі), дорівнює 12,6 МДж на день або 4,18·103 МДж на рік, що еквівалентно енергії, яка виділяється при спалюванні 125 кг нафти. У зв’язку з підвищенням вимог людей до комфорту на початку ХХ століття споживання енергії перевищило біологічно необхідний рівень у 5,5 рази, у 1980 р. – в 13,3 рази, а на початку ХХІ століття – в 2325 разів. У середньому одна людина за рік споживає енергію 2,2 т у. п. (тонн умовного палива), у той час як у США споживання енергії дорівнює 12, у Німеччині – 6, а в країнах Африки – 0,1 т у.п., що на 40% менше мінімуму енергії для підтримки життєдіяльності людини. Чисельність населення Землі швидко зростає. У 1700 році на планеті проживало 600 млн. людей, до 1850 року число землян збільшилося до 1,2 млрд., до 1950 року – до 2,5, а до середини 1987 року – до 5,0 млрд., у другій половині 1999 р. – до 6,0 млрд., на початку 2007 року – 6,3 млрд. Таким чином, для першого подвоєння числа землян потрібно було 150 років, другого – 100, а третього – менше 37 років.
У зв’язку з життєвими потребами і ростом споживчого попиту населення, навантаження на природу стає настільки великим, що слід очікувати порушення енергетичного балансу планети. Очевидно, що земні ресурси зможуть забезпечити зростаючі потреби тільки протягом обмеженого терміну. На початку ХХІ сторіччя на Землі щорічно споживається понад 14 млрд. т у. п. енергії. За прогнозом Всесвітньої Енергетичної Ради і Міжнародного інституту прикладного системного аналізу (WEC/IIASA) у 2020 р. глобальне енергоспоживання людства складе 19,4 млрд. т у. п. У найближче десятиліття зростання попиту на 90% буде покриватися за рахунок використання палива. Слід зазначити, що питоме енергоспоживання на одиницю виробленої продукції в країнах Східної Європи, у тому числі й в Україні, у 15 разів вище, ніж у Японії, у 10 разів вище, ніж у Франції, у 56 разів вище, ніж у США. На 1 долар США продукції в Японії витрачається 0,13, у Франції – 0,19, у Південній Кореї – 0,31, США – 0,35 кг, а в країнах Східної Європи – 1,92,2 кг нафтового еквіваленту. Це свідчить про значні можливості нашої країни щодо енергозбереження. Енергоносії прийнято поділяти на відновлювані і невідновлювані. До першої групи відносять: – сонячну енергію; – енергію вітру; – енергію води; – біомасу (деревина, сміття тощо); – тепло морів; – енергію припливу; – тепло Землі. До другої групи відносять: – кам’яне і буре вугілля; – торф; – нафту; – природний газ; – ядерне паливо.
Основною задачею палива є перетворення енергії. Машини працюють за наступним принципом енергія ні звідки не береться, а переходить з одного стану в інший. Роль нафти і газу в розвитку економіки. Нафта, газ і продукти їх переробки мають величезне значення сьогодні для функціонування економіки та життя населення і матимуть ще більше значення в перспективі.
У процесі переробки нафти, як уже говорилося, отримують автомобільний бензин різних марок, дизельне паливо, мазут, освітлювальний газ, пічне паливо, нафтобітум, електродний кокс, моторні і індустріальні мастила, пластичні мастила і мастильні рідини, парафіни, розчинники ( бензол, толуол), етилен.
Природний газ широко використовується як паливо на теплоелектроцентралях, які б виробляли електричну і теплову енергію для великих міст, у виробництві будівельних матеріалів, комунально-побутовому господарстві, споживається в металургійній, цементній та хімічної промисловості. Остання використовує газ як сировину для виробництва мінеральних добрив, отримання етилену і пропилену, з яких виробляють пластичні маси, синтетичний каучук, штучні волокна і т.п. Застосування природного і попутного нафтового газу дозволяє істотно спростити і прискорити безліч важливих технологічних процесів.
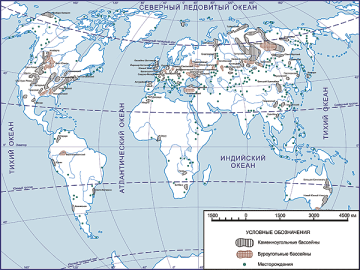
Мал. 10. Запаси ресурсів
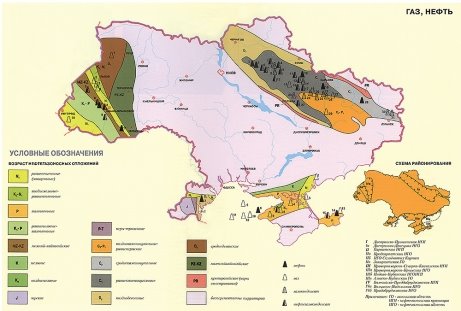
Мал. 11. Запаси нафти і газу
СВІЧКА
Історія. Перш, ніж почати, хочу порадити тим, хто зацікавився темою свічок і вогню, почитати чудову книгу англійського вченого Майкла Фарадея «Історія свічки». Її легко можна знайти і безкоштовно скачати в інтернеті. Саме на цю книгу я буду спиратися в своєму сьогоднішньому оповіданні про пристрій свічки і полум'я.
Є припущення, що вперше свічки з'явилися в Стародавньому Єгипті. Матеріалом для них служили рослинні і тваринні жири, наприклад, яловиче або бараняче сало. Саме тому на Русі такі свічки називали сальними.
Гніт спочатку робили з трісок, потім стали використовувати змочену серцевину очерету. У тому ж Єгипті для виготовлення гніту використовували папірус, згорнутий в трубочку і змочений тваринним жиром.
Пізніше, вже в середні віки, гноти стали робити з туго скручених або плетених рослинних волокон. Щоб вони краще горіли, їх змочували розчинами селітри або хлористого амонію.
В даний час гніт роблять з бавовняних ниток, які просочують розчинами солей фосфорної та борної кислот. Це потрібно для того, щоб гніт згорав повністю, без залишку, без утворення нагару або хоча б з якомога меншим його кількістю.
Самі свічки зовні були абсолютно далекі від нинішніх - миски з налитим в них жиром. Трохи пізніше з'явилися і більш-менш схожі на нинішні форми свічок - коли стали використовувати обрізки того ж очерету, бамбука або очерету. Загалом, хто на що здатний. Край цьому беззаконню поклали древні римляни, які здогадалися, як використовувати властивості тваринного жиру. Раз він дуже швидко застигає, то не використовувати його як форму, не заморочуючись з плошками і судинами з очерету?
Сказано зроблено. Так з'явилися свічки, які стали називати Мока або умочування. Для їх виготовлення гніт опускали в розтоплений жир і чекали, поки він застигне, покривши гніт тонким шаром. Потім знову опускали (мачали) в розтоплений жир, отримуючи таким чином другий шар. І знову, і знову ... Така технологія виготовлення свічок проіснувала аж до 15-го століття.
Саме в 15 столітті невгамовні французи придумали використовувати литі форми для свічок. Гніт пропускали через форму конусоподібної форми, заливали її свічковий масою (крім воску, він не підходив для цього), чекали, поки застигне, після чого витрушували отриманий продукт, в результаті виходила конічна свічка, що стоїть на стійкому широкому підставі.
Не забуваємо, що до сих пір мова йшла про сальних свічках. Їх явним недоліком було те, що вони смерділи (самі знаєте, який неприємний запах видає нагріте тваринний жир) і нещадно чадили, покриваючи всі в житло кіптявою.
Історія свічок з жиру закінчилася тільки на початку 19 століття, коли французький хімік Мішель Ежен Шевроле синтезував стеарин. З його появою закінчилася ера кіптяви і неприємного запаху. Зате з'явилася проблема виготовлення - технології умочування і лиття не годилася через свою невисоку продуктивності.
Одвічні супротивники французів - англійці - придумали нову технологію виготовлення свічок, де свічки з форми виймались автоматично. Завдяки цій вигадка виробництво свічок різко збільшилася.
А коли в 1850 році було отримано парафін, для вогню настав справжнє свято - все житла освітилися чистими, непахнущая свічками. Їх недолік, правда, був в тому, що парафін має низьку температуру плавлення, і такі свічки швидко обпливали, тому їх стали робити з суміші парафіну зі стеарином, отримавши чудовий засіб для освітлення жител.
Але це виявилося лебединою піснею свічки - технології на місці не стояли, спочатку з'явилися гасові лампи, а в кінці 19 століття - і електричні. У 1879 році Едісон вразив світ лампою розжарювання.
Чим закінчилася справа, ми знаємо. Електричне освітлення зараз всюди. Найбільше свічок, мабуть, використовується церквою. Також свічки залишилися як атрибут романтичних вечорів і данина енергетикам з раптовими відключеннями світла.
Колись, років три тому, я писала невелике оповідання, з яким брала участь в інтернет-конкурсі фантастичних оповідань. Я не пройшла навіть до відбірного туру, так як моя розповідь не вписався в умови конкурсу, ну да ладно. Все одно це був лише випадковий, абсолютно спонтанний сплеск моїх літературних здібностей, який затих так само швидко, як і почався. Більше я навіть і не намагалася нічого писати.
Щоб розповідь не валявся просто так «в столі» (на жорсткому диску комп'ютера тобто), викладаю його сюди, не пропадати ж добру :-). Загляньте, якщо цікаво, він якраз частково пов'язаний зі свічками.
Виявляється, спочатку для виробництва перших пральних порошків використовувався кутовий жир. Цілі флотилії борознили океани, полюючи за кашалотами. А зараз замість китового жиру використовується парафін, з яким довгі роки боролися нафтовики, вишкрібаючи його з труб.
Як «працює» свічка ?
Якщо у вас вдома є свічка, спробуйте, запаліть парафін, з якого вона зроблена. Я маю на увазі, що не підпаліть ґніт, а спробуйте підпалити сам парафін, тобто тверда речовина, «тіло» свічки. Вийшло?
А тепер підпаліть ґніт. Парафін, дотичний з ним, тане, утворюючи навколо гнота поглиблення, заповнене рідким парафіном. А тепер нахиліть свічку так, щоб калюжка рідкого парафіну потекла і потрапила на гніт. Що вийшло?
Такий досвід ми робили з сином, коли «грали з вогнем», про що я писала в двох попередніх статтях. Рідкий парафін загасив вогонь, як звичайна вода. Чому так відбувається?
Справа в тому, що гніт, як я вже писала вище, зроблений зі скручених або плетених ниток. Ось дивіться, я спеціально розібрала звичайну магазинну свічку. У ній гніт виконаний плетених «кіскою».
Таким чином, площа поверхні у гніту досить велика. Розплавлений біля основи гніту рідкий парафін просочує гніт і по його капілярах піднімається вгору, в зону горіння. Там температура досить висока, парафін починає випаровуватися, і ось як раз ці пари і горять.
Таким чином, ті, хто думають, що горить гніт, помиляються, це горять пари парафіну. Гніт служить своєрідним транспортом, який доставляє парафін в зону горіння - розплавлений від тепла парафін піднімається по капілярах гніту вгору і горить.
Процес горіння свічки
Процес горіння свічки являє собою складне явище. Основними компонентами в цьому процесі є:
1. Робоча речовина, що утворить тіло свічки (парафін, стеарин, віск і т.д.).
2. Гніт.
3. Кисень повітря.
Робоча речовина в процесі горіння свічки переходить з твердого стану в рідке під впливом температури полум'я. Розтоплений парафін просочує гніт свічки, піднімаючись по капілярах в його верхню частину, де під впливом високої температури випаровується. Пари парафіну вступають в реакцію окислення з киснем навколишнього повітря, таким чином виникає горіння. Гніт, як правило, виготовляється методом плетіння з різних матеріалів. Структура гніту повинна створювати капілярний ефект для розплавленого парафіну.
Саме полум'я свічки поділяють на три області:
1. Нижня частина полум'я - найбільш холодна зона, що має меншу яскравість світіння. Ця зона утворена в основному важкими парами парафіну.
2. Більш яскрава область в центрі полум'я складається з розпечених частинок вуглецю. Ця частина має більш високу температуру.
3. Верхня область - область, в якій знаходяться продукти згоряння парафіну - вуглекислий газ і водяну пару. Область володіє високою температурою.
Їли внести скляну трубку в нижню частину полум'я, то з отвору виходитиме білий пар, який можна підпалити, це і є пари парафіну.
При внесенні холодного предмета в середню частину полум'я можна спостерігати, що предмет закоптиться. Це говорить про те, що в даній області багато вільного вуглецю.
Якщо в різні області полум'я внести лучину, то ви побачите, що вона буде обвуглюватися тільки у верхній області, оскільки саме там найвища температура.
Різновиди свічок і їх фізичні властивості.
За підсумками вивчення літератури нами встановлено, що свічки по
матеріалами, з яких вони виготовлені бувають парафінові, стеаринові,
жирові, воскові, гліцеринові, гелеві.
Характеризуємо кожен з видів.
1. Господарські свічки - найпростіші і дешеві парафінові. як
правило вони білі, напівпрозорі циліндричної форми;
2. Їдальні свічки - декоративні, тому що мають різні форми і цветапростие циліндричні, кручені, химерних форм. Для романтики в свічки
додають аромат.
Такі свічки необхідно ставити в свічники. Це ще додає їм
шарм.
3. Свічки великого діаметру називають прядив'яними. В іншому вони схожі
на столові.
4. Церковні свічки, які роблять з натурального воску в майстернях при
церквах. Щодо використання свічок в різних обрядах вони бувають малі,
келійні, храмові, напрістольние, архієрейські, пострігальние,
чернечі, дияконські, статутні.
5. Чайні свічки -свечі, які використовують в декоративних світильниках,
аромалампах, для підігріву чайників для заварки. Як правило ці свічки
заливають в який-небудь корпус.
6. Гелеві свічки.
7. Вуличні свічки використовувалися здавна і використовуються і зараз - для
освітлення вулиць.
8. Екзотичні свічки - очеретяні, гнітом їм служить серцевина
очерету.
9. У століття електроніки з'явилися електронні свічки. За рахунок мерехтіння лампи,
вміщеній в посудину створюється ефект мерехтіння.
Хімічний склад свічок теж різний:
1. Воскові свічки - свічки до складу яких входять або стеарин, або
парафін, бджолиний віск. Свічки з бджолиного воску в порівнянні з іншими
найбільш використовувані.
2. Солоні свічки. До появи воскових свічок в Росії використовувалися
такі джерела світла-в посудину з розтопленим салом зміцнювали
гніт з скручених ниток. Таке джерело світла швидко виходив з
ладу, коптили, чадили, гніт швидко згорав і його поправляли щипцями,
володіли неприємним запахом.
3. спермацетового свічки. Спермацет - це речовина, що знаходиться в голові
китів. Очищене за допомогою мильного лугу, віджате приймає
виключно білий напівпрозорий колір, але така свічка швидко
обпливала.
4. Парафінові свічки. Їх виготовляли з мінеральних речовин,
витягнутих при перегонці дьогтю, а в Англії з витягували з торфу. В
Нині парафін - це найбільш легкодоступний продукт
перегонки нафти.
Властивості полум'я
Полум'я має форму конуса за рахунок того, що піднімаються потоки повітря обтікають його з усіх боків. Утворені продукти горіння - вуглекислий газ і вода - піднімаються вгору разом з теплим повітрям, нагрітим, від вогню, утворюючи язичок полум'я. Потоки повітря охолоджують зовнішню поверхню свічі, тому її спокійно можна тримати рукою майже без ризику обпектися. Я кажу «майже», бо плавиться і стікає парафін все-таки досить гарячий, температура тут може бути в межах 45-65 градусів. Звичайно, смертельний опік ви не отримаєте, але приємно теж не буде.
Як я вже розповідала в одній їх попередніх статей, полум'я свічки складається з трьох досить добре видимих зон різного кольору. Наведу фото, взяте мною з інтернету:
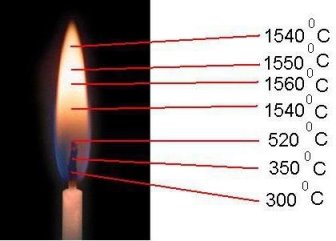
Нижня частина полум'я має синьо-фіолетовий колір. Тут знаходяться важкі пари парафіну, які змішані з повітрям. Якщо ви внесете в цю частину сірник, то вона займеться лише через деякий час, не відразу. Ця частина найменш гаряча, вона має температуру 300-350 градусів. Деякі спритники навіть демонструють хвацькі гасіння свічки пальцями саме в цій частині полум'я.
У другій частині температура полум'я досягає 500-800 градусів. Тут найяскравіше полум'я через те, що саме тут відбувається розкладання вуглеводнів, які утворюються частинки чистого вугілля сильно розжарюються і випромінюють світло. Саме через це утворюється вугілля свічка іноді може коптити - якщо він згоряє не повністю з якихось причин. Наприклад, мало кисню або гніт зроблений з невідповідного матеріалу. Тоді вуглець і випадає у вигляді сажі - кіптяви.
Найгарячіша частина - верхня. Якщо пам'ятаєте, на уроках хімії в школі вчитель напевно говорив вам під час практичних і лабораторних робіт, що пробірку потрібно нагрівати в верхній частині полум'я, так вона швидше нагріється. Тут температура 900-1500 градусів. У цій зовнішньої частини полум'я повністю згоряють вуглеводні з утворенням вуглекислого газу і води. Це полум'я практично не видно, воно майже не світиться.
Чому такий розкид температур, наприклад 900-1500 градусів? Це залежить від природи згорає речовини, а також концентрації і швидкості підведення до нього окислювача, наприклад, кисню повітря або ж чистого кисню (наприклад, в лабораторних умовах).
Чи не плутаємо!
Не будемо плутати віск, стеарин і парафін. Це три різних речовини.
Віск складається з складних ефірів жирних кислот рослинного і тваринного походження.
Стеарин - це воскоподобние суміш пальмітинової і стеаринової кислот (іноді ще є олеїнова), що містить домішки деяких інших насичених і ненасичених жирних кислот. Стеарин жирний на дотик (звідси і пішла назва - від грецького слова stear - сало, жир), білого або жовтуватого кольору, плавиться при температурі 50-65 градусів.
Парафін - суміш насичених вуглеводнів, також має воскоподобние консистенцію, безбарвний. Він легший за воду, плавиться в інтервалі температур 45-65 градусів.
Отримують його, в основному, при переробці нафти. При кімнатній температурі він хімічно інертний, а при високій температурі згорає з утворенням вуглекислого газу і води.
Саме з нього в даний час готують свічки в промисловому масштабі. Якщо ж ви хочете зробити свічку самостійно, то можете знайти і купити для цього в різних інтернет-магазинах і віск, і стеарин, і парафін. Загалом, все, що побажаєте.
Про те, як зробити свічку своїми руками, я зараз розповідати не буду. Можливо, трохи пізніше напишу про це окрему статтю.
Свічка в живопису - один з джерел натхнення художника. Її світло писали і художники середньовіччя, і сучасні майстри. Звичайно, така любов живописців до свічок не випадкова, саме та глибина відтінків, відблисків, світла і тіні, яку дає свічка, і становить основу всієї композиції.
Часто картини, в яких центральне місце займає свічка, буквально передають глядачеві виходить від неї тепло, змушують перенестися в світ, зображений на полотні, стати учасником відбуваються там подій.
Безліч художніх прийомів допомагає розкрити таємницю того тепла, затишку, таємниці і романтики, які дарує людям свічка. Її використовують як в портретах, так і в натюрмортах.
Але історія показує, можна не тільки створювати картини Про свічках. Існують полотна, які написані самими свічками, а точніше воском. Енкаустика (восковий живопис) відома ще за часів Стародавньої Греції, написані такою технікою картини, не втратили свою барвистість і до сьогоднішніх днів.
На цій сторінці ми привели кілька картин, в яких присутня свічка.
1. Олена Флерова «Ханука»
2. Семен Кожин «Святочное ворожіння»
3. Ferdinand du Puigaudeau "Chinese Shadows the Rabbit"
4. Микола Бессонов «Дівчина зі свічкою», «Молитва. італійка »
5. Елліотт Вірджіл «Натюрморт з свічником»
6. Олена Флерова «Суботній вечір»
7. Жан Батист САНТЕРРА «Дівчина зі свічкою».
8. Жорж де ла Тур «Молитва святого Франциска»


Парафін
Чим же вони замінили їх? Парафіном. Назва у нього латинського походження. У буквальному перекладі «парвумаффініс» означає малодіяльна. До того ж класу відносять і інші вуглеводні метанового ряду - вазелін, гірський віск і т. Д. Їх довгий час вважали «граничними», «насиченими». А межа насичення зв'язків в молекулі - це тупик.
До яких тільки хитрощів вдавалися вчені, щоб розворушити їх. Однак не добилися толку. Тому речовини, що містять 45 - 75 відсотків парафінових вуглеводнів, не використовувалися. За інертність вони були прозвані «хімічними мерцями».
Михайло Іванович Коновалов
В кінці XIX століття парафинами зацікавився російський вчений Михайло Іванович Коновалов. Він «воскресив» їх, використовуючи для їх пожвавлення азотну кислоту. Утворилися в процесі нітрування продукти стали проявляти високу активність, охоче взаємодіяти з іншими речовинами. Це відкриття отримало назву «реакція Коновалова». За його методу зараз з парафінових вуглеводнів виробляється величезна кількість різних продуктів для промисловості та застосування в побуті. Російські вчені вдосконалили процес нітрування. Виявилося, що вигідніше обробляти парафіни оксидами азоту: і дешевше, і простіше. З нітропарафінов отримують таким шляхом найрізноманітніші синтетичні речовини - ацетон, етиловий спирт, оліфу, оцтову кислоту, мастила, мило, паливо.
Особливо багато жирів йде на виробництво мила. Правда, тепер їх виробляють з відходів нафтової і коксохімічної промисловості. Варто замінити в молекулі жирної кислоти атом водню атомом натрію, і масляниста рідина перетворюється на тверду речовину - в мило. Що таке: «відіпрати бруд», «дочиста відмив руки», і т. Д. Ну а як же протікає процес прання? Чому «відмиває» мило? Справа в тому, що бруд на тканини або на поверхні шкіри - не що інше, як прилип до жирової плівці частинки пилу. Навіть гаряча вода не завжди може їх змити, так як жир не змочується нею. А мило, що потрапило в воду, відразу ж розщеплюється на вільну луг і жирну кислоту. Ведуть вони себе в рідині по-різному. Луг накидається на бруд, що прилипла до тканини і шкірі, і безцеремонно відриває її від поверхні. Жирна ж кислота підхоплює частинки пилу, «пов'язує» їх і забирає геть.
Може скластися враження, що у всіх сортах мила присутній натрій. Ні, далеко не завжди. У молекули органічних кислот іноді вводять інші метали. Присутність калію дозволяє отримувати так зване зелене, або рідке, мило, яке застосовується в медицині як знезаражуючого кошти. Випускається мило з міддю в головній частині молекули. Ним лікують виразки, знищують сільськогосподарських шкідників, його додають у фарбу, для фарбування днищ кораблів. Або свинцеве мило. З нього готують пластирі, прикладаються до наривів і ран. Цинкові і ртутні мила - порошки, що вживаються в якості присипки. Кобальтові, нікелеві і кадмієві мила потрібні для виробництва непромокаючої шкіри і паперу. А магнієвим милом чистять шовкові тканини.
А як пожвавлюють «хімічних мерців»? Досліджуючи жирні насичені кислоти, виділені з природного жиру, вчені звернули увагу на їх дивовижну схожість з парафіно-вуглеводнями. Тільки в молекулах кислот додатково, був присутній кисень, двома атомами. Спочатку вчені спробували впровадити в молекулу парафіну атоми кисню, використовуючи високий тиск в поєднанні з високою температурою. Процес був занадто громіздким, а найголовніше - жирних кислот виходило мізер. Тоді стали окисляти парафіни киснем повітря в присутності каталізаторів. Справа відразу спростилося. При такому способі 85 відсотків вуглеводнів метанового ряду перетворюються в жирні кислоти. Процес окислення повністю автоматизований.
Між іншим. Виявляється, спочатку для виробництва перших пральних порошків використовувався кутовий жир. Цілі флотилії борознили океани, полюючи за кашалотами. А зараз замість китового жиру використовується парафін, з яким довгі роки боролися нафтовики, вишкрібаючи його з труб.
БОЛОТО
Верхові болота, як величезна губка, нагромаджують надлишок вологи, який упродовж літа живить струмки і ріки, підтримує вологість повітря. Там, де верхові болота осушили, міліють ріки, луки перетворюються на безплідні солончаки. Дощова вода містить дуже мало мінеральних речовин. Тому на верхових болотах розвивається рослинність, пристосована до дуже бідного живлення, наприклад, мох сфаґнум. Сфаґнум може увібрати і утримати в декілька разів більше води, ніж його власна маса. Кислота, яку виділяє сфаґнум, розкладає атмосферний пил на мінеральні речовини, якими він живиться. Пустунчик: Якби я був чарівником, то вмить висушив би всі болота на Землі! Лапуня: Але чи варто це робити? Пустунчик: А чому б і ні? Болота створюють багато незручностей. Це розплідники комарів, ними важко пересуватись і людям, і транспорту. А на місці висушеного болота можна вирощувати культурні рослини. Лапуня: Але ж болота урізноманітнюють природу: тут живуть особливі тварини й рослини. А цілющі грязі деяких боліт застосовують на курортах. Розумник: На болотах поширені особливі вологолюбні рослини, серед яких є занесені до Червоної книги. Наприклад, водяний горіх, росичка круглолиста, деякі види мохів. Лапуня: А ще на болотах заготовляють журавлину, багату на вітамін „С”, збирають лікарські трави, наприклад, аїр. Розумник: З рослинних решток на болоті утворюється торф, який використовують як паливо і добриво. Болота – єдине джерело торфу! Пустунчик: Але ж для видобування торфу болота висушують! Розумник: Так, але тут важливо знати міру. Адже болота можуть давати початок річкам, вони регулюють потік великих і малих річок і живлять великі ріки. Пустунчик: Хіба це можливо у застійній воді? Розумник: Вода в болотах зовсім не застійна. Давайте порівняємо: в озерах вода повністю оновлюється за 17 років, в болотах – кожні 5 років! Лапуня: Величний Дніпро, протікаючи трьома країнами, народжується в мохах невеличкого болота на півночі Смоленської області Росії! Пустунчик: А я знаю, що одна з найбільших рік України – Дністер – теж починається в болотистому урочищі в Карпатах. Розумник: Болото зволожує повітря, пом’якшує клімат. Цю важл иву ланку неможливо виключити з кругообігу води. Лапуня: Можна уявити собі ланцюжок змін, які почалися б після осушення всіх боліт: сухіше повітря – менше дощів – обміління рік та озер, скорочення лісів… Пустунчик: Отже, осушення боліт, вирівнювання русла річок можуть призвести до пересихання території або, навпаки, до її заболочення. Розумник: Так, сьогодні болота треба охороняти, адже отруєння і загибель болота відбувається швидко й безповоротно. Пустунчик: Все зрозуміло. Кожне втручання у природу має бути виваженим. Чапля руда Лунь болотний Курочка болотна Нутрія Росичка круглолиста Сфаґнум вони регулюють потік великих і малих річок і живлять великі ріки. воді? стійна. Давайте порівняємо: в озерах вода клуб „трьох зернят” ПРИРОДНИЙ ФІЛЬТР Болота поглинають частки пилу, який у безвітряну погоду пересувається в напрямку нижчої температури. А температура над поверхнею боліт завжди нижча, ніж навколо. Один гектар боліт може „проковтнути” до трьох тонн пилу! Болота очищають воду від отруйних речовин та хвороботворних мікробів.
Органічна хімія. Поняття «органічна хімія» ввів в 1806 році швед Йенс Якоб Берцеліус, визначивши її як «частину фізіології, яка визначає склад живих тіл разом з хімічними процесами, що відбуваються в них». Берцеліус взагалі зробив для науки (а, значить, і для нас з вами особисто) багато всього: вперше виділив в чистому вигляді кремній, титан і цирконій, підтвердив безліч відомих хімічних законів, придумав і ввів у вживання сучасні символи хімічних елементів. І це при тому, що власне хімією він почав цікавитися вже після 20. Його ім'ям навіть назвали кратер на видимій стороні Місяця (а це, природно, куди крутіше, ніж на зворотній).
Але повертаємося до органічної хімії. Через кілька десятків років її більш наближене до сьогоднішнього визначення дав німець Фрідріх Август Кекуле, описавши як «хімію з'єднань вуглецю».
Так що якщо коротко, то винесене в заголовку твердження вірне. Але взагалі, за минулі з часів Берцеліуса і Кекуле пару сотень років розуміння органічної хімії перестало бути таким однозначним.
Алмаз чи вугілля? Вуглець - один з нечисленних елементів «без роду, без племені». Історія спілкування людини з цією речовиною сягає часів доісторичні. Ім'я першовідкривача вуглецю невідомо, невідомо й те, яка з форм елементарного вуглецю - алмаз або графіт - була відкрита раніше. І те й інше трапилося надто давно. Безумовно стверджувати можна лише одне: до алмазу і до графіту було відкрито речовину, яка ще кілька десятиліть тому вважали третьою, аморфною формою елементарного вуглецю - вугілля. Але в дійсності вугілля, навіть деревне, це не чистий вуглець. У ньому є і водень, і кисень, і сліди інших елементів. Правда, їх можна видалити, але і тоді вуглець вугілля не стане самостійною модифікацією елементарного вуглецю. Це було встановлено лише в другій чверті минулого століття. Структурний аналіз показав, що аморфний вуглець - це по суті той же графіт. А значить, ніякий він не аморфний, а кристалічний; тільки кристали його дуже дрібні і більше в них дефектів. Після цього стали вважати, що вуглець на Землі існує в двох елементарних формах - у вигляді графіту і алмазу.
Вам ніколи не доводилося замислюватися про причини різкого «вододілу» властивостей, який проходить у другому короткому періоді менделєєвської таблиці по лінії, яка відділяє вуглець від наступного за ним азоту? Азот, кисень, фтор при звичайних умовах газоподібні. Вуглець (в будь-якій формі) - тверде тіло. Температура плавлення азоту - мінус 210,5 ° C, а вуглецю (у вигляді графіту під тиском понад 100 атм.) - близько плюс 4000 ° C ...
Дмитро Іванович Менделєєв першим припустив, що ця різниця пояснюється полімерним будовою молекул вуглецю. Він писав:
«Якби вуглець утворював молекулу С₂, як і О₂, то був би газом».
І далі: «Здатність атомів вугілля з'єднуватися між собою і давати складні молекули проявляється у всіх вуглецевих сполуках ... Ні в одному з елементів така здатність до ускладнення не розвинена в такій мірі, як у вуглеці. По сьогодні немає підстави для визначення міри полімеризації вугільної, графитной, алмазної молекули, тільки можна думати, що в них міститься Cn, де n є велика величина ».
Це припущення підтвердилося в наш час. І графіт, і алмаз -полімери, що складаються з однакових, тільки вуглецевих атомів.
За чітким зауваженням професора Ю.В. Ходакова,
«Якщо виходити з природи подоланих сил, професію гранильщика алмазів можна було б віднести до хімічних професіями».
Дійсно, гранувальників припадають долати не порівняно слабкі сили міжмолекулярної взаємодії, а сили хімічного зв'язку, якими об'єднані в молекулу алмазу вуглецеві атоми. Будь-кристал алмазу, навіть величезний, шестісотграммовая «Куллінан» - це по суті одна молекула, молекула надзвичайно регулярного, майже ідеально побудованого тривимірного полімеру.
Інша річ графіт. Тут полімерна впорядкованість поширюється тільки в двох напрямках - по площині, а не в просторі. У шматку графіту ці площини утворюють досить щільну пачку, шари якої з'єднані між собою не хімічними силами, а більш слабкими силами міжмолекулярної взаємодії. Ось чому так просто - навіть від дотику з папером - розшаровується графіт. У той же час розірвати графітову пластинку в поперечному напрямку досить складно - тут протидіє хімічний зв'язок.
Саме особливості молекулярної будови пояснюють величезну різницю у властивостях графіту і алмазу. Графіт відмінно проводить тепло і електрику, алмаз - ізолятор. Графіт зовсім не пропускає світла - алмаз прозорий. Якими б способами ні окисляли алмаз, продуктом окислення буде тільки СО₂. А окисляя графіт, можна при бажанні отримати кілька проміжних продуктів, зокрема графітову (змінного складу) і меллітовую С₆ (СООН) ₆ кислоти. Кисень як би вклинюється між шарами графітової пачки і окисляє лише деякі вуглецеві атоми. У кристалі алмаза слабких місць немає, і тому можливо або повне окислення або цілковито не окислення - третього не дано
Отже, є «просторовий» полімер елементарного вуглецю, є «площинний». В принципі давно вже допускалося існування і «одновимірної» - лінійного полімеру вуглецю, але в природі він не був знайдений.
Його отримали відносно недавно, вже в 60-і роки, радянські хіміки В.В. Коршак, А.М. Сдадков, В.І. Касаточкін і Ю.П. Кудрявцев. Нове речовина була синтезована шляхом каталітичного окислення ацетилену. Лінійний полімер вуглецю назвали Карбин. Зовні він виглядає як чорний мелкокристаллический порошок, володіє напівпровідниковими властивостями, причому під дією світла електропровідність карбін сильно збільшується. На цій властивості засновано перше практичне застосування карбін - в фотоелементах. Важливо, що карбін не втрачається фотопровідності при температурі до 500 ° C; це набагато більше, ніж у інших матеріалів того ж призначення.
За словами першовідкривачів карбін, найскладнішим для них було визначити, якими ж зв'язками з'єднані в ланцюжок вуглецеві атоми. У ньому могли бути чергуються одинарні і потрійні зв'язки (- С ≡ С - С ≡ С - С ≡), а могли бути тільки подвійні (= С = С = С = С =). А могло бути і те й інше одночасно. Лише через кілька років Коршак і Сладкова вдалося довести, що подвійних зв'язків в Карбин немає. Однак, оскільки теорія допускала існування вуглецевого лінійного полімеру тільки з подвійними зв'язками, було б просто грішно не спробувавши отримати цей різновид - по суті, четверту модифікацію елементарного вуглецю.
Ця речовина було отримано в Інституті елементоорганічних сполук АН СРСР. Новий лінійний полімер вуглецю назвали полікумуленом. Мабуть, ще рано робити припущення про можливі практичних застосуваннях «молодшого брата карбін» - дослідження його властивостей тривають.
Поки безперечно лише одне: існують чотири модифікації елементарного вуглецю, і кожна з них по-своєму цікава.
Карбон і його сім’я. Відомо: серед всіх мешканців таблиці Менделєєва вуглець займає найпочесніше місце. У нього найбільша «рідня»: науці вже відомо понад тридцять мільйонів з'єднань з вуглецем. І стежка на цьому не обривається. Щомісяця кількість «родичів» збільшується на тисячі. З'єднання вуглецю - основа живої матерії. З них складаються рослини, тварини, людина.
Історія відкриття вуглецю
Вуглець був відомий людству ще з глибокої давнини. Графіт і вугілля використовувалися ще стародавніми греками, а алмази знайшли застосування в Індії. Правда, за графіт частенько приймали схожі за зовнішнім виглядом сполуки. Проте, графіт мав широке застосування в давнину, зокрема для письма. Навіть його назва походить від грецького слова «графо» - «пишу». Графіт зараз використовується в олівцях. Алмазами почали вперше торгувати в Бразилії в першій половині 18 століття, з цього часу відкрито безліч родовищ, а в 1970 році була розроблена технологія отримання алмазів штучним шляхом. Такі штучні алмази застосовуються в промисловості, натуральні ж, в свою чергу, в ювелірній справі.
Вуглець в природі
Зміст вуглецю в земній корі становить усього близько 0,15%. Здавалося б, один з основних елементів, а так мало ... Насправді, вуглець піддається постійному круговороту із земної кори через біосферу в атмосферу і навпаки. З вуглецю складаються природний газ, нафту, вугілля, торф, вапняки і багато інших з'єднань.
Найбільш значуще кількість вуглецю зібрано в атмосфері і гідросфері у вигляді вуглекислого газу. В атмосфері вуглецю міститься близько 0,046%, а ще більше - в розчиненому вигляді в Світовому Океані.
Крім того, як ми бачили вище, вуглець є основою живих організмів. Наприклад, в тілі людини масою 70 кг міститься близько 13 кг вуглецю! Це тільки в одній людині! А вуглець міститься також у всіх рослинах і тваринах. От і рахуйте ...
Кругообіг вуглецю в природі
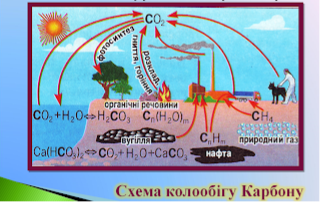
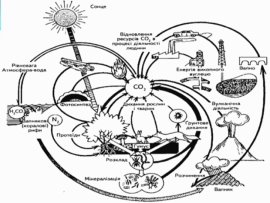
Розвиток хімії вуглецю. На початку XIX століття хімія вуглецю, або, як її зазвичай називають, органічна хімія, стала самостійною гілкою науки. І заслуга в цьому належить, безперечно, шведському вченому Якобу Берцелиусу. Обгрунтовуючи свою точку зору, він допустив, однак, помилку. На його думку, органічні речовини, якими побудовано все живе, не схожі на мінеральні. Берцеліус стверджував, що «в живій природі елементи коряться іншим законам, ніж в неживій», що речовини для створення живого створюються «під впливом життєвої сили».

Йенс Якоб Берцеліус
Куди він хилить? Адже звідси рукою подати до ідеалізму і попівщини, до визнання бога - бога творця, який нібито тільки він може створювати живе!
Першим розвіяв це твердження його учень, німецький хімік Фрідріх Велер, синтезував спочатку щавлеву кислоту, а потім сечовину - продукти життя живого організму.

Фрідріх Велер
Відкриття Миколи Миколайовича Зініна
Але остаточно розтрощив ідеалістичні погляди відомий російський вчений Микола Зінін. У 1842 році він штучно отримав анілін - органічна сполука. А сировиною для його отримання служив кам'яновугільний дьоготь - продукт відходу газової промисловості. Метод, розроблений російським вченим, відрізняється не звичайним витонченістю і простотою. Спочатку з дьогтю Зімін витягнув бензол, потім діючи на нього азотною кислотою, отримав нітробензол - отруйна масляниста речовина, що має запах гіркого мигдалю. Потім учений впливав на цей проміжний продукт сірчистим амонієм. Нітробензол віддав йому свої атоми кисню, а натомість отримав атоми водню. От і все. З'явилося речовина, яке створювалося перш за все на лабораторії природи. «Реакція Зініна» - перша сторінка у великій книзі синтетичної хімії, чудесам якої ми не перестаємо дивуватися і понині. У Казанському університеті, де працював вчений, до сих пір зберігається пробірка з бензідамом (так Зінін назвав анілін).

Микола Миколайович Зінін
Яка ж доля цього відкриття? Через кілька років, в світі виникла - анілінофарбового промисловість, значно збагатила палітру природи. Англійським хіміком Перкін, за допомогою аніліну була отримана в 1856 році штучна фарба фіолетового кольору - мовеин. Майже одночасно з ним російським ученим Натансоном синтезований фуксин - червона фарба. А потім дійшла черга до пурпура, який з незапам'ятних часів добували з молюска Мурекс, що живе в Середземному морі. Для фарби однієї королівської мантії доводилося виловлювати кілька тисяч черепашок. Кармазин ж з кам'яновугільної смоли виявився краще, красивіше природного. Було синтезовано і індиго - «король фарб». Коричневу сепію перш «поставляли» морські каракатиці, а червона фарба (кармін) створювалася жучками кошеніль, що живуть на листках кактуса. З кореневищ тропічної марени витягувався алізарин - яскраво-червона фарба. Тепер їх отримують штучно на хімічних заводах так само, як і тисячі інших фарб, які застосовуються в багатьох галузях промисловості. Все ширше використовуються в народному господарстві "фарби-хамелеони», які змінюють свій колір під дією кислот, лугів або високої температури.
Відкриття Зинина не тільки збагатило палітру природи. Анілін служить також сировиною для створення ліків та інших речовин. Гофман - батько аніліновою галузі в Німеччині так оцінив подвиг Зинина: «Якби Зінін не зробив нічого більш, крім перетворення нітробензолу в анілін, то і тоді його ім'я залишилося б записаним золотими літерами в історію хімії».
Між іншим. Що там не кажи, а свято фарб на тканинах не так вже довгий. Після прання забарвлення тьмяніє. Згубно для них тривале перебування на сонці - вони вигорають. Хіміки зрозуміли, в чому справа, і налагодили випуск так званих активних фарб. Вони не линяють після прання, не вигоряють. Чому? Виявляється, такі фарби вступають в хімічну взаємодію з волокнами і утримуються на їх поверхні за рахунок більш міцних сил молекулярного зчеплення.
До середини минулого століття вчені могли синтезувати десятки органічних речовин. Але найчастіше вони діяли наосліп, на дотик. Позначалася відсутність чіткої теорії. Про настрої вчених тоді, Велер говорив: «Органічна хімія може в даний час кого завгодно звести з розуму. Вона представляється дрімучим лісом, повним чудових речей, величезною хащами без виходу, без кінця куди не наважуєшся проникнути ».
Положення і справді склалося скрутне. Вчені могли визначити, з чого побудовано речовина, а ось здійснити синтез - створення, їм не завжди вдавалося. Тут вже треба знати не тільки з яких елементів складається той чи інший продукт, а й як ці атоми вбудовані в молекулу. Хіміки нагадували будівельників, які, маючи будматеріали, все-таки не могли звести будівлю.
Значення робіт Олександра Михайловича Бутлерова
Праці геніального російського вченого Олександра Михайловича Бутлерова зіграли роль широкої просіки в «дрімучому лісі», вивели науку з глухого кута. Він спростував висновки філософа-ідеаліста Канта, який стверджував, що пізнати будову молекул неможливо. На 36-му з'їзді німецьких вчених, Бутлеров оприлюднив свою чудову теорію будови хімічних речовин. Коли він залишав трибуну, то мужі науки витратило не аплодували йому. Їм здавалося, що молодий російський хімік обдурює їх.
А Бутлеров спокійно дивився поверх сивого голів, формених ґудзиків і орденів. Він перевірив свою теорію сотнями дослідів, багато розмірковував. За його плечима - глибокі дослідження з окислення органічних сполук, відкриття уротропіну. Їм вивчені ефірні масла. Бутлеров впевнений: мине небагато часу, і хіміки навчаться створювати в своїх лабораторіях речовини, над якими довгий час працювала природа. Але вони не зупиняться на цьому і вступлять з нею в змагання, отримають продукти небачених якостей і властивостей.

Александр Михайлович Бутлеров
Прав був російський вчений. Створена ним теорія хімічної будови речовини ось уже на протязі майже двісті років є невичерпним джерелом відкриттів. Вона відразу ж отримала бойове хрещення, блискуче пояснивши ряд питань, перш за абсолютно незрозумілих. Ось такий приклад. Послідовники Берцелиуса були переконані, що речовина змінює свої властивості лише після того, як зміниться його складу. Наприклад, з певної кількості атомів, будь-яких елементів може складатися тільки одна речовина. Але раптом з'ясовується, що однаковий набір атомів має і етиловий спирт, і диметиловий ефір. Прихильників Берцелиуса це надзвичайно збентежило. А Бутлеров? Як він поставився до такого парадоксу природи?
Алотропія
Вивчення простих речовин і їх властивостей надзвичайно важливо для неорганічної хімії і закладає основу для її вивчення. Кардинальна особливість простих речовин полягає в тому, що при розгляді їх властивостей не потрібно враховувати зміни їх складу, оскільки він завжди один і той же. Але і у простих речовин необхідно приділити особливу увагу явищу аллотропии. Це дозволить виявляти залежність властивостей речовин від їх хімічної будови.
Аллотропия (від грецького «tropos» - ознака) - це процес, при якому один хімічний елемент може трансформуватися в два або більше простих речовин. Наприклад, атоми кисню можуть перетворитися в два інших різних речовини - кисень і озон, а сірка - кристалічну і пластичну сірку. Речовини, які утворилися з атомів одне хімічного елемента, називають алотропна модифікаціями цього елемента. Аллотропия викликана разнящимся набором молекул в простому речовині або різним місцезнаходженням частинок в кристалічній решітці цієї речовини.

У 1841 році явище аллотропии стало відомо науці завдяки вченому Йенс Якобу Берцелиусу, пізніше ретельні і довгі дослідження цього явища були пророблені А. Шреттера. У 1860 році, незабаром після того як був відкритий закон Авогадро, за яким в речовинах одного обсягу, де встановлені рівні температури і тиск, існує рівну кількість молекул, вчені зрозуміли, що елементи мають можливість перебувати в формі молекул з безліччю атомів. Наприклад, О2 - кисень і О3 - озон. На самому початку двадцятого століття стало зрозуміло, що відмінності в кристалічній конструкції простих речовин - це ще одна причина аллотропии.
Алотропні модифікації
На сьогоднішній день налічується більше чотирьохсот аллотропних модифікацій простих речовин. Наприклад, алмаз і графіт - це аллотропние модифікації вуглецю, хоча ці речовини зовні абсолютно несхожі. У графіту структура гексагональная шарувата, а у алмазу виглядає як правильно поєднана з один одним сітка тетраедричних утворень.
Іноді це явище об'єднують з поліморфізмом. Це можливість речовин твердого агрегатного стану знаходиться в двох або більше видозмінах з різною кристалічною побудовою і властивостями при однаковому хімічному складі. Але аллотропия має відношення лише до простих речовин, незалежно від їх агрегатного стану, а поліморфізм - до будь-якого твердого речовина, без вказівки на те, просте воно чи сложное.Несмотря на кількість аллотропних модифікацій у хімічного елемента, найстійкішим і не руйнується виявляється, в більшості, тільки одне. Ось приклади одних з найпоширеніших прикладів аллотропии речовин: углеродможет утворити безліч аллотропних модифікацій - алмаз, графіт, карбін і т.д. Кремній утворює два аллотропних видозміни: аморфний і кристалічний кремній.

Алотропні форми вуглецю: a) лонсдейліт; б) алмаз; в) графіт; г) аморфний вуглець; д) C60 (фулерен); е) графен; ж) одношарова нанотрубка
Різноманітність складних речовин спостерігається через їх різного кількісного складу. Його можна визначити по набору електронів, що знаходяться на електронному рівні атома і кількісний вміст протонів і нейтронів в ядрі. Але було виявлено, що хімічні елементи можуть утворювати різні варіації, у яких у ядер один і той же заряд, але при цьому у них різні маси. Такі різновиди атомів називаються ізотопами. Явища алотропії та ізотопії є підтвердженнями різноманіття неорганічних речовин.
Алмази та діаманти
Огранований алмаз отримує найвищу, не тільки грошову, а й естетичну цінність. Завдяки правильній огранювання кристал, приймає певну форму і перетворюється в діамант. Більшість алмазів огранювати в класичну форму. Ця кругла форма, яка налічує 57 граней, дозволяє легко вставити діамант в оправу прикраси.
При правильній огранювання сонячне світло в діамант заломлюється і відбиваючись розпадається на весь світловий спектр. Над діамантом виникає світлове заграва, яке ювеліри називають між собою «гра каменю».
Як утворюються алмази?
Природа освіти алмазів полягає в наступному. У земній корі на глибині близько 200-250 км під великим тиском кристалізується вуглець. Великий тиск магми виштовхує кристали наверх. Через деякий час, алмази разом з іншими породами, такими як піроп і олівін піднімаються до поверхні землі і утворюють так званих «Кімберлітові трубки», які отримали назву «Корінні родовища». Крім цього, алмазні розсипи іноді зустрічаються на берегах північних річок. Тому такі поклади алмазів називають розсипними родовищами. Лідери з видобутку алмазів - ПАР, Індія, Бразилія і Росія.
Чи знаєте ви, що?
Середній вік будь-якого алмаза - приблизно 1,5 мільярда років!
Сталь і чавун.Відмінності чавуну і сталі
Основою для виготовлення чавуну або сталі служить залізо. У природі це - метал з сріблястим відливом, який не має достатньої твердості. Такий метал практично не використовується в промисловості, а широке застосування отримали різні сплави заліза.
Чавун і сталь - це сплави заліза з вуглецем, але від змісту цих елементів і домішок буде залежати якість металу.
Чавун - первинний продукт металургії. У його складі міститься вуглецю понад 2% і значна кількість домішок, що впливають на властивості металу: марганець, фосфор, кремній, сірка, легуючі добавки.
Чавун відносять до крихких металів, його можна легко розбити на осколки при ударі, тому він менш практичний в обробці і застосуванні. Вид вуглецю, що міститься в чавуні, впливає на його властивості, тому розрізняють кілька видів чавуну:
- сірий, м'який метал з низькою температурою плавлення;
- білий, з підвищеною твердістю, але крихкий;
- ковкий, вторинний продукт білого чавуну;
- високоміцний.
Щільність чавуну складає 7000 кг / м3.
сталь
Процентний вміст вуглецю в сплаві не повинно перевищувати позначку 2%, а залізо становити не менше 45%. Решта 53% можуть містити різні легуючі добавки і домішки, які дозволяють змінювати його властивості.
Існує велика кількість різновидів і класифікацій. Залежно від кількості сполучних елементів розрізняють:
- низьколеговані;
- середньолеговані.
Також розрізняють за кількістю вуглецю:
- низьковуглецеві;
- середньовуглецеві;
- високовуглецеві.
На якість металу впливає наявність неметалевих включень (оксиди, сульфіди, фосфіди) і існує класифікація за якістю.
Загальна характеристика це - метал, що володіє хорошою міцністю, зносостійкість, твердість, придатний для різних видів обробки. Щільність стали 7700 - 7900 кг / м3.
Не дивлячись, на велику кількість різновидів чавуну і сталі, можна виділити основні параметри відмінності цих металів:
- сталь має більшу міцність, пластичність і твердістю;
- більш пластична, тому добре піддається обробці (штампування, кування, прокатки, зварювання), вироби з чавуну виконують методом лиття;
- чавун має меншу вартість;
- сталь має високу теплопровідність, якість підвищують методом загартовування, а чавун через пористості металу здатний утримувати тепло;
- сплави мають різну питому вагу.
Металургія поставляє на ринок сотні різновидів того і іншого сплаву, які мають свої особливості і характеристики, але обов'язковими компонентами цих металів є залізо і вуглець. Тому сталь і чавун можна об'єднати в групу залізовуглецевих сплавів.

Активоване вугілля. Активоване вугілля - препарат, який можна зустріти в будинку навіть затятих супротивників медикаментозного лікування. Чому? Я думаю, тому що це найбільш нешкідливий препарат природного походження. З давніх часів це засіб використовується для фільтрації води, очищення організму від різноманітного сміття у вигляді шлаків, при діареї і отруєннях, навіть для відбілювання зубів і схуднення!
Популярності цієї речовини додає і той факт, що він безпечний не тільки для дорослих, але і для дітей, а також дозволений до вживання при вагітності. Зі статті ви дізнаєтеся, що представляє собою препарат, як приймати активоване вугілля і чи має він протипоказання.
Що являє собою ця речовина
Активоване вугілля отримують з найрізноманітніших органічних матеріалів, що містять вуглець. Матеріалом для звичного для нас ліки може послужити деревне вугілля, нафтовий або кам'яновугільний кокс, кісточки абрикоса, шкаралупа волоського або кокосового горіха.
З точки зору хімії це речовина складається з вуглецю на 88-97%, все інше - це водень, сірка, азот, кисень і ін. Самим найближчим родичем за хімічним складом вугілля припадає графіт, включаючи той, який використовується в звичайних олівцях.
Активоване вугілля є «активованим», завдяки величезній кількості пір, які, в свою чергу, утворюються під час спеціальної обробки. Завдяки цьому, він здатний вбирати в себе різні забруднювачі і токсини, а потім утримувати їх на своїй поверхні. Такі речовини називають сорбентами. Я вже розповідала про один дуже цікавому сорбенте - бентонітової глини.
Як отримують?
Насамперед сировину подрібнюється в спеціальних апаратах до 3-5 см частинок, які одразу ж піддають випалу при повній відсутності повітря і дуже високій температурі. На цьому етапі вуглинки отримують свій пористий каркас, але, тим не менш, пористість цього продукту ще досить низька. На наступному етапі необхідна активація, яка досягається двома методами:
Термохимический метод. Сировина обробляють розчином карбонату калію або хлориду цинку, після чого в умови відсутності повітря нагрівають до 400-600 градусів.
Парогазовий метод. Сировина обробляється або вуглекислим газом, або сильно розігрітим паром, або ж їх сумішшю при температурному режимі в 700-900 градусів.
Після активації готовий матеріал охолоджується, сортується, розсіюється, подрібнюється і висушується. Кінцевим етапом виробництва є упаковка.
Для чого приймають
Спочатку давайте визначимо, з якими проблемами нам може допомогти впоратися цей сорбент. Чорні пігулки допоможуть:
при отруєнні (харчовими продуктами або алкоголем);
при проносі;
при метеоризмі;
для усунення симптомів при алергії. Хоча є інша точка зору - навпаки, активоване вугілля може погіршити симптоми алергії. Тому обов'язково порадьтеся з лікарем, не займайтеся самолікуванням!
як допоміжний засіб при схудненні.
Дози і схеми лікування порушень процесу травлення за допомогою цієї речовини в кожному випадку приблизно однакові. Однак варто все-таки знати, як правильно розраховувати дозу препарату, і як часто його можна вживати.
Правила застосування
Запам'ятайте кілька простих правил:
Пити сорбент потрібно за годину до або через годину після їжі в лікувальних цілях.
Якщо ви вирішили спробувати методику схуднення за допомогою вугілля, то в цьому випадку чорні пігулки п'ють за півгодини до їди.
Обов'язково запивайте вугілля великою кількістю води.
Варто пам'ятати, що вугілля разом з усякою гидотою видаляє з організму і корисні речовини, мінерали, вітаміни. Саме тому після тривалого вживання цього препарату, варто пройти вітамінно-мінеральний комплекс, щоб відновити свої запаси.
Застосування вугілля знижує ефективність інших медикаментів, так як сорбент поглинає і виводить їх з організму разом з шкідливими речовинами.
Відомо, що дозування вугілля для кожної людини може відрізнятися. Щоб розрахувати, скільки таблеток потрібно випити саме вам, скористайтеся простою схемою: 1 таблетка на 10 кг вашої ваги. Це означає, що при вазі 70 кг, вам необхідно буде випити за раз 7 таблеток.
При серйозних симптомах сорбент можна приймати до 4 разів на день. Коли гострі симптоми пішли, то вугілля п'ють один раз вранці, другий раз вже перед сном.
Що стосується того, як довго можна приймати вугілля, тут думка лікарів приблизно однакове. Його рекомендують пити не довше 10-ти днів, після чого необхідно робити місячну перерву. Інші схеми лікування, як правило, обговорюються з лікарем.
Для схуднення
Незвичайні способи схуднення завжди були в моді. Ця тенденція не обійшла стороною і звичний для нас сорбент. Однак сам по собі вугілля ніяк не допомагає спалювати калорії. Самі автори методики говорять про те, що вугілля може допомогти очистити кишечник від токсинів, які нерідко стають причиною погіршення обміну речовин і поганого самопочуття.
Відгуки схудлих людей за допомогою вугільної дієти тільки підтверджують цей факт. Без спорту і правильного харчування вугілля скинути зайві кілограми ніяк не допоможе.
Наведу дві короткі схеми вживання:
Розрахуйте потрібну кількість таблеток по схемі, наведеній вище. Це буде вашою разової дозуванням. Пийте вугілля 3 рази в день перед їжею.
Друга схема більш щадна, на мій погляд. Вам буде потрібно всього 10 таблеток в день. Вживати по 3-4 шт перед кожним прийомом їжі.
Не забувайте, що довше 10 днів поспіль не варто вживати цей препарат. Обов'язково робіть перерву.
Протипоказання
Отже, які ж у цього природного сорбенту є протипоказання? Давайте з'ясуємо.
В першу чергу, не варто вживати ці ліки людям, які страждають від виразкової хвороби. Справа в тому, що коли вугільна маса адсорбується на виразках, це може викликати запальні процеси, що тільки погіршить ситуацію.
При гастриті зі зниженою кислотністю також цей препарат не рекомендується до застосування.
Не вживайте вугілля при запорах. активоване вугілля при болях в животі
Історичні факти.Історики свідчать про те, що активоване вугілля використовувався ще за часів процвітання стародавніх цивілізацій. У Стародавній Індії та Стародавньому Римі сорбент використовувався для очищення води і вина. Стародавні єгиптяни ще в 1500 році до н.е. стали використовувати вуглинки в лікувальних цілях.
А що щодо нашого часу? У 18 столітті німецький хімік К. Шеєле встановив, що ця речовина здатна знебарвлювати рідина. Трохи пізніше було виявлено, що вугілля відмінно очищає спирт і здатний значно підвищити якість вина, якщо просто кілька разів струснути вино з вугільним порошком.
У 19 столітті вугілля стали використовувати для освітлення цукрового сиропу. У той же час, аптекар провів на собі експеримент, прийнявши всередину 1 г сильного отрути, одночасно проковтнувши 15 г активованого порошку вугілля. Саме тоді, в 1830 р була відкрита здатність цієї речовини адсорбувати отрути.
Особливо активно в якості антидоту вугілля стали використовувати в період Першої світової війни. Тоді як фільтр в протигази використовували вугілля, щоб солдати могли без втрат пережити атаки отруйними газами.
До цього дня ця речовина вважається найкращим матеріалом, що фільтрує, крім того, його виробництво обходиться досить недорого, що робить його абсолютним лідером в цій сфері.
Гуталін. Дуже хороший адсорбент - вугілля. Причому не кам'яний, а дерев'яний, и не просто селі, а активний (актівоване). Таке вугілля продають в аптеках, зазвічай у виде таблеток. З него и почнемо Досліди по адсорбції.
Приготу блідій розчин чорнила будь-которого кольору и налійте в пробірку, но не доверху. Покладіть в пробірку таблетку активного вугілля, краще потовченого, закрійте пальцем и струсіть як слід. Розчин посвітлішає на очах. Поміняйте розчин на Який-небудь Інший, но теж пофарбованій - нехай це буде розбавлена гуаш або акварель. Ефект виявило таким же. А если взяти просто шматочкі деревного вугілля, то смороду будут поглінаті барвник значний слабкіше.
В цьом немає нічого дивного: актівоване вугілля відрізняється від звичайна тім, что у него набагато більша поверхня. Его частинки буквально пронізані порами (для цього вугілля особливо способом обробляють и відаляють з пего домішки). А если адсорбція - це поглінання поверхні, то ясно: чим более поверхня, тим и поглінання краще. Адсорбенти здатні поглінаті Речовини НЕ только з розчінів. Візьміть півлітрову Скляна банку и капніть на дно одну краплю одеколону або будь-которого Іншого пахучого Речовини. Обхопіть банку долонях и потрімайте ее так з півхвіліні, щоб немного нагріті пахучих рідіну - тоді вона буде швідше віпаровуватіся и сільніше пахнути. Як Прийнято в хімії, что не нюхати Речовини прямо з склянки, а легкими помахамі руки направте до носа повітря разом з парами речовини;
Чим білий вугілля відрізняється від чорного і де застосовується
В продовження розпочатої нещодавно «вугільної» теми розповім про те, що сама тільки недавно дізналася. Нещодавно в аптеці на вітрині побачила чорну коробочку з білими буквами «Білий вугілля». Здивувалася майстерності маркетологів, ухитрився поєднати непоєднувані, подумки здивувалася і посміялася над собою - чому я нічого не знаю про таке речовині, посміхнулася лінгвістам: а ви говорите, біла сажа - це оксюморон.
Примітка: фото не моє, взято з інтернету.
Прийшовши додому, стала шукати інформацію про це «осюмороне» і радіти - то чи добре, що я не знаю про таке ліки, чи то не дуже ...
В результаті з'ясувалося, що це вугілля - зовсім не вугілля (нагадую, хімічний елемент вуглець), а оксид (диоксид) кремнію. На жаль, мені так і не вдалося з'ясувати, звідки ноги ростуть у цієї дивної назви, навіщо заплутувати людей. Так що, якщо ви знаєте, напишіть в коментарях, буде цікаво дізнатися.
Виявляється, це дуже потужний сверхвисокодісперсний сорбент з площею активної поверхні більш 400м2 / г. Відповідно, його сорбційні властивості набагато вище, ніж у звичного нам активованого вугілля.
В одній таблетці міститься 210 мг діоксиду кремнію, плюс мікрокристалічна целюлоза (скорочено МКЦ). Якщо говорити дуже узагальнено, то це харчові волокна також з дуже високим поглинанням, які дуже добре впливають на роботу шлунково-кишкового тракту. Наприклад, крім сорбційних властивостей, стимулює моторику кишечника, в результаті чого з нього активно виводяться токсини.
Для чого застосовують білий вугілля? Це такі захворювання, як:
• кишковий токсикоз,
• інфекційні та неінфекційні діареї,
• коліти,
• екзема,
• псоріаз,
•атопічний дерматит,
• вірусний гепатит,
• хронічна ниркова недостатність,
• пізні гестози вагітних.
Інструкція по застосуванню рекомендує приймати в добу в середньому 2-12 грам або 9 таблеток (порівняйте з активованим, якого потрібно 20-30 грам або 100 таблеток). Це обумовлено як раз тим, що його сорбційні властивості набагато вище, ніж у активованого.
У попередній статті я розповідала, які вимоги висувають до сучасних ентеросорбенту. Білий вугілля в повній мірі відповідає цим вимогам. Крім того, його зручно брати - не потрібно розжовувати або попередньо подрібнювати, а досить просто запити водою.
Що добре в порівнянні з тим же активованим вугіллям (карболеном), кремнієвий сорбент НЕ сорбує воду, вітаміни і мікроелементи. Тому можна не побоюватися запорів і гіповітамінозу і приймати його більш тривалий час, ніж вугілля.
До речі, діоксид кремнію випускається не тільки під назвою білий вугілля, він також може називатися:
Цікаві факти про активоване вугілля
Не так давно я розповідала про прості досліди з активованим вугіллям, які можна самостійно зробити вдома, а сьогодні хочу розповісти кілька цікавих фактів про активоване вугілля. З огляду на те, що сьогодні це засіб досить популярно і у багатьох на слуху (наприклад, вугільне морозиво, всякі способи очищення організму і т.д.), думаю, буде цікаво.
Трішки історії
Можливо, люди давно помітили сорбційні властивості деревного вугілля (від латинського sorbens - поглинаю), але перше задокументоване підтвердження цього явища було зроблено тільки в кінці 18 століття. У 1773 році шведський хімік Карл Шеєле (так, автор лимонаду) вивчав адсорбцію газів на деревному вугіллі. А в 1785 році російський хімік Товій Єгорович Ловиц виявив, що вугілля може знебарвлювати деякі рідини. Це відкриття привело до першого промислового застосування деревного вугілля - його стали використовувати на заводі з виробництва цукру (для очищення цукрового сиропу) в Англії в 1794 році.
19-е століття пройшов в енергійному вивченні самих різних вугілля - від деревного до кістяного - їх отримання, властивостей, застосування. Основними областями застосування було виробництво цукру і виноробство. І, нарешті, в 1900 році були запатентовані два способи отримання активованого вугілля:
1. нагрівання рослинних матеріалів з хлоридами металів;
2. активування за допомогою діоксиду вуглецю і водяної пари при нагріванні.
Саме другий метод і є в даний час основним способом отримання активованого вугілля.
як отримують
Основна сировина - природні матеріали: деревне вугілля, деревна тирса, торф, вугілля з шкаралупи волоського горіха, кам'яне вугілля, кокс, буре вугілля і т.п.
Так, наприклад, близько 36% вуглецевих сорбентів отримують з деревини, на другому місці за поширеністю - кам'яне вугілля (28%). З бурого вугілля виробляють 14% пористих вуглецевих матеріалів або ПУМ (так часто називають активоване вугілля), з торфу - близько 10%.
Коли я збирала матеріал для статті, мені було цікаво дізнатися, що приблизно 10% виробляється з шкаралупи кокосових горіхів. От уже ніколи б не подумала про таке сировину. Настільки воно нетипово і незвично для наших реалій, а ось для кого-то це в порядку речей
У звичайному вугіллі пори закриті, він не може поглинати в себе інші речовини, потрібна його активація. Саме для цього й існують різні технології активації, тобто розкриття пір, збільшення їх кількості та розмірів.
Основний принцип - вихідний матеріал поміщають в печі і обробляють сумішшю повітря, водяної пари і вуглекислого газу при температурі 800-1000 градусів Цельсія. При цьому відбувається зміна структури матеріалу і утворення в ньому великої кількості пір (саме звідси і пішла назва ПУМ - пористі вуглецеві матеріали), які і визначають властивості і застосування активованого вугілля.
Як правило, площа активної поверхні 1 грама такого вугілля становить 1-4 квадратних метра.
Будова.
Думаю, багато хто з вас чули фразу «вугілля очищає» або «вугілля - це молекулярне сито». А як саме він очищає і що це за сито таке?
Справа в тому, що активоване вугілля - це найдрібніші кристали, що складаються із сполучених між собою плоских шестигранників, утворених атомами вуглецю. Ці шестигранники утворюють шари, безладно зрушені відносно один одного. Таким чином, утворюються мікропори, які і забезпечують затримування в вугіллі самих різних молекул інших речовин. Саме тому такий матеріал називають, крім всіх вже прозвучали назв, вуглецевими молекулярними ситами (до речі, є ще дуже цікаві неорганічні молекулярні сита, цеоліти). Також ви, напевно, часто чули слово «сорбент» - це теж про вугілля, якраз за рахунок великої кількості пір він є відмінним сорбентом.
До речі, активоване вугілля - це не тільки хімічний елемент вуглець, тут є й інші елементи, які потрапляють в нього в процесі отримання:
• 93-94% вуглецю;
• 0,7-1% водню;
• 4,7-5,3% кисню;
• 0,3-0,6% азоту
• і деякі інші в микроколичествах, наприклад, хлор або сірка.
застосування
Виробництво пористих вугільних матеріалів в усьому світі становить близько мільйона тонн на рік. Для чого ж все це потрібно? Навіщо людству таку кількість активованого вугілля? Що, все дружно отруїлися? Звичайно ж ні. Застосування в медицині стоїть на останніх місцях за кількістю витрачається вугілля (далі я не завжди буду використовувати слово «активоване», щоб не перевантажувати текст).
Основні області застосування:
• очищення повітря і газів в промисловості;
• очищення розчинів в промисловості;
• адсорбція парів бензину, що виділяються машинами;
• очищення повітря в приміщеннях, де знаходиться багато людей (наприклад, аеропорти);
• противогазовая захист людей від шкідливих речовин (протигази);
• виробництво захисних тканин (вони містять дрібнодисперсний активоване вугілля і захищають людину від токсичних газів);
• використання в якості каталізатора в деяких технологічних процесах;
• збагачення металів (наприклад, золота);
• використання в якості фільтра в деяких сигаретах;
• звичайно ж - застосування в медицині (про це я розповім окремо).
Що стосується розчинів, хочу трохи докладніше сказати, що сюди входить:
• очищення цукрового сиропу при виробництві цукру;
• очищення харчових жирів і масел;
• очищення лікарських препаратів (наприклад, желатину, кофеїну, інсуліну, хініну );
• очищення спирту, пива, вина, фруктових соків;
• очищення питної води;
• очищення побутових і промислових стічних вод.
Якщо зовсім в загальних рисах, тобто ось такі цифри споживання вугільних матеріалів:
Звичайно ж, для всіх цих цілей використовуються різні ПУМ. Вони відрізняються між собою багатьма параметрами, наприклад, розмірами пір (що впливає на їх сорбційні властивості), здатністю смачиваться водою (гідрофільність), чистотою, тобто кількістю домішок, міцністю, складом і т.д. Навіть ціна матеріалу має велике значення при великомасштабному використанні, наприклад, при очищенні газових викидів заводів.
І один момент, над яким мало хто замислюється - а що відбувається з вугіллям, чиї пори повністю заповнені «забруднювачами»? Ідеальний варіант, звичайно, реактівірованіе, тобто регенерація - видалення адсорбованих речовин і повторне використання вугілля.
Але тут багато мінусів - вугілля вельми неохоче віддає те, що вже забрав. Необхідно спеціальне обладнання для регенерації, створення спеціальних умов (наприклад, підвищена температура), використання додаткових хімічних речовин, енерговитрати. Саме тому реактівірованіе далеко не завжди використовується.
Використання в медицині
Про медичне застосування деревного вугілля відомо ще з 1550 року до н.е. зі старого єгипетського папірусу. Крім того, в 400 році до н.е. Гіппократ розповідав про лікування отруєнь за допомогою вугілля.
В даний час активоване вугілля використовується як ентеросорбент - так називають препарати, що володіють високою сорбційною ємністю, при цьому не руйнуються в шлунково-кишковому тракті і здатні зв'язувати різні потрапили в організм речовини. Основні способи зв'язування:
• адсорбція,
• іонний обмін,
• комплексообразование.
Активоване вугілля продається в аптеках у вигляді таблеток і порошку. Якраз нещодавно я шукала інформацію по вугіллю в довіднику Комаровського «Ліки» і була вражена, скільки ж, виявляється, препаратів є у звичайного активованого вугілля! Белосорб, карбактін, карболонг, карбомікс, карбосорб і ще багато інших «карбо» (від латинської назви елемента вуглецю). Тут і порошки, і гранули, і капсули.
Тільки ось пошук по інтернет-магазинах наших казахстанських аптек показав сумну картину - тільки класичний активоване вугілля в таблетках по 0,25 г.
А також його «бужуйсткіе» аналоги з Нідерландів та Австрії. Посміємося разом над цінами за той же самий вугілля по 0,25 г (в Еукарбон - 0,18 г).
Загалом, ситуація аналогічна фізрозчин, про який я колись розповідала.
Гаразд, повертаємося до вугілля і через брак порошків говоримо про таблетках. Їх готують з активованого медичного вугілля з додаванням сполучного речовини, яке втрачає свої властивості в шлунку, наприклад, крохмалю, желатину. Іноді для таких препаратів використовують медична назва - карболен.
Основна область застосування карболену в медицині - лікування інфекційних захворювань шлунково-кишкового тракту. Вугілля адсорбує токсини, що виділяються бактеріями, а також шкідливі речовини, що утворюються в результаті запалення шлунково-кишкового тракту.
Також успішно застосовується при харчових інтоксикаціях, отруєннях алкалоїдами і солями важких металів, при підвищеній кислотності шлункового соку.
Перевага цього сорбенту в тому, що він відповідає вимогам, що пред'являються до ентеросорбенту:
• він нетоксичний;
• добре виводиться з організму;
• не пошкоджує шлунково-кишковий тракт;
• володіє високою сорбційною ємністю;
• має зручну форму;
• його легко дозувати;
• володіє хорошими органолептичними властивостями.
Напевно, багато хто чув про модні зараз «чистках» організму, в тому числі і активованим вугіллям. Не буду зараз говорити про медичному сенсі цих процедур, відішлю вас до лекцій (мої улюблені ця і ця) дипломованих і досвідчених лікарів, скажу тільки як хімік, що більшість сорбентів, в тому числі і так улюблений усіма «чистильниками» активоване діють не вибірково. Простіше кажучи, вони сорбують все підряд.
Ви думаєте, вугілля у вас в шлунку або кишечнику підходить до речовини, дивиться вивіску на ньому «Вітамін» і говорить: «Ні, я не буду тебе вбирати, а краще займуся парочкою молекул миш'яку, який тобі, напевно, дружина в суп підсипала» ? Немає такого. Сорбируется все підряд - і непотрібне, і потрібне - вітаміни, амінокислоти, гормони, ферменти і т.д.
Звичайно, я зараз говорю дуже примітивно і спрощено. Хімік-професіонал може зі мною посперечатися щодо розмірів пір сорбенту, розмірів молекул і т.д., але це все в більшості сорбентів, а особливо в тому ж активованому вугіллі, про очищення яким з таким побожним придихом говорять в інтернетах, практично не відіграє суттєвої ролі. Сорбироваться буде все.
Саме тому не рекомендується тривале застосування ентеросорбентів. Це призведе до гіповітамінозу і запорів, так як молекулярні сита активно сорбують і воду, і вітаміни, і мікроелементи. І, відповідно, виводять їх з організму, позбавляючи його корисних речовин. Набагато краще в цьому плані ситуація з кремнієвими сорбентами, про які я напишу в одній з наступних статтях.
Також через відсутність виборчої сорбції не можна приймати сорбенти одночасно з ліками, а розносити їх по часу прийому на 2-3 години.
З цієї ж причини карболен та інші подібні речовини призначають приймати натщесерце за 1-2 години до їжі. За цей час препарат вступить в реакцію з вмістом шлунку і встигне частково переміститися в кишечник, де продовжить свою корисну роботу по рятуванню вас від токсинів.
Ще одна цікава область застосування в медицині - гемосорбенти. Вуглецеві гемосорбенти використовуються для очищення крові хворих. Гемосорбция, заснована на здатності сорбентів видаляти з крові різні шкідливі речовини при певних захворюваннях (інфекційних, онкологічних, алергійних, аутоімунних і т. Д.).
Зараз цей напрямок вважається перспективним методом сорбційної детоксикації організму. У багатьох лабораторіях світу йде розробка і синтез нових вуглецевих композиційних матеріалів, що володіють унікальними властивостями, наприклад, сумісністю з кров'ю та іншими біологічними рідинами організму, інертністю до тканинам внутрішніх органів, виборчої сорбції токсичних речовин і т.д.
Графен. Графен часто називають сверхматеріалом, і це перше і найдивовижніше речовину серед так званих наноматеріалів, єдина субстанція, що складається з одного шару атомів. Це повністю вуглецеве речовина, яке можна виготовляти шаром товщиною в один атом, на планеті немає нічого легше - і міцніше. З одного квадратного метра графенового листа - товщиною в один атом, не забудемо, - вийде гамак, фортеці та гнучкості якого вистачить на цілого кота, хоча важити він сам буде, як один котячий вус. Графеновий гамак для кота буде ще і прозорим - повне враження, що кіт висить в повітрі, а електрику цей гамак буде проводити краще міді. Якщо вірити рекламному шуму, графен покладе край нашим стражданням з телефонними зарядками і дозволить нам заряджати електромобілі за лічені хвилини.
Гейм, звичайно, не претендує на відкриття цього суперматеріал: про його існування знали інші хіміки і навіть були близькі до його отримання, проте він і його колега по Нобелівської премії Костянтин Новосьолов виявили надійний, хоч і комерційно сумнівний метод отримання графена з графіту. Вони просто взяли шматок графіту і зняли з його поверхні шар графена за допомогою клейкої стрічки. Графіт - та ж штука, з якої роблять грифелі для простих олівців, і це просто стопка сотень тисяч графенових листів з досить слабкими зв'язками між ними. Гейм з Новоселовим цього не розуміли, поки не придивилися до шматка клейкої стрічки, якою чистили шматок графіту.
Хоча є деякі розбіжності в тому, хто і коли саме першим виділив графен, немає ніяких сумнівів, що статті, які майбутні нобелівські лауреати опублікували в 2004 і 2005 роках, багато що змінили в уявленнях вчених про цей матеріал. До того часу дехто не вірив, що лист вуглецю в один атом товщиною виявиться стійким. У дослідженні 2005 року було перевірено надзвичайні якості графена як електропровідниками, і тепер вони викликають пильний інтерес. Будь-які слова про графенові транзистори і гнучку електроніку, в тому числі і про що гнуться телефони і сонячні батареї, прозвучало чимало.
Графен - це не тільки електричні властивості: все. що в триста разів міцніше сталі і важить при цьому менше міліграма на квадратний метр, напевно має і інші застосування. Ось тому в 2013 році виробник спортивного інвентарю Хед оголосив про включення графена в ручки нових тенісних ракеток. З такою ракеткою Новак Джокович переміг у Відкритому чемпіонаті Австралії в тому ж році. Тут не вгадаєш, це він через графена виграв або сам по собі, але спосіб рекламувати ракетки відмінний.
У 2012 році двоє дослідників з університету Каліфорнії в Лос-Анджелесі оголосили, що створили мікросуперконденсатори на базі графену - на зразок маленьких довгограючих батарейок, заряджатимуться за кілька секунд. Аспіранту Махер Ель-Каді вдалося забезпечити електролампочку енергією на цілих п'ять хвилин, зарядивши її за кілька секунд за допомогою фрагмента графена. Ель-Каді і його науковий керівник Річард Кей-нер незабаром знайшли спосіб виготовляти такі прилади за допомогою лазера в ОУЕ-рекордері і мають намір створити
виробничий аналог, щоб можна було інтегрувати ці крихітні джерела енергії у що завгодно, від мікрочіпів до імплантатів типу кардіостимуляторів.
ГРАФЕНОВИХ САНДВІЧ
Прекрасна електропровідність графену пояснюється тим, що кожен вуглецевий атом в цій плоскій сітчастої структурі має один вільним електроном. Ці вільні електрони носяться по поверхні як переносники заряду. Заковика, скоріше, в надмірній електропровідності графена. Напівпровідникові матеріали типу кремнію (див. С. 96), які виробники чіпів застосовують для створення мікросхем, корисні тим, що вони проводять електрику лише за певних умов, тобто їх провідність можна включати і вимикати. Ось чому вчені-економісти в графен домішки - або навіть перекладають його надтонкими шарами інших речовин, щоб виходили матеріали з більш керованими електричними властивостями. Ще одна незручність: виробляти графен в масових кількостях непросто і недешево. Зрозуміло, розпускати шматки графіту на графа-ші простирадла скотчем непрактично. В ідеалі матеріалознавцям б розробити спосіб отримання великих листів. Один з найбільш успішних методів - хімічне осадження з газової фази, тобто освіту шару атомів на якійсь поверхні, але цей метод вимагає надвисоких температур. Інші способи, дешевше, ще поки в стадії розробки, і в них застосовуються промислових масштабів блендери або відділення шарів графена від графітової маси ультразвуком.
ХТОСЬ заїкатися Про левітації?
Це все про графен. А що там Гейм говорив про інші свої експерименти? Він змусив левитировать воду, просто так виливши її в лабораторну електромагнітну установку. А ще він левітіровать жабу в міхурі води. А стрічка Гекко повинна була, за задумом, імітувати липучу шкірку на лапках гекона, але на жаль, так здорово, як у ящірки, зробити не вийшло, і ця задумка визнання не отримала.
Людина з незапам'ятних часів користується нафтою. Вона висвітлювала, правда, не дуже яскраво, житла стародавніх єгиптян, ассірійців, і греків. Нею топили вогнища і навіть лікувалися. Здавалося, «кров землі» вичерпала свої можливості. Але ось в 1745 році російський умілець Федір Прядун виділив з нафти гас. Потім був зроблений ще один крок: нафтоперегонний завод, побудований біля Моздока, вперше в світі почав випускати в великій кількості цей продукт. Технологію його отримання розробив кріпак Василь Дубінін разом зі своїми братами Герасимом і Макаром. Вони ж виготовили всю потрібну апаратуру.
З тієї пори штучне світло став змагатися з денним. Після того як чорна "кров землі» привела в рух перший двигун, попит на неї миттєво зріс. У незбагненно короткий термін вона стала незамінною їжею величезної армії моторів.
Вивчаючи нафту, вчені встановили, що в її склад входить кілька рідких і газоподібних органічних речовин - метан, етан, пропан, бутан, пентан, октан, парафін та інші. Було запропоновано кілька способів їх переробки. Дмитро Іванович Менделєєв в 1870 році створив постійно діючий апарат, перегоняющий нафту. Через кілька років інженер Шухов, знаменитого винахідника парових котлів, автора знаменитих металевих веж-гіперболоїдів (сама, велика з них споруджено в Москві на Шаболовці і служить для трансляції радіопередач), винайшов більш досконалий апарат, що дозволяє отримати з нафти набагато більше гасу і бензину, ніж їх витягували при звичайній перегонці.
А яким чином? Справа в тому, що звичайна перегонка велася при впливі температури 150-200 градусів і давала тільки 20% бензину. В апараті, винайденому Шуховим при високому тиску і температури з присутністю каталізаторів, складні і великі молекули вуглеводнів нафти розщеплювалися на короткі. А це і є бензин. Процес цей тільки на вигляд простий. Насправді ж їм важко керувати. Втім, судіть самі.
Як уже сказано, що нафта складається з декількох речовин. Якщо вибудувати по ранжиру їх молекули, то виявиться, що вони неоднакового «зростання». На лівому фланзі буде знаходитися сама крихітна молекула газу метану, в складі якої один атом вуглецю, утримує чотири атома водню. Якщо відірвати у двох метанових молекул по одному, а у трьох молекул по два атома водню за всіма правилами хімічного етикету - за допомогою високої температури і тиску, а також в присутності каталізатора, то вийде ось що. Осколки молекул створять «в складчину» ланцюжок, утворивши нову речовину - пентан. Але це вже не газ, а рідина. Нічого не звичайного тут немає. І в інших випадках у міру подовження молекул речовини мінятимуть свої властивості, з газоподібного стану переходити в рідкий, а потім і в тверде. Те, що називається газоліном, є сумішшю двох продуктів. Один з них має п'ять метанових ланок (пентан), а інший (гексан) - шість. Бензин складається з трьох речовин, які утворені з шести, семи і восьми метанових ланок. Гас - це суміш речовин з більш довгими молекулами. Якщо їх подовжити ще більше (до 12-15 метанових ланок), то вийдуть мастила. Речовини, що складаються з шістнадцяти і більше ланок, при звичайній температурі знаходяться вже в твердому стані - це так звані парафіни. Добре відомий вазелін має в своєму складі 16-17 метанових ланок. Кам'яновугільна ж смола, яка містить в собі найбільші молекули метанового ряду, тверда, як камінь.
Апарат Шухова великі і складні молекули нафти розщеплював на дрібні і прості. Молекула вазеліну, наприклад, розривається навпіл і перетворюється в дві молекули бензину.
Раніше цей процес йшов не завжди рівно. Далеко не всі молекули розривалися точно посередині. Траплялося, що вони розмикали ланцюжка ближче до кінця, утворюючи молекули газів, що складаються з декількох ланок. Пізнавши закони «хімічної крою», вчені навчилися отримувати з нафти необхідне. При високому тиску великі молекулярні ланцюга розриваються переважно посередині. В цьому випадку відбувається, здавалося б, парадоксальна річ: з нафти виходить більше бензину, ніж його в ній знаходиться! Якщо в 1909 році з тонни сировини витягували всього 110 кілограмів бензину, то з використанням методу Шухова вихід його становить майже півтонни.
Царська Росія не використала, проте, це чудове відкриття. У США ж воно отримало дуже широке поширення. Лише через багато років російський винахід повернулося на батьківщину, але вже під англійською назвою «крекінг» (від слова розщеплювати). Американці підрахували: якби не метод Шухова, то їм довелося б добути вдвічі більше нафти, щоб отримати ту саму кількість бензину.
Старійшина радянських хіміків академік Микола Дмитрович Зелінський удосконалив цей процес. У період громадянської війни, коли нафта Кавказу була недоступна, він використовував для отримання бензину соляровое масло і гас. Запропонований ним метод дозволив використовувати для отримання високосортного пального навіть вугілля і сланці. Значення цього відкриття важко переоцінити. Адже в світових запасах палива на частку природного нафти припадає незначна частина - 0,002 відсотка. Але двигуни не помруть «голодною смертю». Вчені навчилися отримувати пальне з найбільш худого вугілля і сланців.
Це відкриття дуже значне. Тому що частка нафти в світових запасах палива всього 0,002%. Але двигуни не помруть «голодною смертю». Вчені навчилися отримувати пальне з найбільш худого вугілля і сланців.
Ось так починалася ера нафти.
Спалах горючих рідин. Спалах - це запалення суміші парів горючої рідини і повітря при піднесенні полум'я. При спалаху горіння не буває повним, і полум'я не має високої температури і не запалює саму випаровується рідина. Коли загоряється остання, то явище відповідає поняттю «займання». Температура спалаху має велике значення в техніці безпеки і стоїть в прямому зв'язку з пружністю пара, тобто здатністю речовини випаровуватися в більшій чи меншій мірі.
Чим нижче температура кипіння речовини, тим нижче лежить його температура спалаху: у бензину, наприклад, нижче 0 ° С. Не існує певної різниці температур між спалахом і займанням, хоча ця різниця тим менше, ніж однорідні речовина. Тому у гасу і мастильних масел інтервал між цими двома величинами може досягати 5-20 ° С і вище. У тих випадках, коли горючий продукт піддається нагріванню, наприклад, гас в лампових резервуарах в жарких приміщеннях, огнеопасность буде тим вище, чим нижче температура спалаху.
Законодавчі установи деяких країн обумовлюють найбільш низький температурний межа спалаху гасу, щоб усунути введення в гас фракції бензину. У нас встановлена межа в 28 ° С, але фактично спалах завжди лежить вище, так як комерційно невигідно при справжніх цінах на бензин вводити його в гас.
Спалах залежить і від тривалості зіткнення горючої речовини. Так, наприклад, палаюча цигарка гасне при опусканні в ефір, не запалюючи останнього. В кінцевому рахунку температура спалаху безпосередньо залежить від пружності пари речовини, а тому - і від барометричного тиску. Чим воно вище, тим вище спалах, а тому при визначенні такого роду треба вводити поправки на тиск атмосфери.
Визначення технічного характеру виробляються і спеціальних приладах, наприклад, прилади для гасу - Абель-Пенського (для температур до 50 ° С), для олій - Мартенс-Пенського (для температур до 200 ° С). Крім того, є прилади Бренко і Маркуссона. У двох останніх визначається також і температура займання.
Всі ці прилади являють собою металеву (у Бренко порцелянову) чашечку, в яку наливається певну кількість випробуваного продукту і опущений термометр. Повільно підвищуючи температуру нагріванням чашечки, через кожні 2-3 ° С підносять до поверхні рідини маленьке полум'я, спостерігаючи температуру, при якій відбувається спалах або потім займання.
Щоб отримати більш точні цифри, досвід повторюють кілька разів, беручи кожен раз нову порцію рідини. Піднесення полум'я і сама його величина повинні бути у всіх дослідах тотожні. Для цієї мети в деяких апаратах (Абель-Пенського і Мартенса) є механічні пристосування.
Різні мінеральні масла мають спалах від 150 ° С до 320 ° С. Для мастил температура спалаху є не стільки критерієм їх безпеки, скільки ознакою відсутності легко летючих частин, видалення яких в процесі роботи масла могло б занадто підвищити їх в'язкість.
Нафта. Були часи, коли нафта застосовували лише в старомодних лампах. Багато чого змінилося з тих пір, а все завдяки крекінгу - хімічному процесу, при якому сира нафта перетворюється в купу корисних продуктів, якими сповнений (і отруєний) наш сучасний світ, - від бензину до пластикових пакетів.
Подумати тільки: наші автомобілі їздять иа мертвечині. Бензин в основному складається з доісторичних рослин і тварин, які перебували йод тиском земних порід мільйони років, і з них вийшла нафту; її викачують і перетворюють в продукт, який ми, спалюючи, перетворимо в енергію. Тим, хто не знайомий з нефтехимией, частина «перетворення» може здатися дещо загадковою.
Хімічний трюк, за допомогою якого мертвечина, яку ми видобуваємо з-під каменів, тобто сира нафта, перетворюється в по- * Від англ, crack- корисними продукти, називається крекингом '. І на виході ми отримуємо ламати, розщеплювати. далеко не тільки паливо. Багато чого в нашому повсякденному житті взагалі-то продукти крекінгу. Що завгодно, зроблене з пластмаси (див. С. 160), наприклад, швидше за все початок своє життя на нефтеперегонном заводі.
Світ до крекінгу.У XIX столітті, до винаходу крекінгу, гас (див. «Авіаційне паливо», с. 62) був єдиним корисним продуктом переробки нафти. Гасові лампи були новомодним способом висвітлювати житла, хоча пожеж від них траплялося чимало. Гас отримували перегонкою нафти - нагрівали сировину до певної температури і чекали, коли гасова фракція википить і сконденсіруется. Бензин - інша фракція, що отримується при перегонці, проте він так швидко википає, що його просто зливали в якусь річку по сусідству, оскільки нафтопереробні підприємства нс знали, що з ним робити. Безліч можливостей, прихованих в сирої нафти, залишалися невідомими - але недовго.
У 1855 році американський професор хімії Бенджамін Сіллімен, думкою якого щодо видобутку корисних копалин і мінералогії завжди цікавилися, повідомив про «кам'яному маете», знайденому в окрузі Вснанго, штат Пенсільванія. Деякі спостереження, які він виклав В тому звіті, передбачили майбутнє нафтохімічної промисловості. Він зазначив, що, якщо важке кам'яне масло нагріти, воно поступово, протягом декількох днів, випаровується, видаючи по черзі легші фракції; їх-то якраз Сіллімен вважав потенційно корисними. Редактор з журналу «Американський хімік» пізніше зазначав, що Сіллімен «передбачив і описав більшість прийомів, які знайшли в подальшому застосування» в нафтохімічній промисловості.
Нині легкі нафтові фракції типу бензину -ті самі, які перші нефтотрейдери зливали в річки, - найбільша цінність. Саме винахід крекінгу зробило кам'яне масло потужним бізнесом - спочатку термічного, пізніше - процесів із застосуванням пара, а ще трохи згодом - сучасного каталітичного крекінгу, проведеного на синтетичних каталізаторах.
Хоча походження крекінгу не цілком відомо, патенти на термічний крекінг були видані в 1891 році в Росії і в 1912-му - в США. Поняття «крекінг» - майже дослівне опис того, що відбувається з хімічною точки зору: довгі вуглеводневі ланцюжка рвуться на молекули подрібніше. Процес крекінгу дозволяє впливати на склад зібраних в ході прямої перегонки продуктів відповідно до потреб господаря виробництва. Хоча бензин, який складається з молекул, що включають від п'яти до десяти вуглецевих атомів, можна отримувати прямий перегонкою нафти, крекінг дозволяє отримувати його набагато більше. Гасова фракція, наприклад, містить молекули з 12-16 вуглецевими атомами, і її теж, розщепивши крекінгом, можна переробити в бензин.
Перші крекінгові установки виробляли безліч коксу - вугільного залишку, який доводилося вигрібати раз в пару днів. Коли винайшли паровий крекінг, додаванням води невдача з коксом вирішувалася, проте продукти виходили не тієї якості, яке необхідно, щоб бензиновий двигун справно працював. Належної якості вдалося домогтися, коли додумалися до розщеплення нафти за участю каталізатора.
Спочатку хіміки застосовували гліноподобние матеріали під назвою цеоліти, що містили кремній і алюміній, поки не отримали штучні варіанти цих природних матеріалів в лабораторії.
При паровому крекінгу вуглеводні часто надходять в процес з одинарними зв'язками і розвалюються на молекули коротший, але з подвійними зв'язками. Цим можна скористатися і отримати різноманітні інші речовини. Однак з появою каталітичного крекінгу вуглеводні нс тільки розщеплюються - вони перебудовуються всередині, розгалужуються. Розгалужені вуглеводні - краще паливо, тому що двигун внутрішнього згоряння починає «стукати», тобто працює так собі через лінійних вуглеводнів, якщо їх перебір.
Безпосередньо перед Другою світовою війною в Маркус-Хук, Пенсільванія, була зібрана перша установка каталітичного крекінгу, і у союзників з'явився доступ до палива, якого нс було у німецьких люфтваффе. Сорок один мільйон барелів чудового авіапалива, отриманого на цій установці, збільшило, як кажуть, маневреність винищувачів союзників і тим самим дало їм перевагу в повітряних боях.
Каталітичні процеси не тільки дозволяють отримати відмінне паливо, вони взагалі серце хімічної промисловості: завдяки їм ми виробляємо найважливіші для сучасного життя речовини - наприклад, поліетилен. Якщо нафта рано чи пізно закінчиться, нам буде потрібно придумати альтернативні способи паз вчений і я цих продуктів. Виробники речовин вже тягнуть руки до живих рослин, а не до давно мергвим. Одна німецька компанія продає фарбу, зроблену з резеди - солодко пахне рослини, використовуваного в парфумерії.
Бензин. Автовождение подарувало нам свободу жити і працювати, як нам подобається. Де б ми були без нафти і досягнень в очищенні бензину? Але бензин - паливо, яке, ймовірно, найсильніше вплинуло на зміни клімату і на забруднення атмосфери Землі.
У усереднений день 2013 року жителі США споживали дев'ять мільйонів барелів бензину. Припустимо, справа була 1 січня. На наступний день, 2 січня. США спожили ще дев'ять мільйонів барелів, то ж - і третього. Так минуло 365 днів, поки за рік не вийшло понад три мільярди барре.чей - і це в одних лише США.
Основну частину цього фантастичного обсягу з'їли двигуни внутрішнього згоряння автомашин, які сукупно проїхали за цей час 4,8 трильйона кілометрів. Тепер уявіть, що всього 150 років тому ніяких машин не було (не рахуючи парових), бензиновий двигун внутрішнього згоряння ще навіть не винайшли, а перша нафта всього років п'ять як була здобута. Розквіт автомоторов на бензині перевершив навіть найсміливіші очікування.
Навіть на початку XX століття в США було всього 8000 зареєстрованих автомобілів, і всі вони повзали на швидкості нижче 32 км / ч. Але нафтова лихоманка вже почалася, і нафтові магнати на кшталт Едварда Доен - він став прототипом персонажа, якого зіграв Деніел Дей-Льюїс у фільмі -Нефть- (2007), - уже почали збивати свої мільйони. -Панамеріканская нафтова і транспортна компанія »Доен в 1892 році пробурила в Лос-Анджелесі першу в США свердловину. До 1897 му їх уже було 500.
Потреба в бензині росла швидше, ніж знання про нього хіміків. У 1923 році Карл Джонс з компанії «Стендерд Ойл», Нью-Джерсі, писав в журнал «Промислова та інженерна хімія», що в цій області ведеться прикро мало досліджень.
Між тим голлівудські зірки і нафтові мільйонери, в тому числі і Доен, каталися на дорогих автомобілях. Син Едварда Нед
купив своїй дружині машину, спроектовану в майстернях «Ерл Отомобайл». Вона була сталевого сірого кольору з шкіряним червоним салоном і лампами від «Тіффані». Головний дизайнер «Ерл Отомобайл» пізніше приєднався до «Дженерал Мотора», очолив там відділ декору і кольору і розробив стилі -каділлака », -бьюіка», «Понтіак» і «шевроле».
палкі амбіції
Завдяки зростаючому попиту на автомобілі та рішучості Генрі Форда задовольнити його за допомогою конвеєрного масового виробництва автозаправки почали виникати біля проїжджих доріг по всій країні. Розвиток процесів очищення нафти, в тому числі і крекінгу (див. С. 60), незабаром дозволило виробникам бензину домагатися якісних сумішей пального, на якому мотори працювали глаже.
Пальне в бензобаку вашої машини сьогодні містить сотні різних речовин, у тому числі і суміш вуглеводнів, а також добавки проти детонації, іржі та замерзання. Вуглеводні - поняття розтяжне і покриває собою величезне безліч лінійних, розгалужених, циклічних і ароматичних сполук. Хімічний склад компонентів бензину частково залежить від того, де видобули вихідну нафту. Сира нафта в різних точках планети має різні властивості, а ще різні нафти змішують між собою.
У двигуні внутрішнього згоряння бензин горить на повітрі, тобто горіння відбувається за участю кисню, в результаті виходить діоксид вуглецю. наприклад:
гептан + кисень = вуглекислий газ+ вода
Це приклад реакції окислення-відновлення, оскільки атоми вуглецю в гептан окислюються, а кисень відновлюється.
Всього кілька десятків років тому в бензин, щоб він не детонировал перш, ніж добереться до робочих частин двигуна, додавали тетраетилсвинець, і завдяки цьому згоряння палива відбувалося ефективніше. Але добавка тетраетилсвинцю повідомляла вихлопу додаткову отруйність: тетраетилсвинець реагував з іншого добавкою, 1,2-діброметаном, яка не поз валя л свинцю накопичуватися в двигуні, в результаті виходив шкідливий бромід свинцю. Бензин зі свинцевою присадкою почали витісняти вже в 1970-х, а виробники бензину взялися шукати способи палученія гладко палаючого високооктанового палива, на літрі якого можна було б проїхати бальшое кілометрів.
Крім цього лиха, у міру шквального розвитку автомобільної промисловості в XX столітті метушні к.та і інша: вихлоп вуглекислого газу в атмосферу просто зашкалив. Концентрації інших забруднювачів теж підскочили, оскільки енергія, що генерується двигуном автомобіля, втягує в реакцію і інші компоненти повітря. Азот реагує з киснем, виходить суміш оксидів азоту, від яких утворюється зміг і відбуваються всякі легеневі захворювання. Приблизно половина всіх азотнокислим викидів - через автотранспорту.
Скорочення вихлопу стало у виробників автомобілів пріоритетом, їм доводиться підкорятися все більш суворим нормативам. Промисловці обмірковують можливості електричних і гібридних машин, але рішення як і раніше потрібні і для звичайного бензинового (і дизельного) автотранспорту. Три мільярди барелів бензину, які спалюють щороку в одних тільки США. вистачить, щоб заповнити двісті тисяч олімпійських басейнів. На кожного американця припадає по 3,8 літра бензину в день. Каталізатори для конвертерів, пастки для оксидів азоту та іншого вихлопу - найактивніші області хімічних досліджень.
З розвитком хімії стало можливо проводити більш ефективні палива, що. в свою чергу, дозволило провідним автомобіль подорожувати далі і дешевше. Нині хімії доводиться мати справу з наслідками: атмосфера задихається від вихлопних газів, а ресурси, завдяки яким ми катаємося туди і сюди щодня, виснажуються.
Октанове число. Октанове число бензинової суміші або окремого компонента бензину - міра ефективності горіння. Октанове число вимірюється в порівнянні з 2.2.4-трима-тілпентаіом (його по-старому називають ізооктаном.), Октанове число якого прирівнюють до 100. і з гептаном, у якого октанове число - нуль. Компоненти бензину з низьким октановим числом зазвичай і «стукають» в двигуні - детонують.
Синтетичне паливо. Синтез Фішера-Тропша - процес отримання синтетичного палива шляхом декількох хімічних реакцій за участю водню і оксиду вуглецю. Два ці газу (разом іменовані «синтез-газ») зазвичай виходять з кам'яного вугілля. Методом Фішера-Тропша можна виробляти, минаючи нафту, рідке паливо. яке ми прівьнно мислимо як продукт нафтопереробки (див. с. 156). Компанія Сасол в Південній Африці виробляє «синтез-паливо« вже не перше десятиліття.
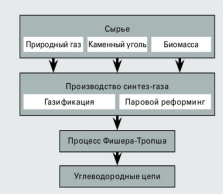
Авіаційне паливо.Гас (Керосин)
Гас - масляниста рідина, яка застосовувалася в давні часи в освітлювальних лампах. У деяких місцях планети гас і раніше використовують для освітлення і обігріву, але найцінніше його застосування в наші дні - авіаційне паливо. Складові гасу - молекули вуглеводнів з 12-16 атомами вуглецю, тому гас важче бензину, менш летючий і не так легко запалюється, і тому його безпечніше палити в будинках. Це не одне окреме речовина, а суміш різних лінійних і циклічних вуглеводневих сполук, киплячих при більш-менш однієї і тієї ж температурі. Гас відокремлюють від сирої нафти перегонкою і крекингом - як і бензин, але бензинові фракції киплять і конденсуються при температурах нижче.
У 2014 році хіміки оголосили, що створили авіапаливо - гас - з вуглекислого газу і води, застосувавши активний вплив сонячного світла. Світло нагрів діоксид вуглецю і воду, вийшов синтез-газ (суміш водню і оксиду вуглецю), який далі перетворили в паливо добре відомим методом - процесом Фі-шера-Тропша.
Вазелін.Кожен з нас з дитинства звик до мазі, що носить назву «вазелін». А хтось замислювався, що це таке? У вже далекому 1859 році спостерігається початок нафтового буму. І майже випадково англійський хімік, емігрант із США, Роберт Чезбро, зауважив липкий продукт, який чомусь прилипав до бурильних установок, і навіть забивав наноси. Маса була якоюсь парафінообразной. Здавалося б, нічого незвичайного. Але вчений помітив інтерес робітників до цієї речовини - вони активно використовували речовина при опіках, що, как не странно, сприяло загоєнню ран. Як виявилося, уважність хіміка привела до появи мазі, яка активно використовується до сьогоднішнього дня. Вчений вирішив провести експерименти, намагаючись вивчити наявні властивості речовини, і посилити їх позитивний ефект.
При виникненні у самого вченого опіків, він змастив їх отриманої маззю, і отримав прямо приголомшливий успіх - рани змогли зажити, причому досить швидко. Ця мазь сприяла регенерації покривів шкіри, і вчений вирішив запустити засіб в промислове виробництво. Так з 1870 року в аптечну продаж надійшло «Нафтове желе». Але популярністю мазь не користувалася. Як виявилося, відбувалося це через невдалий назви. Все, що пов'язано з нафтою, обивателі вважали легкозаймистою. Тоді винахідник вирішив змінити назву. Мазь стала називатися вазеліном. Воно акумулювало два слова, німецьке слово вода «wasser» і грецьке «elaion» - оливкова олія. Продаж пішла жвавіше. У 1878 році Чезбро отримав патент на назву «вазелін».
Почався тріумфальний хід вазеліну по світу. Він виявився незамінним і при запаленнях, і при опіках, і при лікуванні саден. Судіть самі: вазелін використовували актори для нанесення сліз; художники мазали його на підлогу для захисту від попадання фарби; рибалки використовували для залучення риб (наносили вазелін на гачки); бейсболісти пом'якшували вазеліном рукавички; плавці наносили його на тіло ... Вазелін і сьогодні похідне від нафти - суміш мінерального масла з важкими вуглецями. Він безбарвний, не має ні запаху, ні смаку, не розчиняється у воді. Цікаво, саме завдяки своєму засобу, Чезбро прожив 96 років? А чим ми з вами гірше?
Коктейль Молотова
Коктейль Молотова - це загальна назва, під яким ховається ціла група запальних рідин на основі бензину. Для збільшення температури і тривалості горіння "Коктейлів" до бензину додають інші, більш важкі фракції нафти. У класичному "Коктейлі Молотова" міститься т.зв. рідина КС, що складається з бензину, лигроина, масла і білого фосфору з сіркою.
Склади для коктейлю Молотова і їх пропорції
Склад №1. Бензин + Скипидар = 1: 1. Даная суміш добре зігрітися і довго горить жарким полум'ям.
Склад №2. Бензин + Гас + Скипидар = 2: 1: 1. Приблизно такий же склад, як і попередній, горить з більш високою температурою.
Склад №3. Масло + Бензин + Скипидар = 1: 4: 1. Склад швидко розтікається і добре всмоктується в будь-які матеріали. Масло можна взяти звичайну соняшникову або відпрацювання.
Склад №4. Бензин + Скипидар + Гудрон (або мазут) = 5: 3: 1. Один з кращих складів, горить з дуже високою температурою, відмінно все підпалює.
Фінський «коктейль Молотова» розробив (під назвою polttopullo - «запальна пляшка») капітан Куіттінен з гарнізону Коріа навесні 1939 року. Перший випробуваний зразок був звичайною скляною пляшкою, наповненою бензином, з прикрученим до неї шматком тканини. В ході польових випробувань проте були виявлені такі недоліки:
· Рідина не прилипала до мети і стікала з неї занадто швидко;
· Палаюча тканину робила кидав легко помітним, що на практиці (при використанні проти танків в ближньому бою) було неприйнятно.
Додавання гудрону до суміші (близько 10-20 мілілітрів на 0,5 літрову пляшку) не тільки вирішило першу проблему, а й дозволило створити більше диму при загорянні. Суміш також горіла довше і при більш високій температурі.
Яку суміш використовували в коктейлі Молотова?
Найпоширеніші рецептури:
1. Рецепт Че-Гевари: ¾ бензину і ¼ масла.
2. Рецепт ВАЗівської: 2/4 бензину, ¼ масла, ¼ етилового спирту.
3. Фінський рецепт: бензин з додаванням 10-20 мл. гудрону.
4. Турецький рецепт: бензин - 70%, масло - 20%, парафін - 10%.
5. Найчастіше в другій половині 20-го століття використовувався просто бензин.
Чи залишаться пластик і нейлон, коли нафта закінчиться?
Значна частина світу навколо нас зроблена з нафти і газу. Ми живемо в будинках з пластиковими вікнами і вініловими шпалерами, на підлозі у нас лінолеум або покритий полімером ламінат. Ми їздимо в автомобілях, де весь інтер'єр виконаний з пластмаси, а шини - з синтетичного каучуку. Ми миємося і чистимо зуби лауретсульфат, одягаємося в нейлон і поліуретан. Продукти нафтохімії надають аромат нашій їжі, яку продають в пластиковій тарі. Але що буде, коли нафта і газ закінчаться або хоча б просто сильно подорожчають? Виявляється, нічого страшного. Ми не залишимося без шампунів і ароматних жувальних гумок. Нафтохімія може існувати і без нафти. Головне - мати джерело вуглецю. Ще в 1920-і роки в Товаристві кайзера Вільгельма (тодішньому німецькому аналогу Академії наук) був винайдений спосіб синтезу рідких вуглеводнів з синтез-газу, суміші чадного газу і водню. Цей синтез отримав назву процес Фішера-Тропша, на його основі в другій половині 20-го століття випускали синтетичне моторне паливо і мастила. nCO + (2n +1) H 2 -> CnH2n + 2 + nH2O nCO + 2nH2 -> CnH2n + nH2O Пізніше став використовуватися синтез олефінів через послідовне отримання з синтез-газу метанолу та диметилового ефіру. Сировиною для синтез газу, а, отже, і для всіх продуктів нафтохімії при цьому може бути практично все, що містить вуглець: вугілля, деревина, вуглекислий газ. У Китаї, де мало нафти, але багато вугілля, вже запущено кілька заводів з його переробки в олефіни, в тому числі в найважливіші мономери: етилен і пропілен.
Полімерний століття: Чому пластика так багато Люди користуються полімерами з кам'яного століття: з білків складаються шерсть і шкіра, основним компонентом тканин, папірусу і паперу є целюлоза. Такі полімери, потрапивши в навколишнє середовище, досить швидко розкладаються. На початку XX століття людство освоїло виробництво синтетичних полімерів. Вироби з них виявилися легкими і міцними, але ... Прихід полімерного століття затьмарила нездатність природи швидко руйнувати такі сполуки. В результаті «рукотворні» полімери накопичуються в гігантських кількостях на звалищах, а вчені шукають способи врятувати Землю від згубного пластика. Ланцюгові молекули Полімери, незважаючи на малу питому вагу, мають великий молекулярної масою. У цих з'єднаннях періодично повторюються певні елементи - структурні ланки. Насправді полімери старі як життя. У число обов'язкових компонентів живих систем входять білки, нуклеїнові кислоти і полісахариди. Ці полімери називаються природними. Ті ж, що з'явилися завдяки людині, - штучними і синтетичними. Найбільш поширені синтетичні полімери Штучні полімери утворюються в результаті хімічної модифікації природних. Перший штучний полімер - нитроцеллюлоза - була отримана в 1829 році швейцарським хіміком Крістіаном Фрідріхом Шенбейн. Спочатку нитроцеллюлозу застосовували для заміни виробів зі слонової кістки (наприклад, більярдних куль) і виробництва фото- і кіноплівки. Зараз з неї роблять в основному бездимний порох. Синтетичними називаються полімери, які отримують полімеризацією або поліконденсацією низькомолекулярних сполук (найчастіше продуктів нафтопереробки). Саме їх ми в побуті зазвичай і називаємо «пластиком». У найбільших масштабах виробляються п'ять синтетичних полімерів: поліетилен, поліпропілен, полістирол, поліхлорвініл і поліетилентерефталат. Епоха синтетики Взагалі-то, першим штучним полімером можна вважати дубленої шкіру. При її виробленні речовини з дубильного розчину реагують з білками шкіри - в результаті зшиваються білкові молекули, це збільшує міцність шкіри. Технологія виникла ще в кам'яному столітті. Спосіб виробництва першого синтетичного полімеру був запатентований в 1909 році. Затвердевающую при нагріванні фенолформальдегідні смоли назвали бакелит в честь винахідника - бельгійського хіміка Лео Бакеланда. І все ж вважається, що ера промислового виробництва синтетичних полімерів почалася в 1950 е, коли Карл Циглер і Джуліо Натта розробили каталізатори, що дозволяють отримувати поліетилен і поліпропілен без високих тиску і температури. Завдяки катализаторам Циглера - Натта хімічна промисловість швидко освоїла виробництво конструкційних і пакувальних матеріалів. Спосіб отримання першого синтетичного полімеру - бакеліта. З нього серед іншого виготовляють кулі для боулінгу. Але не минуло й десяти років, як екологи почали бити на сполох. Уже в 1960 е було очевидно, що зростання обсягів виробництва одноразових пакетів і упаковки харчових продуктів являє собою загрозу для навколишнього середовища. Відслужив своє пластик став засмічувати вулиці міст, приміські зони і навіть моря. Побоювання підтвердилися. Якщо в 1950 е вироблялося не більше 2 млн тонн пластмас в рік, то в 2015 м їх випуск зріс до 400 млн тонн. Не менш 4 млрд тонн було відвантажено з заводів за останні 13 років. Простота і великі обсяги виробництва призвели до того, що пластикові вироби дійсно стали одноразовими: лише 9% всіх вироблених синтетичних полімерів було перероблено вдруге, ще 12% - спалено в топках сміттєспалювальних заводів і теплових електростанцій. Нескладно підрахувати, що 79% пластика виявилося на сміттєвих полігонах, звалищах і просто в навколишньому середовищі. Тільки в Світовий океан щорічно потрапляє більше 8 млн тонн синтетичних полімерів. Морські й океанічні течії збирають їх в «сміттєві острови», які згодом ризикують перетворитися в «сміттєві континенти». До 2050 року сумарна маса полімерних відходів складе вже 12 млрд тонн.
Спалах горючих рідин
Спалах – це запалення суміші парів горючої рідини і повітря при піднесенні полум'я. При спалаху горіння не буває повним, і полум'я не має високої температури і не запалює саму випаровується рідина. Коли загоряється остання, то явище відповідає поняттю «займання». Температура спалаху має велике значення в техніці безпеки і стоїть в прямому зв'язку з пружністю пара, тобто здатністю речовини випаровуватися в більшій чи меншій мірі.
Чим нижче температура кипіння речовини, тим нижче лежить його температура спалаху: у бензину, наприклад, нижче 0° С. Не існує певної різниці температур між спалахом і займанням, хоча ця різниця тим менше, ніж однорідні речовина. Тому у гасу і мастильних масел інтервал між цими двома величинами може досягати 5-20 ° С і вище. У тих випадках, коли горючий продукт піддається нагріванню, наприклад, гас в лампових резервуарах в жарких приміщеннях, вогненебезпечність буде тим вище, чим нижче температура спалаху.
Законодавчі установи деяких країн обумовлюють найбільш низький температурний межа спалаху гасу, щоб усунути введення в гас фракції бензину. У нас встановлена межа в 28° С, але фактично спалах завжди лежить вище, так як комерційно невигідно при справжніх цінах на бензин вводити його в гас.
Спалах залежить і від тривалості зіткнення горючої речовини. Так, наприклад, палаюча цигарка гасне при опусканні в ефір, не запалюючи останнього. В кінцевому рахунку температура спалаху безпосередньо залежить від пружності пари речовини, а тому і від барометричного тиску. Чим воно вище, тим вище спалах, а тому при визначенні такого роду треба вводити поправки на тиск атмосфери.
Визначення технічного характеру виробляються і спеціальних приладах, наприклад, прилади для гасу Абель-Пенського (для температур до 50 ° С), для олій Мартенс-Пенського (для температур до 200 ° С). Крім того, є прилади Бренко і Маркуссона. У двох останніх визначається також і температура займання.
Всі ці прилади являють собою металеву (у Бренко порцелянову) чашечку, в яку наливається певну кількість випробуваного продукту і опущений термометр. Повільно підвищуючи температуру нагріванням чашечки, через кожні 2-3° С підносять до поверхні рідини маленьке полум'я, спостерігаючи температуру, при якій відбувається спалах або потім займання.
Щоб отримати більш точні цифри, досвід повторюють кілька разів, беручи кожен раз нову порцію рідини. Піднесення полум'я і сама його величина повинні бути у всіх дослідах тотожні. Для цієї мети в деяких апаратах (Абель-Пенського і Мартенса) є механічні пристосування.
Різні мінеральні масла мають спалах від 150 ° С до 320 ° С. Для мастил температура спалаху є не стільки критерієм їх безпеки, скільки ознакою відсутності легко летючих частин, видалення яких в процесі роботи масла могло б занадто підвищити їх в'язкість.
Звідки взявся уран? Швидше за все, він з'являється при вибухах наднових. Справа в тому, що для нуклеосинтеза елементів важче заліза повинен існувати потужний потік нейтронів, який виникає як раз під час вибуху наднової. Здавалося б, потім, при конденсації з утвореного нею хмари нових зоряних систем, уран, зібравшись в протопланетному хмарі і будучи дуже важким, повинен тонути в глибинах планет. але це не так. уран - радіоактивний елемент, і при розпаді він виділяє тепло. Розрахунок показує, що якби уран був рівномірно розподілений по всій товщі планети хоча б з тієї ж концентрацією, що і на поверхні, то він виділяв би занадто багато тепла. Більш того, його потік у міру витрачання урану повинен слабшати. Оскільки нічого подібного не спостерігається, геологи вважають, що не менше третини урану, а може бути, і весь він зосереджений в земній корі, де його зміст становить 2,5 ∙ 10 -4 %. Чому так вийшло, що не обговорюється.
Де добувають уран? Урану на Землі не так уже й мало - за поширеністю він на 38-му місці. А найбільше цього елемента в осадових породах - вуглистих сланцях і фосфоритах: до 8 ∙ 10 -3 і 2,5 ∙ 10 -2 % Відповідно. Всього в земній корі міститься 10 14 тонн урану, але головна проблема в тому, що він дуже неуважний і не утворює потужних родовищ. Промислове значення мають приблизно 15 мінералів урану. Це уранова смілка - її основою служить оксид чотирьохвалентного урану, уранова слюдка - різні силікати, фосфати і більш складні з'єднання з ванадієм або титаном на основі шестивалентного урану.
Що таке промені Беккереля? Після відкриття Вольфгангом Рентгеном Х-променів французький фізик Антуан-Анрі Беккерель зацікавився світінням солей урану, яке виникає під дією сонячного світла. Він хотів зрозуміти, чи немає і тут Х-променів. Дійсно, вони були присутні - сіль засвічувала фотопластинку крізь чорну папір. В одному з дослідів, проте, сіль не стали висвітлювати, а фотопластинка все одно потемніла. Коли ж між сіллю і фотопластинкою поклали металевий предмет, то під ним потемніння було менше. Стало бути, нові промені виникали аж ніяк не через порушення урану світлом і через метал частково не проходили. Їх і назвали спочатку «променями Беккереля». Згодом було виявлено, що це головним чином альфа-промені з невеликою добавкою бета-променів: справа в тому, що основні ізотопи урану при розпаді викидають альфа-частинку, а дочірні продукти відчувають і бета-розпад.
Наскільки велика радіоактивність урану? У урану немає стабільних ізотопів, всі вони радіоактивні. самий долгоживущий - уран-238 з періодом напіврозпаду 4,4 млрд років. Наступним йде уран-235 - 0,7 млрд років. Обидва вони зазнають альфа-розпад і стають відповідними ізотопами торію. Уран-238 становить понад 99% всього природного урану. З-за його величезного періоду напіврозпаду радіоактивність цього елемента мала, а крім того, альфа-частки не здатні подолати ороговілий шар шкіри на поверхні людського тіла. Розповідають, що І. В. Курчатов після роботи з ураном просто витирав руки носовою хусткою і ніякими хворобами, пов'язаними з радіоактивністю, що не страждав.
дослідники не раз зверталися до статистики захворювань робітників уранових копалень і обробних комбінатів. Ось, наприклад, недавня стаття канадських і американських фахівців, які проаналізували дані про здоров'я більше 17 тисяч робочих копальні Ельдорадо в канадській провінції Саскачеван за 1950-1999 роки (Environmental Research, 2014 року, 130, 43-50, DOI: 10.1016 / j.envres.2014.01.002 ). Вони виходили з того, що найсильніше радіація діє на швидко розмножуються клітини крові, приводячи до відповідних видів раку. Статистика ж показала, що у робочих копальні захворюваність різними видами раку крові менше, ніж в середньому у канадців. При цьому основним джерелом радіації вважається не сам по собі уран, а породжуваний їм газоподібний радон і продукти його розпаду, які можуть потрапити в організм через легені.
Чим же шкідливий уран? Він, подібно до інших важких металів, дуже отруйний, може викликати ниркову і печінкову недостатність. З іншого боку, уран, будучи неуважним елементом, неминуче присутній в воді, ґрунті та, концентруючись в харчовому ланцюжку, потрапляє в організм людини. Розумно припустити, що в процесі еволюції живі істоти навчилися знешкоджувати уран в природних концентраціях. Найбільш небезпечний уран в воді, тому ВООЗ встановила обмеження: спочатку воно становило 15 мкг / л, але в 2011 році норматив збільшили до 30 мк / г. Як правило, урану у воді набагато менше: в США в середньому 6,7 мкг / л, в Китаї і Франції - 2,2 мкг / л. але бувають і сильні відхилення. Так в окремих районах Каліфорнії його в сто разів більше, ніж за нормативом, - 2,5 мг / л, а в Південній Фінляндії доходить і до 7,8 мг / л. Дослідники ж намагаються зрозуміти, чи не занадто суворий норматив ВООЗ, вивчаючи дію урану на тварин. Ось типова робота (BioMed Research International, 2014 року, ID 181989; DOI: 10.1155 / 2014/181989 ). Французькі вчені дев'ять місяців поїли щурів водою з добавками збідненого урану, причому у відносно великій концентрації - від 0,2 до 120 мг / л. нижнє значення - це вода поблизу шахти, верхнє ж ніде не зустрічається - максимальна концентрація урану, виміряна в тій же Фінляндії, становить 20 мг / л. До подив авторів - стаття так і називається: «Несподіване відсутність помітного впливу урану на фізіологічні системи ...», - уран на здоров'я щурів практично не позначився. Тварини прекрасно харчувалися, додавали у вазі як слід, на хвороби не скаржилися і від раку не вмирали. Уран, як йому і належить, відкладався насамперед в нирках і кістках і в стократно меншій кількості - в печінки, причому його накопичення очікувано залежало від вмісту у воді. Однак ні до ниркової недостатності, ні навіть до помітного появи будь-яких молекулярних маркерів запалення це не приводило. Автори запропонували почати перегляд строгих нормативів ВООЗ. Однак є один нюанс: вплив на мозок. В мізках щурів урану було менше, ніж в печінці, але його зміст не залежало від кількості у воді. А ось на роботі антиоксидантної системи мозку уран позначився: на 20% зросла активність каталази, на 68-90% - глютатіонпероксидази, активність же суперкоксіддісмутази впала незалежно від дози на 50%. Це означає, що уран явно викликав окислювальний стрес в мозку і організм на нього реагував. такий ефект - сильну дію урану на мозок при відсутності його накопичення в ньому, до речі, так само як і в статевих органах, - помічали і раніше. Більш того, вода з ураном в концентрації 75-150 мг / л, якій дослідники з університету Небраски поїли щурів півроку (Neurotoxicology and Teratology, 2005, 27, 1, 135-144; DOI: 10.1016 / j.ntt.2004.09.001 ), сказалаcь на поведінку тварин, головним чином самців, випущених в поле: вони не так, як контрольні, перетинали лінії, підводилися на задні лапи і чистили шерсть. Є дані, що уран призводить і до порушень пам'яті у тварин. Зміна поведінки корелювало з рівнем окислення ліпідів в мозку. Виходить, що пацюки від уранової водички робилися здоровими, але дурнуватими. Ці дані нам ще знадобляться при аналізі так званого синдрому Перської затоки (Gulf War Syndrome).
Забруднює уран місця розробки сланцевого газу? Це залежить від того, скільки урану в містять газ породах і як він з ними пов'язаний. Наприклад, доцент Трейсі Бенк з Університету Буффало досліджувала сланцеві породи родовища Марцелус, що простягнувся із заходу штату Нью-Йорк через Пенсільванію і Огайо до Західної Віргінії. Виявилося, що уран хімічно пов'язаний саме з джерелом вуглеводнів (згадаємо, що в родинних вуглистих сланцях найвищий вміст урану).Досліди ж показали, що використовується при розриві пласта розчин прекрасно розчиняє в собі уран. «Коли уран в складі цих вод виявиться на поверхні, він може призвести до забруднення околиць. Радіаційного ризику це не несе, але уран - отруйний елемент », - зазначає Трейсі Бенк в прес-релізі університету від 25 жовтня 2010 року. Докладних статей про ризик забруднення навколишнього середовища ураном або торієм при видобутку сланцевого газу поки не підготовлено.
Навіщо потрібен уран? Раніше його застосовували як пігмент для виготовлення кераміки і кольорового скла. Тепер же уран - основа атомної енергетики і атомної зброї. При цьому використовується його унікальну властивість - здатність ядра ділитися.
Що таке розподіл ядра? Розпад ядра на два нерівних великі шматки. Саме через це властивості при нуклеосинтезі за рахунок нейтронного опромінення ядра важче урану утворюються з великими труднощами. Суть явища полягає в наступному. Якщо співвідношення числа нейтронів і протонів в ядрі НЕ оптимально, воно стає нестабільним. Зазвичай таке ядро викидає з себе або альфа-частинку - два протони і два нейтрони, або бета-частинку - позитрон, що супроводжується перетворенням одного з нейтронів в протон. В першому випадку виходить елемент таблиці Менделєєва, віддалений на дві клітини назад, у другому - на одну клітку вперед. Однак ядро урану крім випромінювання альфа- і бета-частинок здатне ділитися - розпадатися на ядра двох елементів середини таблиці Менделєєва, наприклад барію і криптону, що і робить, отримавши новий нейтрон. Це явище виявили незабаром після відкриття радіоактивності, коли фізики піддавали нововідкритому випромінювання все, що доведеться. Ось як пише про цьому учасник подій Отто Фріш ( «Успіхи фізичних наук», 1968, 96, 4). Після відкриття берилієвих променів - нейтронів - Енріко Фермі опромінював ними, в Зокрема, уран, щоб викликати бета-розпад, - він сподівався за його рахунок отримати наступний, 93-й елемент, нині названий нептунієм. Саме він і виявив у опроміненого урану новий тип радіоактивності, який пов'язав з появою трансуранових елементів. При цьому уповільнення нейтронів, для чого берилієвий джерело покривали шаром парафіну, збільшувало таку наведену радіоактивність. Американський радіохімік Арістід фон Гроссе припустив, що одним з цих елементів був протактиний, але помилився. Зате Отто Ган, який працював тоді в Віденському університеті і вважав відкритий в 1917 році протактиний своїм дітищем, вирішив, що зобов'язаний дізнатися, які елементи при цьому виходять.Разом з Лізою Мейтнер в початку 1938 року Ган припустив на підставі результатів дослідів, що утворюються цілі ланцюжки з радіоактивних елементів, що виникають через багаторазових бета-розпадів поглотивших нейтрон ядер урану-238 і його дочірніх елементів. Незабаром Ліза Мейтнер була змушена тікати до Швеції, побоюючись можливих репресій з боку фашистів після аншлюсу Австрії. Ган ж, продовживши досліди з Фріцем Штрассманом, виявив, що серед продуктів був ще і барій, елемент з номером 56, який жодним чином з урану вийти не міг: все ланцюжка альфа-розпадів урану закінчуються набагато важчим свинцем. Дослідники були настільки здивовані отриманим результатом, що публікувати його НЕ стали, тільки писали листи друзям, в Зокрема Лізі Майтнер в Гетеборг. Там на Різдво тисяча дев'ятсот тридцять вісім року її відвідав племінник, Отто Фріш, і, гуляючи в околицях зимового міста - він на лижах, тітка пішки, - вони обговорили можливості появи барію при опроміненні урану внаслідок поділу ядра (докладніше про Лізу Мейтнер см. «Хімію і життя», 2013, №4 ). Повернувшись в Копенгаген, Фріш буквально на трапі пароплава, який відбуває в США, зловив Нільса Бора і повідомив йому про ідею поділу. Бор, ляснувши себе по лобі, сказав: «О, які ми були дурні! Ми повинні були помітити це раніше ». В січні 1939 року вийшла стаття Фріша і Майтнер про розподіл ядер урану під дією нейтронів. До той час Отто Фріш вже поставив контрольний досвід, так само як і багато американських групи, які отримали повідомлення від Бора. Розповідають, що фізики стали розходитися по своїх лабораторіях прямо під час його доповіді 26 січня 1939 року в Вашингтоні на щорічній конференції з теоретичної фізики, коли вхопили суть ідеї. Після відкриття ділення Ган і Штрассман переглянули свої досліди і знайшли, так само, як і їх колеги, що радіоактивність опроміненого урану пов'язана не з трансуранов, а з розпадом утворилися при розподілі радіоактивних елементів з середини таблиці Менделєєва.
Як проходить ланцюгова реакція в урані? Незабаром після того, як була експериментально доведена можливість поділу ядер урану і торію (а інших елементів, що діляться на Землі в скільки-небудь значній кількості немає), що працювали в Прінстоні Нільс Бор і Джон Уїллер, а також незалежно від них радянський фізик-теоретик Я. І. Френкель і німці Зігфрід Флюгге і Готфрід фон Дросте створили теорію поділу ядра. З неї слідували два механізми. Один - пов'язаний з пороговим поглинанням швидких нейтронів. Згідно з ним, для ініціації поділу нейтрон повинен володіти досить великою енергією, більше 1 МеВ для ядер основних ізотопів - урану-238 і торію-232. При меншій енергії поглинання нейтрона ураном-238 має резонансний характер. Так, нейтрон з енергією 25 еВ має в тисячі разів більшу площу перетину захоплення, ніж з іншими енергіями. При цьому ніякого розподілу не буде: уран-238 стане ураном-239, який з періодом напіврозпаду 23,54 хвилини перетвориться в нептуній-239, той, з періодом напіврозпаду 2,33 дня, - в долгоживущий плутоній-239. Торій-232 стане ураном-233.
Завантаження ТВЕЛу в реактор на четвертому блоці Калінінської АЕС. Фото: ВАТ Росатом, www.rosatom.ru
другий механізм - безпорогове поглинання нейтрона, йому слід третій більш-менш поширений ділиться ізотоп - уран-235 (а одно і відсутні в природі плутоній-239 і уран-233): поглинувши будь нейтрон, навіть повільний, так званий теплової, з енергією як у молекул, що беруть участь в тепловому русі, - 0,025 еВ, таке ядро розділиться. І це дуже добре: у теплових нейтронів площа перетину захоплення в чотири рази вище, ніж у швидких, мегаелектронвольтних. В цьому значимість урану-235 для всієї подальшої історії атомної енергетики: саме він забезпечує розмноження нейтронів в природному урані. Після потрапляння нейтрона ядро урану-235 стає нестабільним і швидко ділиться на дві нерівні частини.Попутно вилітає кілька (в середньому 2,75) нових нейтронів. Якщо вони потраплять в ядра того ж урану, то викличуть розмноження нейтронів в геометричній прогресії - піде ланцюгова реакція, що призведе до вибуху через швидке виділення великої кількості тепла. Ні уран-238, ні торій-232 так працювати не можуть: адже при розподілі вилітають нейтрони з середньою енергією 1-3 МеВ, тобто при наявності енергетичного порога в 1 МеВ значна частина нейтронів свідомо не зможе викликати реакцію, і розмноження НЕ буде. А значить, про ці ізотопи слід забути і доведеться сповільнювати нейтрони до теплової енергії, щоб вони максимально ефективно взаємодіяли з ядрами урану-235. При цьому не можна допустити їх резонансного поглинання ураном-238: все-таки в природному урані цей ізотоп становить трохи менше 99,3% і нейтрони частіше стикаються саме з ним, а НЕ з цільовим ураном-235. А діючи сповільнювачем, можна підтримувати розмноження нейтронів на постійному рівні і вибуху не допустити - керувати ланцюговою реакцією.
Розрахунок, проведений Я. Б. Зельдовичем і Ю. Б. Харитоном в Того ж доленосному 1 939 році, показав, що для цього потрібно застосувати сповільнювач нейтронів у вигляді важкої води або графіту і збагатити ураном-235 природний уран щонайменше в 1,83 рази. Тоді ця ідея здалася їм чистою фантазією: «Слід зазначити, що приблизно подвійне збагачення тих досить значних кількостей урану, які необхідні для здійснення ланцюгового вибуху, <...> є надзвичайно громіздку, близьку до практичної нездійсненності завдання». Зараз ця задача вирішена, і атомна промисловість серійно випускає для електростанцій уран, збагачений ураном-235 до 3,5%.
Що таке спонтанне ділення ядер? У 1940 році Г. Н. Флерів і К. А. Петржак виявили, що розподіл урану може відбуватися спонтанно, без будь-якого зовнішнього впливу, правда період напіврозпаду набагато більше, ніж при звичайному альфа-розпаді. Оскільки при такому розподілі теж виходять нейтрони, якщо не дати їм полетіти із зони реакції, вони-то і послужать ініціаторами ланцюгової реакції. Саме це явище використовують при створенні атомних реакторів.
Навіщо потрібна атомна енергетика? Зельдович і Харитон були в числі перших, хто порахував економічний ефект атомної енергетики ( «Успіхи фізичних наук», 1940, 23, 4). «... В Зараз ще не можна зробити остаточних висновків про можливість або неможливість здійснення в урані ядерної реакції поділу з нескінченно розгалужуються ланцюгами. Якщо така реакція може стати реальністю, то автоматично здійснюється регулювання швидкості реакції, що забезпечує спокійне її протікання, незважаючи на величезну кількість доступної експериментатора енергії. Ця обставина виключно сприятливо для енергетичного використання реакції. Наведемо тому - хоча це і є поділом шкури невбитого ведмедя - деякі числа, що характеризують можливості енергетичного використання урану. Якщо процес ділення йде на швидких нейтронах, отже, реакція захоплює основний ізотоп урану (U238), то <виходячи зі співвідношення теплотворних здібностей і цін на вугілля і уран> вартість калорії з основного ізотопу урану виявляється приблизно в 4000 разів дешевше, ніж з вугілля ( якщо, звичайно, процеси "спалювання" і теплос'ема НЕ виявляться в разі урану значно дорожче, ніж в разі вугілля). У разі повільних нейтронів вартість "уранової" калорії (якщо виходити з вищенаведених цифр) буде, беручи до уваги, що поширеність ізотопу U235 дорівнює 0,007, вже лише в 30 раз дешевше "вугільної" калорії при інших рівних умовах ».
Першу керовану ланцюгову реакцію провів в 1942 році Енріко Фермі в Чиказькому університеті, причому управляли реактором вручну - задовго і висуваючи графітові стрижні при зміні потоку нейтронів. Перша електростанція була побудована в Обнінську в 1954 році. Крім вироблення енергії перші реактори працювали ще й на виробництво збройового плутонію.
Як функціонує атомна станція? Зараз більшість реакторів працюють на повільних нейтронах. Збагачений уран у вигляді металу, сплаву, наприклад з алюмінієм, або в вигляді оксиду складають в довгі циліндри - тепловиділяючі елементи. Їх певним чином встановлюють в реакторі, а між ними вводять стержні з сповільнювач, які і керують ланцюговою реакцією. З часом в тепловиділяючі елементи накопичуються реакторні отрути - продукти поділу урану, також здатні поглинати нейтронів. Коли концентрація урану-235 падає нижче критичної, елемент виводять з експлуатації. Однак в ньому багато уламків поділу з сильною радіоактивністю, яка зменшується з роками, чому елементи ще довго виділяють значну кількість тепла. Їх витримують у охолоджуючих басейнах, а потім або ховають, або намагаються переробити - витягти незгорілий уран-235, напрацьований плутоній (він йшов на виготовлення атомних бомб) і інші ізотопи, яким можна знайти застосування. Невикористану частину відправляють в могильники.
Корпус авіаційної атомної бомби з Музею ядерної зброї Російський федеральний ядерний центр у Сарові. Фото: ВАТ Росатом, www.rosatom.ru
У так званих реакторах на швидких нейтронах, або реакторах, навколо елементів встановлюють відбивачі з урану-238 або торію-232. Вони сповільнюють і відправляють назад в зону реакції занадто швидкі нейтрони. Уповільнені ж до резонансних швидкостей нейтрони поглинають названі ізотопи, перетворюючись відповідно в плутоній-239 або уран-233, які можуть використовуватися як для атомної станції. Так як швидкі нейтрони погано реагують з ураном-235, потрібно значно збільшувати його концентрацію, але це виправдовується більш сильним потоком нейтронів. Незважаючи на те що реактори-розмножувачі вважаються майбутнім атомної енергетики, оскільки дають більше ядерного палива, ніж витрачають, - досліди показали: управляти ними важко. Зараз в світі залишився лише один такий реактор - на четвертому енергоблоці Белоярской АЕС.
Як критикують атомну енергетику? Якщо не говорити про аварії, то основним пунктом в міркуваннях противників атомної енергетики сьогодні стала пропозиція додати до розрахунку її ефективності витрати по захисту навколишнього середовища після виведення станції з експлуатації та при роботі з паливом. В обох випадках виникають завдання надійного захоронення радіоактивних відходів, а це витрати, які несе держава. Є думка, що якщо перекласти їх на собівартість енергії, то її економічна привабливість пропаде.
Існує опозиція і серед прихильників атомної енергетики. Її представники вказують на унікальність урану-235, заміни якому немає, тому що альтернативні діляться тепловими нейтронами ізотопи - плутоній-239 і уран-233 - через періоду напіврозпаду в тисячі років в природі відсутні. А отримують їх як раз внаслідок поділу урану-235. Якщо він закінчиться, зникне прекрасний природний джерело нейтронів для ланцюгової ядерної реакції. В результаті такого марнотратства людство втратить можливість в майбутньому залучити до енергетичний цикл торій-232, запаси якого в кілька разів більше, ніж урану.
Теоретично для отримання потоку швидких нейтронів з мегаелектронвольтнимі енергіями можна використовувати прискорювачі часток. Однак якщо мова йде, наприклад, про міжпланетні польоти на атомному двигуні, то реалізувати схему з громіздким прискорювачем буде дуже непросто. Вичерпання урану-235 ставить хрест на таких проектах.
Що таке збройовий уран? Це високозбагачений уран-235. Його критична маса - вона відповідає розміру шматка речовини, в якому мимоволі йде ланцюгова реакція, - досить мала для того, щоб виготовити боєприпас. Такий уран може служити для виготовлення атомної бомби, а також як детонатор для термоядерної бомби.
Які катастрофи пов'язані із застосуванням урану? Енергія, запасені в ядрах елементів, що діляться, величезна. Вирвавшись з-під контролю через недогляд або внаслідок умислу, ця енергія здатна накоїти чимало лиха. Дві найжахливіші ядерні катастрофи сталися 6 і 8 серпня 1945 року, коли ВПС США скинули атомні бомби на Хіросіму і Нагасакі, в результаті чого загинули і постраждали сотні тисяч мирних жителів. Катастрофи меншого масштабу пов'язані з аваріями на атомних станціях і підприємствах атомного циклу. Перша велика аварія трапилася В1949 році в СРСР на комбінаті «Маяк» під Челябінськом, де напрацьовували плутоній; рідкі радіоактивні відходи потрапили в річку Течу. У вересні 1957- року на ньому ж стався вибух з викидом великої кількості радіоактивної речовини. Через одинадцять днів згорів британський реактор з напрацювання плутонію в Уіндскейлі, хмара з продуктами вибуху розсіялася над Західною Європою. У 1979 році згорів реактор на АЕС Трімейл-Айленд в Пенсільванії. До найбільш масштабних наслідків призвели аварії на Чорнобильській АЕС (1986) і АЕС в Фукусімі (2011), коли впливу радіації зазнали мільйони людей. Перша засмітила великі землі, викинувши в результаті вибуху 8 тонн уранового палива з продуктами розпаду, які поширилися по Європі. Друга забруднила і через три роки після аварії продовжує забруднювати акваторію Тихого океану в районах рибних промислів. Ліквідація наслідків цих аварій обійшлася дуже дорого, і, якби розкласти ці витрати на вартість електроенергії, вона б істотно зросла.
Окреме питання - наслідки для здоров'я людей. Згідно з офіційною статистикою, багатьом людям, які пережили бомбардування або живуть на забрудненій території, опромінення пішло на користь - у перших більш висока тривалість життя, у других менше онкологічних захворювань, а деяке збільшення смертності фахівці пов'язують із соціальним стресом. Кількість же людей, які загинули саме від наслідків аварій або в результаті їх ліквідації, обчислюється сотнями людей. Противники атомних електростанцій вказують, що аварії призвели до кільком мільйонам передчасних смертей на європейському континенті, просто вони непомітні на статистичному тлі.
Висновок земель з людського використання в зонах аварій призводить до цікавого результату: вони стають свого роду заповідниками, де росте біорізноманіття. Правда, окремі тварини страждають від хвороб, пов'язаних з опроміненням. Питання, як швидко вони пристосуються до підвищеного фону, залишається відкритим. Є також думка, що наслідком хронічного опромінення виявляється «відбір на дурня» (див. «Хімію і життя», 2010, №5 ): ще на стадії ембріона виживають більш примітивні організми. В Зокрема, стосовно людям це повинно приводити до зниження розумових здібностей у покоління, що народилося на забруднених територіях незабаром після аварії.
Що таке збіднений уран? Це уран-238, який залишився після виділення з нього урану-235. Обсяги відходу виробництва збройового урану і тепловиділяючих елементів великі - в одних США накопичилося 600 тисяч тонн гексафториду такого урану (про проблеми з ним см. «Хімію і життя», 2008, №5). Вміст урану-235 в ньому - 0,2%. Ці відходи треба або зберігати до кращих часів, коли будуть створені реактори на швидких нейтронах і з'явиться можливість переробки урану-238 в плутоній, або якось використовувати.
Застосування йому знайшли. Уран, як і інші перехідні елементи, використовують в якості каталізатора. Наприклад, автори статті в ACS Nano від 30 червня 2014 року пишуть, що каталізатор з урану або торію з графеном для відновлення кисню і перекису водню «має величезний потенціал для застосування в енергетиці». Оскільки щільність урану висока, він служить в якості баласту для судів і противаг для літаків. Годиться цей метал і для радіаційного захисту в медичних приладах зджерелами випромінювання.
Яка зброя можна робити зі збідненого урану? Кулі і сердечники для бронебійних снарядів. Розрахунок тут такий. Чим важче снаряд, тим вище його кінетична енергія. Але чим більше розмір снаряда, тим менш концентрований його удар. Значить, потрібні важкі метали, що володіють високою щільністю. Кулі роблять зі свинцю (уральські мисливці один час використовували і самородную платину, поки не зрозуміли, що це дорогоцінний метал), сердечники ж снарядів - з вольфрамового сплаву. Захисники природи вказують, що свинець забруднює ґрунт в місцях бойових дій або полювання і краще б замінити його на щось менш шкідливе, наприклад на той же вольфрам. Але вольфрам недешевий, а схожий з ним по щільності уран - ось він, шкідливий відхід. При цьому допустиме забруднення грунту і води ураном приблизно в два рази більше, ніж для свинцю. Так виходить тому, що слабкою радіоактивністю збідненого урану (а вона ще й на 40% менше, ніж у природного) нехтують і враховують дійсно небезпечний хімічний фактор: уран, як ми пам'ятаємо, отруйний. В той же час його щільність в 1,7 рази більше, ніж у свинцю, а значить, розмір уранових куль можна зменшити в два рази; уран набагато більш тугоплавкий і твердий, ніж свинець, - при пострілі він менше випаровується, а при ударі в ціль дає менше мікрочастинок. В загальному, уранова куля менше забруднює навколишнє середовище, ніж свинцева, правда, достовірно про таке використання урану невідомо.
Зате відомо, що пластини зі збідненого урану застосовують для зміцнення броні американських танків (цьому сприяють його високі щільність і температура плавлення), а також замість вольфрамового сплаву в сердечниках для бронебійних снарядів. Урановий сердечник гарний ще й тим, що уран пірофорен: його гарячі дрібні частинки, що утворилися при ударі об броню, спалахують і підпалюють все навколо. Обидва застосування вважаються радіаційно безпечними. Так, розрахунок показав, що, навіть просидівши безвилазно рік в танку з уранової бронею, завантаженому уранових боєкомплектом, екіпаж отримає лише чверть допустимої дози. А щоб отримати річну допустиму дозу, треба на 250 годин прикрутити до поверхні шкіри такий боєприпас.
Снаряди з урановими сердечниками - до 30-мм авіаційним гармат або до артилерійських подкалиберним - застосовували американці в недавніх війнах, почавши з іракської кампанії 1991 року. У той рік вони висипали на іракські бронетанкові частини в Кувейті і при їх відступі 300 тонн збідненого урану, з них 250 тонн, або 780 тисяч пострілів, довелося на авіаційні гармати. У Боснії і Герцеговині при бомбардуваннях армії невизнаної Республіки Сербської було витрачено 2,75 тонни урану, а при обстрілі югославської армії в краї Косово і Метохія - 8,5 тонн, або 31 тисяча пострілів. Оскільки ВООЗ до того часу перейнялася наслідками застосування урану, було проведено моніторинг. Він показав, що один залп складався приблизно з 300 пострілів, з яких 80% містило збіднений уран. В цілі потрапляло 10%, а 82% лягало в межах 100 метрів від них. Решта розсіювалися в межах 1,85 км. Снаряд, що потрапив в танк, згорав і перетворювався в аерозоль, легкі цілі на кшталт бронетранспортерів урановий снаряд порушували наскрізь. Таким чином, в уранову пил в Іраку могло перетворитися від сили півтори тонни снарядів. За оцінками ж фахівців американського стратегічного дослідницького центру «RAND Corporation», в аерозоль перетворилося більше, від 10 до 35% використаного урану. Борець з урановими боєприпасами хорват Асаф Дураковіч, який працював у великій кількості організацій від ер-Ріядського Госпіталю короля Фейсала до вашингтонського Уранового медичного дослідницького центру, вважає, що тільки в Південному Іраку в 1991 року утворилося 3-6 тонн субмікронних частинок урану, які розсіялися по великому району , то є уранове забруднення там можна порівняти з чорнобильським.
Тема 6. Перетворення енергії. Принцип роботи двигуна
Паливо – це кров, яка тече по артеріям;
Це вид матерії, який дає корисну дію у вигляді енергії.
Енергія – це сила, яка засавляє все живе рухатися.
Що являє собою поняття «енергія», яке ми так часто використовуємо? «Енергія» (грец. ενεργια - д ЧИННИМ, діяльність) - загальна кількісна міра різних форм руху матерії. За великим рахунком поняття енергії, ідея енергії штучні і створені спеціально для того, щоб бути результатом наших роздумів про навколишній світ. На відміну від матерії, про яку ми можемо сказати, що вона існує, енергія - це плід думки людини, його «винахід», побудоване так, щоб була можливість описати різні зміни в навколишньому світі і в той же час говорити про сталість, збереженні чого -то, що було названо енергією. Для цієї фізичної величини довгий час вживався термін «жива сила», введений І. Ньютоном. Вперше в історії в поняття «жива сила» сенс «енергія», не промовляючи ще цього слова, вкладає Роберт Майер в статті «Зауваження про сили неживої природи», опублікованій в 1842 році. Спеціальний термін «енергія» був введений в 1807 р англійським фізиком Томасом Юнгом і позначав величину, пропорційну масі і квадрату швидкості тіла, що рухається. У науку термін «енергія» в сучасному його розумінні ввів Вільям Томсон (лорд Кельвін) в 1860 році.
Енергія проявляється в різних формах руху матерії, що заповнює весь світовий простір. Властивістю, властивим всім видам енергії і об'єднуючим їх, є здатність кожного виду енергії переходити за певних умов в будь-який інший її вигляд в строго визначеному кількісному співвідношенні. Сама назва цієї властивості - «закон збереження і перетворення енергії» - було введено в науковий обіг Ф. Енгельсом, що дозволило всі види енергії вимірювати в одних одиницях. В якості такої одиниці прийнятий джоуль (1 Дж = 1 H · м . У той же час для вимірювання кількості теплоти використовують «стару» одиницю - 1 кал (калорія), для вимірювання механічної енергії - величину 1 кгм = 9,8 Дж, електричної енергії - 1 кВт · год = 3,6 МДж, при цьому 1 Дж = 1 Вт · с.
Майже всі види енергії, що розглядаються в технічній термодинаміці, за винятком теплової, являють собою енергію спрямованого руху. Так, механічна енергія проявляється в безпосередньо спостерігається рух тіл, що має певний напрям в просторі (рух газу по трубі, політ снаряда, обертання валу і т. П.). Електрична енергія проявляється в прихованому русі електронів по провіднику (електричний струм). Теплова енергія виражається в молекулярному та внутрішньо-молекулярні хаотичному русі, представляючи собою енергію хаотичного руху атомів і молекул речовини. Теплова енергія газів проявляється в коливальному, обертальному і поступальному русі молекул, які постійно змінюють свою швидкість по величині і напрямку. При цьому кожна молекула може безладно переміщатися по всьому об'єму газу. У твердих тілах теплова енергія проявляється в коливаннях молекул і атомів щодо положень, які визначаються кристалічною структурою речовини, в рідинах - в коливанні і переміщенні молекул або їх комплексів. Отже, корінним відмінністю теплової енергії від інших видів енергії є те, що вона являє собою енергію не направлення, а хаотичного руху. В результаті цього перетворення теплової енергії в будь-який вид енергії спрямованого руху має свої особливості, вивчення яких і є однією з головних задач технічної термодинаміки.
Кожне тіло в будь-якому його стані може володіти одночасно різними видами енергії, в тому числі теплової, механічної, електричної, хімічної, внутрішньоядерній, а також потенційною енергією різних фізичних полів (гравітаційного, магнітного, електричного). Сума всіх видів енергії, якими володіє тіло, являє собою повну його енергію.
Теплова, хімічна і внутрішньоядерна енергії входять до складу внутрішньої енергії тіла. Всі інші види енергії, пов'язані з переміщенням тіла, а також потенційна енергія зовнішніх фізичних полів відносяться до його зовнішньої енергії. Наприклад, зовнішньої енергією летить снаряда в зоні дії сил земного тяжіння буде сума його кінетичної Е до і потенційної енергії гравітаційного поля E п. м. Якщо газ або рідина рухаються безперервним потоком в трубі, то в їх зовнішню енергію додатково входить енергія проштовхування, іноді звана енергією тиску Е пр.
Зовнішня енергія, отже, являє собою суму
Внутрішня енергія тіла U може бути представлена як би складається з двох частин: внутрішньої теплової енергії U Т і U 0 - внутрішньої нульової енергії тіла, умовно охолодженого до абсолютного нуля температури:
Внутрішньої тепловою енергією є та частина повної внутрішньої енергії тіла, яка пов'язана з тепловим хаотичним рухом молекул і атомів і може бути виражена через температуру тіла та інші його параметри. Оскільки температура реального тіла тільки частково відображає його внутрішню теплову енергію, зміна останньої може мати місце і при постійній температурі тіла. Прикладами цього є процеси випаровування, плавлення, сублімації, в яких відбувається фазове перетворення і змінюється ступінь хаотичності молекулярного руху.
Таким чином, повна енергія тіла в загальному випадку може бути представлена у вигляді суми внутрішньої нульовий внутрішньої теплової U Т, зовнішньої кінетичної енергій, сукупних зовнішніх потенційних енергій і енергії проштовхування
Кожна з цих складових повної енергії може при певних умовах перетворюватися одна в іншу. Наприклад, в хімічних реакціях має місце взаємне перетворення. Якщо реакція екзотермічна, то частина нульової енергії перетворюється в теплову. Нульова енергія отриманих речовин виявляється меншою, ніж вихідних, - відбувається «виділення тепла». У ендотермічних реакціях відзначається зворотне явище: нульова енергія збільшується за рахунок зменшення теплової енергії - відбувається «поглинання тепла».
У процесах, які пов'язані зі зміною хімічного складу речовини, нульова енергія не змінюється і залишається постійною. У цих умовах змінюється тільки внутрішня теплова енергія. Це дозволяє в різних розрахункових рівняннях враховувати зміну лише внутрішньої теплової енергії, яку в подальшому будемо називати просто внутрішньою енергією U. Якщо однорідне тіло масою m має внутрішню енергію U, то внутрішня енергія 1 кг цього тіла u = U / m.
величину і називають питомої внутрішньою енергією і вимірюють в Дж / кг.
Зовнішня кінетична енергія (Дж) являє собою енергію поступального руху тіла як цілого і виражається формулою
Зовнішня потенційна енергія як енергія спрямованого дії статичних полів може бути виражена через можливі роботи кожного поля від заданого положення до якихось нульових. Так, потенційна енергія гравітаційного поля виражається як добуток сили тяжіння mg цього тіла на його висоту H над яким-небудь нулем відліку:
E = mgH.
тут висота H являє собою відповідну координату.
Енергія проштовхування Е п р являє собою додаткову енергію речовини, що виникає в системі за рахунок впливу на нього інших частин системи, які прагнуть виштовхнути цю речовину із займаного судини. Так, при перебігу газу (або пара) по трубі або якому-небудь каналу в умовах суцільного потоку кожен кілограм цього газу, крім внутрішньої і зовнішніх кінетичної і потенційних енергій, володіє ще додаткової, яку переносять на собі енергією проштовхування:
Такий же енергією i володіє і 1 кг газу, що знаходиться в циліндрі, при витісненні його поршнем.
Повна енергія даної системи, що складається з 1 кг газу і діє на нього поршня, буде дорівнює сумі внутрішньої енергії і газу та енергії p υ його виштовхування, т. е. дорівнює його ентальпії. на цьому підставі ентальпію часто називають енергією розширеної системи.
Перектворення енергії
Перетворення енергії , також відоме як перетворення енергії , це процес зміни енергії від одного формі в іншу. В фізика , енергії є кількість що забезпечує здатність виконувати роботи (підйом об'єкта). На додаток до конвертованим, відповідно до Закон збереження енергії , енергія передається в інше місце або об'єкт, але вона не може бути створена або знищена.
Енергія в багатьох її формах може бути використана в природних процесах або забезпечити певну послугу суспільству, такі як опалення, охолодження, освітлення або виконання механічної роботи для роботи машин. Наприклад, щоб опалювати будинок, піч спалює паливо, чиє хімічна потенційна енергія таким чином, перетворюється в теплову енергію , яку потім переносять на домашній повітря для підвищення її температури.
В іншому прикладі a двигун внутрішнього згоряння спалює бензин, створюючи тиск, який штовхає поршні, таким чином виконуючи роботу з метою прискорення вашого автомобіля, в кінцевому рахунку перетворюючи хімічну енергію палива на додатковий автомобіль кінетична енергія що відповідає його збільшенню швидкості.
Конверсії до теплової енергії (таким чином , підвищення температури) від інших форм енергії, може відбуватися зі 100% -ної ефективності [ правити ]. Конверсія серед нетеплових форм енергії може відбуватися з досить високою ефективністю, хоча завжди існує деяка енергія, розсіяна термічно за рахунок тертя і подібні процеси.Іноді ефективність близька до 100%, наприклад, коли потенційна енергія перетворюється на кінетичну енергію, коли об'єкт падає у вакуумі, або навпаки, як об'єкт в еліптична орбіта навколо іншого тіла віддаляється від нього і перетворює свою кінетичну енергію (швидкість) в гравітаційну потенційну енергію (відстань від іншого об'єкта) - коли вона досягає найдальшої точки, вона повертає процес, прискорюючи і перетворюючи потенційну енергію в кінетичну. Оскільки простір є майже вакуумним, цей процес наближається до 100% ефективності.
Теплова енергія унікальна, тому що вона не може сама по собі бути перетвореною в інші форми енергії. Тільки a різниця У щільності теплової енергії (температури) можна використовувати для виконання робіт, а ефективність перетворення буде (значно) менше 100%. Це пояснюється тим, що теплова енергія являє собою особливо неупорядковану форму енергії - її розподіляють випадковим чином серед багатьох доступних станів колекції мікроскопічних частинок, що складають систему (ці комбінації положення і імпульсу для кожної з частинок, як кажуть, утворюють фазовий простір ). Мірою цього розладу або випадковості є ентропія , і її визначальна особливість полягає в тому, що ентропія ізольованої системи ніколи не зменшується - не можна приймати стан високоентропії (як гаряча речовина, з певною кількістю теплової енергії) і перетворювати його в стан низької ентропії (як низький стан). -температурна речовина, що має відповідну кількість хімічної потенційної енергії), не ставлячи цю ентропію в інше місце (наприклад, навколишній повітря). Іншими словами, немає ніякого шляху концентрат енергії без поширення енергії в іншому місці.
Теплова енергія в рівновазі при даній температурі вже являє собою максимальне вивільнення енергії між усіма можливими станами. Така енергія іноді вважається «деградованою енергією», тому що вона не є повністю конвертованою «корисною» формою, тобто такою, яка може робити більше, ніж просто впливати на температуру. The другий закон термодинаміки це спосіб констатувати, що, з цієї причини, теплова енергія в системі може бути перетворена в інші види енергії з ефективністю, що наближається до 100%, тільки якщо ентропія (парність або розлад) Всесвіту збільшена іншими засобами, компенсувати зниження ентропії, пов'язане з зникненням теплової енергії та її змістом ентропії. В іншому випадку тільки частина теплової енергії може бути перетворена в інші види енергії (і, отже, корисна робота), оскільки залишок тепла повинен бути зарезервований для передачі в тепловий резервуар при більш низькій температурі, таким чином, щоб збільшення в Ентропія для цього процесу більш ніж компенсується зниження ентропії, пов'язане з перетворенням решти тепла в інші види енергії.
Щоб зробити трансформацію енергії більш ефективною, бажано уникати термічної конверсії. Наприклад, ефективність ядерних енергетичних реакторів, де кінетична енергія ядер спочатку перетворюється на теплову енергію, а потім на електричну, лежить на рівні близько 35%. [1 ] [2] Завдяки прямому перетворенню кінетичної енергії в електричну енергію, тобто шляхом усунення проміжного перетворення теплової енергії, ефективність процесу трансформації енергії може бути значно покращена. [3]
Енергетичні перетворення у Всесвіті з часом характеризуються (загалом) різними видами енергії, які були доступні з часів Великий вибух , пізніше "звільнений" (тобто перетворюється на більш активні види енергії, такі як кінетична або променева енергія), коли для цього доступний механізм запуску.
Вивільнення енергії з гравітаційного потенціалу: Пряме перетворення енергії відбувається, коли водень, вироблений у Великому вибуху, збирається в такі структури, як планети, в процесі якого частина гравітаційного потенціалу перетворюється безпосередньо в тепло. В Юпітер , Сатурн , і Нептун , наприклад, таке тепло від триваючого колапсу великих газових атмосфер планет продовжує керувати більшістю погодних систем планет, з атмосферними смугами, вітрами і потужними бурями, які лише частково живляться від сонячного світла (всі електромагнітні випромінювання). або Зоряне світло , породжене Сонце ). Однак, на Уран , цей процес мало що відбувається.
Увімкнено Земля , значна частина виходу тепла з внутрішнього простору планети, що оцінюється в третині до половини загального обсягу, обумовлена повільним розпадом планетарних матеріалів до меншого розміру, з виходом течії, що приводиться в дію.
Вивільнення енергії з радіоактивного потенціалу: До відомих прикладів інших таких процесів, що трансформують енергію з Великого вибуху, можна віднести ядерний розпад, який виділяє енергію, яка спочатку «зберігалася» у важких ізотопів , таких як уран і торій . Ця енергія зберігалася під час нуклеосинтез з цих елементів, процес, який в кінцевому рахунку використовує гравітаційний потенціал енергії, що виділяється від гравітаційного колапсу Росії Тип II наднових , для зберігання енергії при створенні цих важких елементів, перш ніж вони були включені до складу Сонячна система і Земля. Така енергія, заблокована в урані, спрацьовує для раптового вивільнення ділення ядер бомби, і аналогічно зберігаються енергії в атомних ядрах вивільняються спонтанно, протягом більшості типів радіоактивного розпаду . У таких процесах тепло від розпаду цих атомів Росії радіоізотоп в ядрі Землі відразу перетворюється на тепло. Це тепло в свою чергу може піднімати гори, через тектоніка плит і орогенез . Такий повільний підйом рельєфу, таким чином, є своєрідним гравітаційним потенціалом накопичення енергії теплової енергії. Збережена потенційна енергія може бути виділена для активної кінетичної енергії в зсувах після ініціюючого події. Землетруси також вивільняються еластична потенційна енергія у скелях, свого роду механічний потенційна енергія які були вироблені з тих же джерел радіоактивного тепла.
Таким чином, згідно з сучасним розумінням, звичні події, такі як зсуви і землетруси, виділяють енергію, яка зберігається як потенційна енергія в гравітаційному полі Землі або еластична деформація (механічна потенційна енергія) в гірських породах. До цього енергія, представлена цими подіями, зберігалася у важких атомах (або в гравітаційному потенціалі Землі). Енергія, що зберігається в атомах тепла, зберігалася як потенціал з тих пір, як гравітаційні потенціали, перетворюючи енергію в колапс давно зруйнованих зірок (наднових), створювали ці атоми, і таким чином зберігали енергію всередині.
Вивільнення енергії з потенціалу синтезу водню: У подібному ланцюжку перетворень, що починаються на зорі Всесвіту, ядерний синтез водню в Сонце випускає ще один запас потенційної енергії, який був створений під час Великого вибуху. У той час, згідно з теорією, простір розширювався, і Всесвіт занадто швидко охолоджувалася, щоб водень повністю злився в більш важкі елементи. Це призвело до того, що водень, що представляє собою запас потенційної енергії, який може бути виділений ядерний синтез . Такий процес злиття викликається теплом і тиском, що виникають внаслідок гравітаційного колапсу водневих хмар, коли вони виробляють зірки, і частина енергії синтезу потім перетворюється в світло зірки. Розглядаючи сонячну систему, світло зірок, що надто переважає від Сонця, може знову зберігатися як гравітаційна потенційна енергія після того, як вона вразить Землю, як (наприклад, снігові лавини), або коли вода випаровується з океанів і депонується високо над рівнем моря ( , після звільнення на гідроелектростанції , вона може бути використана для приводу турбін / генераторів для виробництва електроенергії). Сонячне світло також веде багато явищ погоди на Землі. Прикладом погоди на сонячну погоду є a Ураган , що виникає, коли великі нестійкі ділянкитеплого океану , що нагріваються протягом декількох місяців, раптово віддають частину своєї теплової енергії до потужності за кілька днів насильницького руху повітря. Сонячне світло також захоплюється зеленими рослинами хімічна потенційна енергія , коли вуглекислий газ і вода перетворюються в горючу комбінацію вуглеводів, ліпідів і кисню. Вивільнення цієї енергії як тепла і світла може бути викликане раптово іскрою, у лісовому вогні; або може бути більш доступним для тварин або людини метаболізм коли ці молекули проковтуються, і катаболізм викликається дією ферменту.
Через усі ці трансформаційні ланцюги потенційна енергія, що зберігається під час Великого вибуху, пізніше вивільняється проміжними подіями, які іноді зберігаються різними шляхами протягом тривалого періоду часу між викидами, як більш активна енергія. Всі ці події передбачають перетворення одного виду енергії в інші, включаючи тепло.
Приклади наборів переходів енергії в машина
Наприклад, a вугільна електростанція включає в себе такі енергетичні перетворення:
Хімічна енергія у вугіллі перетворюється в термальна енергія у вихлопних газах горіння
Теплова енергія вихлопних газів перетворюється в теплову енергію пари за допомогою теплообміну
Теплова енергія пари перетворюється на механічну енергію в турбіні
Механічна енергія турбіни перетворюється на електричну енергію генератором, що є кінцевим виходом
У такій системі перший і четвертий кроки є високоефективними, але другий і третій кроки менш ефективні. Найбільш ефективні газові електростанції можуть досягти 50% ефективності перетворення. Нафтових і вугільних станціях досягти менше.
У звичайному автомобільні , ці енергетичні перетворення задіяні:
Хімічна енергія в паливі перетворюється в кінетичну енергію розширюється газу через горіння
Кінетична енергія розширюється газу перетворюється на лінійний рух поршня
Рух лінійного поршня перетворюється на поворотний рух колінчастого вала
Рух поворотного колінчастого валу перейшов у трансмісійний вузол
Ротаційне переміщення вийшло зі збірки передачі
Ротаційний рух проходив через диференціал
Поворотний рух вийшов з диференціала на привідні колеса
Поворотний рух приводних коліс перетворюється на лінійний рух транспортного засобу
Інші перетворення енергії
Є багато різних машин і перетворювачі які перетворюють одну форму енергії в іншу. Короткий перелік прикладів:
Термоелектричні ( Тепло → Електрична енергія )
Геотермальна енергетика (Тепло → Електрична енергія)
Теплові двигуни , такі як двигун внутрішнього згоряння, що використовується в автомобілях, або паровий двигун (Тепло → Механічна енергія)
Теплова енергія океану (Тепло → Електрична енергія)
Гідроелектростанції ( Гравітаційна потенційна енергія → Електрична енергія)
Електричний генератор ( Кінетична енергія або Механічна робота → Електрична енергія)
Паливні елементи ( Хімічна енергія → Електрична енергія)
Батарея (електрика) (Хімічна енергія → Електрична енергія)
Вогонь (Хімічна енергія → Тепло і світло)
Електрична лампа (Електрична енергія → Тепло і світло)
Мікрофон (Звук → Електрична енергія)
Потужність хвилі (Механічна енергія → Електрична енергія)
Вітряні млини ( Енергія вітру → Електрична енергія або Механічна енергія)
П'єзоелектрики (Штам → Електрична енергія)
Тертя (Кінетична енергія → Тепло)
Електричний нагрівач (Електрична енергія → Тепло)
Фотосинтез (Електромагнітне випромінювання → Хімічна енергія)
Гідроліз АТФ (Хімічна енергія в аденозинтрифосфаті → механічна енергія)
Архімед використав свій розум і зання для захусту Сіракуз, зробив дзеркало Архімеда, результатов якого була тотальна перемога персів. Це кричущий приклад того як можна можна перетворити енергію
Горіння.Життя це передусім енергія, і історія розвитку цивілізації - це історія оволодіння технологіями одержання енергії. Первісна людина почала з використання відновних джерел енергії. Спочатку це була енергія спалення дров та іншої целюлозовмісної органіки, а також мала енергетика млинів і вітряків. Але технічна революція стала можливою лише за умови переходу до невідновних (традиційних) джерел, на першому етапі – вугілля, на другому етапі - нафти й газу. Але як відомо останні через менш, ніж 80 років
З первісних часів і до нашого часу енергія палива забезпечує існування людства. За цей час способи добування і використання вогню надзвичайно удосконалилися, а коло застосовуваних видів палива розширився. Одночасно поглиблювалося розуміння природи горіння як фізико-хімічного процесу. В новітні часи було по-новому оцінено вплив на навколишнє середовище промислового спалювання палива на природний круговорот вуглецю, який відбувається в біосфері між атмосферою, океаном і живими організмами. Існує думка, що історія людства починається з моменту отримання вогню людиною. Саме вогонь, а точніше енергія, укладена в паливі, зробила людини таким могутнім, обігріває та висвітлює будинку, рухає машини. Людина застосував вогонь раніше, ніж навчився його навмисно добувати. Спочатку джерелами вогню були тільки пожежі, що виникають від самозаймання прілого листя, грозових розрядів і вулканічної лави. Від них отримували, дбайливо зберігали, підтримували і переносили з місця на місце «черговий» вогонь, який вважався божественним істотою, що живиться сухими листям і травою.
Потім людина навчилася сам запалювати вогонь. Штучне отримання вогню тертям дерев'яних предметів доведено історичними описами життя первісних народів і подекуди зберігалося до нової ери. Найчастіше використовували круглу паличку, яку швидко обертали в поглибленні дерев'яної дошки. Виділяється при терті тепло займисті дерев'яну тирсу в жолобки, що з'єднує точку обертання і чашу з дерев'яною стружкою або сухими подрібненими листям (детально про це читайте в розділі 2 першої частини книги). Така технологія вимагала гарної вправності і терпіння, поки кресало з сірчаного колчедану і кремінь (кресало) не полегшить цю працю. Пізніше сірчаний колчедан замінили сталлю, а в якості легкозаймистого матеріалу почали застосовувати труть - губчасту масу з висушеного гриба-трутовика. Такий пристрій було основним засобом запалювання вогню аж до винаходу в XIX столітті фосфорних сірників. Поява сучасних запальничок стало просто поверненням до старої ідеї кресала, але на новому технологічному рівні.
Засоби займання удосконалювалися одночасно з поглибленням знань про фізико-хімічну природу вогню і палива.
Речовин, що виділяють при спалюванні тепло, існує дуже багато, проте не всі вони можуть бути названі паливом. Для цього речовина має задовольняти ряду вимог, серед яких достатність і доступність в природі запасів цієї речовини або сировини для його отримання; можливість спалювання з досить високим ступенем використання отриманого тепла (ККД); нешкідливість продуктів згоряння для обслуговуючого персоналу, навколишнього тваринного і рослинного світу. Цим вимогам задовольняють різні вуглецеві речовини від майже чистого вуглецю до його сполук з воднем, киснем, азотом і сіркою.
На початку XVIII століття була зроблена спроба пояснити явище горіння на основі гіпотези флогістона. Відповідно до цієї гіпотези все речовини, здатні горіти або змінюватися від дії вогню, містять особливу. «Речовина вогню» – флогістон. Вперше правильно витлумачив горіння як з'єднання палаючого речовини з «важкими частинками повітря» М.В. Ломоносов.
В основі отримання енергії з палива горінням завжди лежить хімічна реакція окислення. Прикладом може служити горіння метану:
СН4 + 2О2 = СО2 + 2Н2О + Енергія.
Горіння – це хімічна реакція окислення, при якій спостерігаються хоча б два з трьох наступних ознак: розігрівання палаючого тіла, світіння і полум'я. Найчастіше ми спостерігаємо все три ознаки. Рідше зустрічається горіння без полум'я. Так, наприклад, горять порошки металів. І зовсім рідко буває так зване холодне горіння - без нагрівання. Таке полум'я у розріджених парів фосфору.
Що лежить в основі процесу горіння?
В основі горіння лежить:
Наявність горючої речовини;
Окислювача (структурна частинка атом, молекула чи йон, яка приймає електрони)
Джерело запалювання (фактор, який надає енергію електронам)
Повне — за достатньої або надлишкової кількості окислювача і за такого горіння виділяються нетоксичні речовини. Неповне — відбувається за недостатньої кількості окислювача. За неповного горіння утворюються продукти неповного згорання, серед яких є токсичні речовини (чадний газ, водень).
Від яких факторів залежатиме ефективне згорання речовини:
якість палива (чистіші краще згорають, ніж з домішками, приклади сажа і огарки, недоокиснення СО, неповне горіння, нечистий кисень);
співвідношення реагентів (надлишок чи недостача кисню, вигідне, щоб згорав все паливо, але витрачати гроші на надмірно надлишкову кількість повітря чи кисню);
передача теплоти, що виділяється в ході реакцій;
від руху мас: палива та кисню (ефективно коли подається противотечійно);
видалення продуктів згорання (при згоранні вуглеводній вивільнити СО2 із середовища)
розмір частинок, що згорають.
Енергія палива.Існують різні види палива: вугілля, торф, дрова, природній газ та інші. Згораючи, паливо виділяє енергію. Це відбувається тому, що енергія палива і кисню, який міститься у повітрі, більший, ніж енергія вуглекислого газу, який утворюється з них. Досить часто виникає необхідність розрахунку кількості теплоти, яка виділяється під час згорання палива. Для того, щоб розрахувати кількість теплоти, яка виділяється в наслідок повного згорання одиниці маси різних видів палива.
Питомою теплотою згорання палива називають фізичу величину, що чисельно дорівнює кількості теплоти, яка виділяється в наслідок згорання 1 кг палива. Одиниця виміру Дж/кг.
Для природнього газу питома теплота рівна 4,4 107 Дж/кг. Наприклад, для згорання 1 кг газу, необхідно витратити 4,4 107 Дж енергії.
Для обчислення кількості теплоти, яка виділилася під час повного згорання паливо масою м, потрібно питому теплоту згорання q помножити на масу палива:
Q=qm
Деякі вадливі принцпи з фізики
Базові поняття і принципи перед тим як розпочати розглядати роботу газу
• Газ – це скупність молекул, які хаотично рухаються у всіх напрямах незалежно одна від одної. Харкерною властивістю газу на відміну від інших форм є здатність заповнювати простір та легко стискуватися.
• Тиск – це фізична величина, яка дорінює відношенню модуля сили, що діє перпендикулярно до поверхні тіла. Тиск, що діє на рідину чин на газ передається ним у всі напрями (закон Паскаля).
• Поршень - основна деталь насосів, компресорів та поршневих двигунів внутрішнього згоряння, що служить для перетворення енергії стисненого газу в енергію поступального руху (в компресорах - навпаки).
• Енергія не звідки не береться, а переходить з одного стану в інший.(закон збереження енергії).
• Енергія – це міра хаосу.
• Енергію мають усі рухомі тіла . До того ж чим більша маса тіла тим з більшою швидкістю воно рухається, тим більшу енергію воно має.
• Безладний рух частинок, з яких складаються тіла називають тепловим рухом.
• Теплопровідність – це явище передачі внутрішньої енергії від однієї частинки тіла до іншої або від одого тіла до іншого при безпосередньому контакті.
• Кількість теплоти необхідної для нагрівання тіла або кількість теплоти, яку воно віддає при охолодженні, заледить від його маси, від зміни температури і роду речовини з якої воно складається/
• Енергія тіл залежить від їхніх швидкостей, розташованих у просторі, температури, форми, хімічного складу та ін.. Зміна енергії тіл відбувається або за рахунок роботи, яка виконується цими тілами, або за рахунок передачі енергії.
• Існує взаємний перехід між рідкою та газоподібною фазою, якщо відбувається перехід від рідкого стану до газоподібного під дією температури, то це випаровування, конденсація, процес переходу від газоподібного стану до рідкого.
• Молекулярно-кінетична теорія: всі речовини складються з частино (атомів, молекул, йонів); всі частинки перебувають у безперерервному, хаотичному русі (наприклад, поширення запахів); між частинками діють сили притягання, відштовхування, характер взаємодії залежить від відстані;між молекулами не дільб сили притягання і під час зіткнень вони поводять себе як абсолютні тіла; теплова рівновага у вьому об’ємі встановлюється миттєво.
• Кількість теплоти переданої системі, витрачається на зміну її внутрішньої енергії і виконання нею роботи (І закон термодинаміки)
• Газ виконує роботу під час розширення. Під час ізобарного нагрівання газ розширюється і виконує додаткову роботу: A=p∆V
• Розширення газу процес необоротній.
•
• У тепловій машині, що діє циклічно, неможливий процес, єдиним результатом якого було б перетворення в механічну роботу всієї кількості теплоти, отриманої від джерела енергії – нагрівника.
• Тепло переходить від більш нагрітого тіла до менш нагрітого тіла.
• Газ розширюючись охолоджується, а при стиснені через перегородку нагрівається(ефект Джолуля-Томсона).
• Машина Карно
• Наслідки з І і ІІ закону термодинаміки
• Ізохора, ізобара, ізотерма, адіабата
• Дифузія
• У рідинах і газах, що знаходяться у стані спокою зовнішній тиск передається у всі боки
• Перехід енергії з однієї форми в іншу
• Галілей розсудив, що існують дві форми енергії і під час коливань маятника одна форма переходить в іншу і навпаки. Одна - це гравітаційна потенційна енергія, здатна піднімати фізичне тіло над поверхнею Землі, долаючи її тяжіння. Гравітаційна енергія повинна додаватися масі, щоб та змогла піднятися вище, і вивільнятися, коли маса падає. Якщо вам доводилося забиратися на велосипеді по крутому схилу пагорба, ви знаєте, що для подолання тяжіння Землі потрібна чимала енергія. Інша форма енергії, притаманна маятнику, - кінетична, пов'язана зі швидкістю. Таким чином, маятник використовує перехід потенційної енергії в кінетичну і назад. У точності те ж робить хитромудрий велосипедист. Спускаючись по крутому схилу, він може набрати швидкість і долетіти до кінця спуску, навіть не крутячи педалі, а потім використовувати набрану швидкість для того, щоб злетіти на якусь відстань вгору по схилу наступного горба.
• Багатогранність енергії Енергія проявляє себе у вигляді різних типів, і в кожному з них вона може тимчасово зберігатися різними способами. Стиснута пружина зберігає енергію пружності, яка може потім вивільнятися за нашим бажанням. Теплова енергія збільшує коливання атомів і молекул в речовині. Так, сковорідка нагрівається на плиті, тому що її атоми, отримуючи приплив енергії, починають коливатися швидше. Енергія може також переноситися в вигляді електромагнітних хвиль - світло, радіохвилі, - а хімічна енергія - вивільнятися в ході хімічних реакцій, що і відбувається в травній системі кожного з нас.
• Збереження енергії Збереження енергії - це перш за все закон фізики, а вже потім заклик економити енергію. Закон цей стверджує, що загальна кількість енергії незмінно, навіть коли вона перерозподіляється між різними типами. Дані про це з'явилося лише відносно недавно, після вивчення багатьох типів енергії.
• Закон ідеального газу Тиск, обсяг і температура газу пов'язані між собою, і закон ідеального газу визначає, як саме. Якщо ви нагріваєте газ, він прагне розширитися; якщо ви стискаєте його, він займає менше місця, але створює більш високий тиск. Закон ідеального газу знаком і авіапасажирам, тремтячим від однієї думки про те, який страшний холод варто за бортом, і альпіністам, які знають, що в міру сходження до вершини температура повітря і тиск будуть падати. Навіть Чарлз Дарвін зміг звинуватити закон ідеального газу в тому, що, коли він перебував у таборі, розбитому високо в Андах, там ніяк не вдавалося зварити картоплю.
• Якщо ви коли-небудь користувалися скороваркою, значить, користувалися і законом ідеального газу. Адже що таке скороварка? Каструля з кришкою, приганяє так щільно, що під час приготування їжі пар не може вийти з неї назовні. Оскільки пара, що утворилася при кипінні води, з каструльки не виходить, тиск всередині неї підвищується. І тиск може зрости настільки, що кипляча вода більше не зможе випаровуватися, а тому температура варива перевищить звичайну температуру кипіння води, 100 градусів за Цельсієм. В результаті їжа приготується швидше, а в смаку не втратить.
• Закон ідеального газу, вперше сформульований в XIX столітті французьким фізиком Емілем Клапейроном, описує взаємозв'язок тиску, температури і об'єму газу. Тиск зростає і при зменшенні обсягу, і при зростанні температури. Уявіть собі коробку з повітрям. Якщо ви зумієте зменшити обсяг коробки вдвічі, тиск в ній подвоїться. Якщо нагрієте коробку, подвоївши її початкову температуру, знову-таки подвоїться і тиск в ній.
• . Клапейрон поєднав три цих параметра, розмірковуючи про кількість газу, який іменується «молем», - цей термін описує певне число атомів або молекул, а саме 6 1023 (6 з 23 нулями), відоме також як число Авогадро. Число це виглядає колосальним, але приблизно стільки атомів ви знайдете в графітовому стрижні олівця. Моль визначається як число атомів вуглецю-12 в 12 грамах вуглецю. Можна сказати і так: якщо зібрати число грейпфрутів, яка дорівнює кількості Авогадро, вони займуть об'єм, що дорівнює об'єму Землі.
• «Шляхетні» гази, такі як неон, аргон і ксенон, поводяться як ідеальний газ, що складається з окремих атомів (а не молекул). Легкі симетричні молекули - водень, азот, кисень - поводяться майже як ідеальні гази, але чим важче молекули газу - бутану, наприклад, - тим більше відхиляється він в своїй поведінці від ідеального. Гази мають дуже низькою щільністю, їх атоми або молекули ніяк не зливаються один з одним, але рухаються абсолютно вільно. В ідеальному газі атоми поводяться, як гумові кульки, викинуті на корт для гри в сквош, - стукаються один об інший і об стінки судини, в якому знаходиться газ. Власних кордонів газ не має, але може міститися в посудині певного обсягу. При зменшенні цього обсягу відстань між частинками газу скорочується, чому, згідно з газовим законом, зростають тиск і температура.
• Зіткнення зі стінками пружні, тобто частки газу відскакують, не втрачаючи енергію і не прилипаючи, однак передають судині імпульс, який і сприймається як тиск. Імпульс міг би і зрушувати посудину з місця, проте посудину противиться переміщенню, а сили ударів діють в самих різних напрямках, в середньому врівноважуючи один одного. Підвищення температури збільшує швидкість часток газу, так що тиск на стінки ще посилюється. Теплова енергія передається молекулам, збільшуючи їх кінетичну енергію і змушуючи рухатися швидше. Вдаряючись об стінки, вони передають їм більший імпульс, що знову-таки призводить до зростання тиску. Зменшення обсягу збільшує щільність газу, через що зіткнення зі стінками відбуваються частіше, - знову підвищується тиск. Підвищується і температура, а закон збереження енергії призводить до того, що молекули, отримуючи менше простору для польотів, починають прискорюватися. Деякі з реальних газів не дотримуються цього закону в точності. Якщо газ складається з великих і складних молекул, в ньому можуть виникати додаткові сили, та й злипаються такі молекули частіше, ніж в ідеальному газі. Сили злипання можуть виникати завдяки електричні розряди атомів, з яких складаються молекули, прояв їх більш імовірно, коли газ сильно стиснутий або сильно охолоджений, оскільки за таких умов молекули рухаються повільно. По-справжньому липкі молекули - білків або жирів - взагалі ніколи газів не утворюють.
• Зіткнення зі стінками пружні, тобто частки газу відскакують, не втрачаючи енергію і не прилипаючи, однак передають судині імпульс, який і сприймається як тиск. Імпульс міг би і зрушувати посудину з місця, проте посудину противиться переміщенню, а сили ударів діють в самих різних напрямках, в середньому врівноважуючи один одного. Підвищення температури збільшує швидкість часток газу, так що тиск на стінки ще посилюється. Теплова енергія передається молекулам, збільшуючи їх кінетичну енергію і змушуючи рухатися швидше. Вдаряючись об стінки, вони передають їм більший імпульс, що знову-таки призводить до зростання тиску. Зменшення обсягу збільшує щільність газу, через що зіткнення зі стінками відбуваються частіше, - знову підвищується тиск. Підвищується і температура, а закон збереження енергії призводить до того, що молекули, отримуючи менше простору для польотів, починають прискорюватися. Деякі з реальних газів не дотримуються цього закону в точності. Якщо газ складається з великих і складних молекул, в ньому можуть виникати додаткові сили, та й злипаються такі молекули частіше, ніж в ідеальному газі. Сили злипання можуть виникати завдяки електричні розряди атомів, з яких складаються молекули, прояв їх більш імовірно, коли газ сильно стиснутий або сильно охолоджений, оскільки за таких умов молекули рухаються повільно. По-справжньому липкі молекули - білків або жирів - взагалі ніколи газів не утворюють.
• Термодинаміка
• Другий закон термодинаміки - це основа основ сучасної фізики. У ньому йдеться, що тепло передається від розігрітих тел до холодних, але не передається назад. Оскільки теплота є міра безладу, або ентропії, інше формулювання закону виглядає так: в ізольованій системі ентропія завжди зростає. Другий закон пов'язує хід часу і відбуваються у всесвіті події з її кінцевої долею.
• Якщо ви наливаєте гарячу каву в стакан з кубиками льоду, лід зігрівається і тане, а кава охолоджується. Але чи задавалися ви коли-небудь питанням, чому температура кави не підвищується? Адже кава міг би витягнути з льоду залишки тепла, стати гаряче, а лід став би ще холодніше. Досвід говорить нам, що так не буває. Але чому? Тенденція гарячих і холодних тіл обмінюватися теплом і купувати рівну температуру відображена другим початком термодинаміки. У загальному і цілому він звучить так, що тепло не може переходити від холодного тіла до гарячого. А як же тоді працюють холодильники? Як нам вдається охолодити стакан апельсинового соку, якщо передати його тепло чогось іншого неможливо? Другий закон дозволяє зробити це, але лише при особливих умовах. Охолоджуючи що-небудь, холодильник генерує велику кількість тепла, в чому легко переконатися, приклавши долоню до його задній стінці. І оскільки він вивільняє тепло, то порушення другого початку не відбувається - потрібно просто враховувати загальну енергію холодильника і його оточення.
• Ентропія Теплота є міра безладу, а у фізиці безлад часто отримує кількісне вираження як «ентропія» - міра способів, якими може організовуватися система, що складається з багатьох елементів. Скажімо, пакет з сухими макаронами володіє низькою ентропією, оскільки макаронини в ньому впорядковані, але киньте їх в каструлю з окропом - вони переплетуться, порядку стане менше, а ентропія їх зросте. Точно так же акуратні ряди іграшкових солдатиків володіють низькою ентропією, а якщо розсипати їх по підлозі, ентропія солдатиків підвищиться. Але яке відношення має все це до холодильників? Одна з формулювань другого початку термодинаміки виглядає так: ентропія обмеженою системи зростає і ніколи не зменшується. Температура пов'язана з ентропією безпосередньо - холодні тіла мають малу ентропією. Їх атоми невпорядкованості в меншій мірі, ніж розгойдуються атоми нагрітих тел. Тому будь-яка зміна ентропії системи з урахуванням всіх її складових породжує в кінцевому рахунку тільки один ефект: ентропія зростає. Що стосується холодильника, охолодження апельсинового соку зменшує його ентропію, проте зменшення це компенсується виробленим холодильником нагріванням повітря. Фактично збільшення ентропії повітря перевищує зменшення ентропії охолодженням продуктів. Якщо розглядати систему в цілому - холодильник і його оточення, - другий початок термодинаміки залишається справедливим. Ще одна його формулювання зводиться до того, що ентропія зростає завжди. Другий закон справедливо для ізольованих систем, в які енергія не надходить ззовні і з яких вона не виводиться. У ній працює закон збереження енергії. Всесвіт і сама є ізольованою системою в тому сенсі, що поза нею, за визначенням, нічого не існує. Таким чином, у всесвіті енергія зберігається, а ентропія повинна зростати. У малих її областях може відбуватися незначне зменшення ентропії, пов'язане, скажімо, з охолодженням, проте воно компенсується, як і в разі холодильника, нагріванням в інших областях і таким збільшенням їх ентропії, що сумарна ентропія всесвіту зростає.
• Але як же воно виглядає, зростання ентропії? Якщо налити шоколадний сироп в стакан молока, все почнеться з низького значення ентропії - молоко і сироп утворюють ясно помітні білий і коричневий шари. Якщо ж ви збільшите ентропію, розмішавши напій ложкою, молекули молока і сиропу перемішається. Максимальний безлад виникне в склянці, коли сироп повністю змішається з молоком і напій придбає коричневий відтінок. Згадайте ще раз про всесвіт як про цілий - другий початок має на увазі, що з часом атоми в ній стають все більш неупорядкованими. Будь-які блоки речовини будуть повільно розсипатися, поки їх атоми не заповнили весь світ. Тобто кінцевий стан всесвіту, колишньої спочатку багатобарвним килимом із зірок і галактик, - це сірий океан безладно перемішаних атомів. Коли всесвіт розшириться настільки, що галактики почнуть розпадатися, а речовина, з якого вони складаються, - розріджувати, залишиться лише подібність супу з частинок. І якщо припустити, що розширення Всесвіту триватиме, то кінцевим її станом буде «теплова смерть». Вічний рух Оскільки теплота є форма енергії, її можна змусити працювати. Паровий двигун перетворює тепло в механічний рух поршня або турбіни, яка може виробляти електрику. Бо2льшую частина термодинаміки і була розроблена в XIX столітті для пов'язаних з паровими двигунами практичних потреб, а не виведена фізиками на папері. Ще один наслідок другого початку полягає в тому, що парові двигуни, як і інші, що працюють на тепловій енергії, далеко не досконалі. Будь-який процес, що перетворює тепло в іншу форму енергії, пов'язаний з втратою малої її частини, а в підсумку ентропія системи в цілому зростає. Ідея вічного двигуна - машини, яка ніколи не втрачає енергію і тому може працювати вічно, - переслідувала вчених ще з часів Середньовіччя. Другий закон термодинаміки поклав кінець їхнім надіям, однак до того, як він був сформульований, вони встигли запропонувати безліч конструкцій таких машин. Уява Роберта Бойля малювала чашу, яка переливала воду з себе в себе ж саму, індійський математик Бхаскара придумав колесо, яке саме себе крутить, переміщаючи закріплені на його спицях вантажі. При найближчому розгляді з'ясовувалося, що такі двигуни втрачають енергію. Ідеї, подібні цим, набули такого широкого поширення, що вже в XVIII столітті слова «вічний двигун» придбали погану славу. І Французька королівська академія наук, і американське Бюро патентів просто заборонили розглядати пропозиції, що стосуються вічних двигунів. І сьогодні ці машини належать до області, в якій трудяться дивакуваті винахідники-кустарі. Демон Максвелла Одна з викликали найбільші суперечки спроб обійти другий початок термодинаміки була запропонована в 1860-х шотландським фізиком Джеймсом Клерком Максвеллом у вигляді уявного експерименту. Уявімо собі два що стоять пліч-о-пліч прямокутних судини з газом однієї температури. У стінках судин є по маленькому отвору, яке дозволяє частинкам газу переходити з посудини в посудину. Якщо нагріти одну посудину, частинки, проходячи через цей отвір, поступово вирівняють температури. Максвелл уявив собі, що у отвори сидить крихітний демон, мікроскопічний чортеня, який виловлює найшвидші молекули однієї судини і проштовхує їх в інший. В результаті середня швидкість руху молекул другого судини зростає за рахунок молекул першого. Стало бути, постулював Максвелл, тепло буде переноситися з посудини холодніше в посудину гарячіше. Хіба такий процес не виявиться порушенням другого закону термодинаміки? Чи не дозволить правильний відбір молекул переносити тепло з холодного тіла в гаряче? З тих пір фізики безуспішно намагалися пояснити, чому демон Максвелла працювати ну ніяк не може. Багато з них говорили, що процес вимірювання швидкостей частинок, а потім відкривання і закривання з'єднує судини люка зажадає роботи, а значить, і витрат енергії, а це означає, що повна ентропія системи не зменшиться. Найближче підійшов до реалізації «демона Максвелла» в нанорозмірних масштабах Единбурзький фізик Девід Лі. Його пристрій дійсно відділяло швидкі частинки від повільних, але для цього йому був потрібний зовнішнє джерело енергії. Оскільки механізму, який міг би переміщати частинки без використання зовнішньої енергії, не існує, обійти другий початок термодинаміки фізикам не вдалося й досі. По крайней мере, до цієї пори воно тримається.
• Броунівський рух - це безладні переміщення малих часток, що виникають внаслідок їх зіткнення з невидимими молекулами води або газу. Першим його виявив ботанік Роберт Броун - частинки пилку, які він розглядав під мікроскопом на мокрому предметному склі, рухалися ривками, - проте описати математично зміг тільки Альберт Ейнштейн. Броунівський рух пояснює, як поширюється в спокійному повітрі пилок, а й описує також безліч випадкових процесів - від повеней до стрибків на фондовому ринку. Його непередбачувані ривки пов'язані з фракталами
• Перший закон: Перемогти ти не можеш
• Другий закон: Ти можеш тільки програти.
• Третій закон: Вийти з гри тобі теж не вдасться
• Газ Хмара не пов'язаних один з одним атомів або молекул.
• Тиск Сила на одиницю площі.
• Зірка Газовий куля, в ядрі якого відбувається ядерний синтез.
• Молекула Група атомів, з'єднаних хімічними зв'язками.
• Ядерний синтез Злиття легких ядер атомів в більш т яжелие.
• Атом. Найменша одиниця матерії, здатна існувати самостійно. Атоми містять тверді внутрішні ядра, що складаються з (позитивно заряджених) протонів і (НЕ заряджених) нейтронів і оточені хмарами (негативно заряджених) електронів
• Газ. Хмара не пов'язаних атомів або молекул. Гази не мають чітких меж, але можуть обмежуватися якимось посудиною.
• Тиск. Визначається як сила на одиницю площі. Тиск газу - це сила, яку його атоми або молекули докладають до внутрішньої поверхні містить газ судини.
• Маса. Властивість, еквівалентну кількості атомів або кількості енергії, які містить чтолибо. Інерція - це схожа ідея,
• Сила. Підйом, поштовх чи ривок, що змушує змінюватися рух чого-небудь. Другий закон Ньютона визначає силу як величину, пропорційну створюваному нею прискоренню.
• Енергія. Властивість чогось, що визначає його здатність до зміни. Загальна її кількість зберігається, але може розподілятися між різними типами енергії. Ентропія. Міра безладу. Чим більш впорядковано що-небудь, тим менше його ентропія.
Принцип роботи двигуна внутрішнього згоряння (ДВЗ)
Дію поршневої двигуна внутрішнього повороту засновано на вікорістанні датчіків теплового Розширення нагрітіх газів во время руху поршня. Нагрівання газу відбувається в результате згоряння в ціліндрі паливо-повітряної суміші. Для повторення циклу відработанную газову суміш нужно віпустіті в кінцевій годину поршня и заповнити нову порцію паливо и Повітря. В кінці положення відбувається підпал паливо від іскри свічки. Випуск и випуск паливо та продукту відбувається через клапани, керовані механізмамі газорозподілу и системою подачі палів.
Таким чином, цикл роботи двигуна ділиться на наступні етапи:
Такт впуску.
Такт стиску.
Такт розширення, або робочий хід.
Такт випуску.
Зусилля від рухається поршня циліндра через колінчастий вал перетворюється в обертальний рух вала двигуна. Частина енергії обертання витрачається на повернення поршнів в початковий стан, для здійснення нового циклу. Конструкція вала визначає різне положення поршнів в різних циліндрах в кожен конкретний момент часу. Таким чином чим більше в двигуні циліндрів, тим, в загальному випадку, рівномірніше обертання його вала.
По розташуванню циліндрів двигуни діляться на кілька типів:
а) Двигуни з вертікльним або похилим розташуванням циліндрів в один ряд
б) V-подібні з взаємним розташуванням циліндрів під кутом у формі латинської букви V:
d) Двигуни з протилежними циліндрами. Він носить назву "опозитний", циліндри в ньому розташовані під кутом 180 градусів:
Механізм газорозподілу двигуна на такті випуску забезпечує очистку циліндрів від продуктів згоряння (відпрацьованих газів) і наповнення циліндрів новою порцією паливно-повітряної суміші на такті впуску.
Система запалювання виробляє високовольтний розряд і передає його свічці циліндра через високовольтний провід. Управління підпал здійснює трамблер, проводи від якого підходять до кожної свічці. Трамблер влаштований таким чином, щоб розряд виникав саме в тому циліндрі, де поршень в даний момент проходить точку найбільшого стиснення паливної суміші. Якщо суміш спалахне раніше, то тиск газу спрацює проти його ходу, якщо пізніше - потужність виділяється розширенням газів буде використана не повністю.
Для запуску двигуна, йому необхідно надати початковий рух. Для цього використовується система старту (див. Статтю "як працює стартер") від електричного двигуна - стартера.
Переваги бензинових двигунів
Більш низький рівень шуму і вібрацій в порівнянні з дизелем;
Велика потужність при рівному обсязі двигуна;
Можливість роботи на високих оборотах, без серйозних наслідків для двигуна.
Недоліки бензинових двигунів
Більший ніж у дизеля витрата палива, і більш високі вимоги до його якості;
Необхідність наявності і постійної роботи системи запалювання палива;
Найбільша потужність бензинових ДВС досягається у вузькому діапазоні оборотів.
Зелена хімія принципи
1. Виконуємо якомога менше відходів.
2. Плануємо хімічні процеси так, щоб в справу йшов кожен атом реагенту.
3. Не застосовуємо біологічно небезпечні реагенти, що не створюємо біологічно опас¬них побічних продуктів.
4. Розробляємо менш отруйні нові продукти.
5. Застосовуємо безпечніші розчинники, в меншій кількості.
6. Бережімо енергію.
7. Застосовуємо відновлюваних сировину.
8. Проектуємо реакції, які виробляють тільки потрібні нам речовини.
9. Застосовуємо каталізатори і так збільшуємо ефективність.
10. Розробляємо продукти, безпечно розкладаються в природі.
11. Стежимо за процесами щоб уникнути витоків і виникнення біо-логічно небезпечних побічних продуктів.
12. Вибираємо методики, які мінімізують ймовірність нещасних випадків, пожеж і вибухів.


про публікацію авторської розробки
Додати розробку
