УрокВалентність хімічних елементів.Звʹязок між розміщенням елемента в періодичній системі та його валентністю.
7 клас Хімія
Школа КЗО « СЗШ №50» ДМР
Вчитель:Кліценко Ольга Олексіївна
Стаж: 37 років
Категорія:вища
Звання :Старший вчитель
Тема. Валентність хімічних елементів.Звʹязок між розміщенням елемента в періодичній системі та його валентністю.
Цілі уроку:
Освітня:
- ознайомити учнів з новим поняттям «валентність» хімічних елементів,як здатності атомів утворювати певну кількість звʹязків та хімічні сполуки;
- показати звʹязок між розміщенням елемента в періодичній системі та його валентністю;
- формувати навички розставляти валентності елементів і складати формули бінарних сполук за валентністю та виробляти вміння застосовувати на практиці раніше здобуті знання;
Розвивальна:
- продовжити формувати навички учнів користуватися періодичною системою як джерелом інформації;
- розвивати хімічну мову,памʹять,спостережливість,логічне мислення,
- показати звʹязок хімії з іншими природничими науками,зокрема математикою,біологією;
- формувати стійкий інтерес до вивчення предмету.
Виховна:
- виховувати в учнів інтерес до хімії, допитливість,прагнення брати участь у пошуку нових знань,працелюбність та наполегливість,вміння працювати самостійно і в групі.
- показати необхідність застосування набутих знань з предмету для практичного життя
Тип уроку: комбінований урок
Основні поняття:хімічна формула,види формул,валентність,НСК
Форми та прийоми роботи на уроці: групова,фронтальна,парна;робота з підручником, керована практика,розповідь,робота з ПСХЕ,складання моделей речовин,прийоми:бліц-інтервʹю,»лови помилку»,робота біля дошки (прийом «міні -практикум»,графічний диктант (прийом « вірю-невірю»)
Обладнання: періодична система хімічних елементів Д. І.,картки з алгоритмом складання формул за валентністю та визначення валентності елементів у бінарних сполуках.
Девіз уроку: Запитуй!Сперечайся!
Думай!Аналізуй!
Висновком мудрим думку хвилюй!
«Хімічні формули говорять хімікові цілу історію речовини»
Д.І.Менделєєв
ХІД УРОКУ
I. Організаційний момент уроку.
Дорогі діти, сьогодні у нас з Вами незвичайний урок.До нас прибули гості,то ж давайте ми з Вами привітаємось до них,посміхнемось один одному і побажаємо всім нам успіху. Сподіваюсь час ,який ми проведемо з вами разом на нашому уроці дозволить вам ще краще полюбити цей предмет та піднятися на щабель вище у вивченні цієї дивовижної науки хімії,тому девізом уроку сьогодні у нас будуть слова: Запитуй! Сперечайся!Думай!Аналізуй!Висновком мудрим думку хвилюй!Що це значить?А це значить,що сьогодні ми будемо працювати напружено і саме головне,ви самі оцінете рівень своїх навчальних досягнень.У вас на партах є листки навчальних досягнень:
підпишіть їх ,будь-ласка.(кожна вірна відповідь,дає вам право отримати 1 бал,відповідь неповна-0,5балів,відсутність відповіді-0балівТож будьте уважні.
Епіграфом до уроку взяті слова вченого з великої букви.Як ви розумієте ці слова?І чому саме я взяла їх ?
II. Мотивація навчальної діяльності та засвоєння нових знань
Так,хімічні формули дійсно говорять дуже багато про речовини,зокрема про їх склад,
властивості,будову,а значить і практичне застосування у житті.Назвіть мені речовини,які відомі вам?.Так речовин багато,близько 15 тисяч неорганічних та майже 20 млн органічних,тих,що дає нам природа та тих,що добуті штучно.Їх використовують у техніці,промисловості,сільському господарстві,медицині, побуті та інших сферах людського життя.Всі речовини,з якими маємо справу в будь-якій з галузей,що щойно перелічили-це перш за все не тільки назва ,а й відповідний склад-тобто,іншими словами –формула.Ось цьому питанню ми сьогодні і присвятимо наш урок.Давайте з вами повторимо все,що відомо нам на сьогодні про хімічну формулу у формі хімічної розминки.А поки з класом ми будемо відновлювати матеріал біля дошки будуть працювати.(робота за картками – прийом міні-практикум)
Картка 1
Що означають такі записи:H2; 5O2 ; O3 ; 2 H2O ; N2.Яка з речовин є зайвою і чому? Доведи. Скільки атомів і молекул містить друга речовина? Що таке коефіцієнт?
Картка 2.
Запишіть формули речовин :аш-три-пе-о-чотири;натрій –два-ес-о-чотири; пе-аш-три; кальцій-о, ен-два.Яких речовин простих чи складних,записаних тобою більше?Відповідь доведи.
Картка 3
Склади формули трьох речовин: Молекула першої речовини містить 2 атоми Нітрогену,атом Оксигену; молекула другої речовини - 2 атоми Нітрогену,3 атоми Оксигену.У якої речовини в молекулі більша кількість атомів?Відповідь доведи.
1.Як ви можете назвати записи,що бачите на екрані?(хімічні формули)
2.Прочитайте їх:НСl,H2O,NH3,CH4,C2H5OH
3.Що таке хімічна формула?(Умовний запис складу речовини)
4.Хто вмітиме писати хімічні формули?(Той,хто знає символи хімічних елементів)
5. Яку інформацію можна одержати з хімічної формули?( назва, проста чи складна речовина, якісний та кількісний склад ,відношення мас елементів)
6.Що таке індекс?(назвіть індекси у вище зазначених формулах речовин
7.Що таке коефіцієнт у формулі речовини?(число записане перед формулою)
8. Як скласти формулу хімічної сполуки?
(Потрібно знати, з атомів яких хімічних елементів складається молекула цієї речовини.
Необхідно знати кількість атомів кожного елемента)
9.А ми вміємо складати формули речовин? (ні)а хочемо?
10. Чому атоми хімічних елементів утворюють молекули в суворо визначеному співвідношенні?
(тому що можуть утворювати тільки чітко визначену кількість звʹязків;
атоми мають властивість, що визначає здатність атома певного хімічного елемента приєднувати певне число атомів інших елементів)
ІІІ.Вивчення нового матеріалу
- Поняття валентності. Ми будемо називати цю здатність валентністю.Валентність –це властивість атомів приєднувати певну кількість атомів іншого хімічного елемента.
За одиницю валентності приймають валентність атома Гідрогену. Вона дорівнює 1.
Вважають, що Гідроген у сполуках одновалентний. За кількістю атомів Гідрогену, що може приєднати атом, можна визначити його валентність.
Наприклад, HCl: у Хлору в цій сполуці валентність І, тому що він приєднує один атом Гідрогену.За правилом: сума одиниць валентностей атомів одного елемента дорівнює сумі одиниць валентностей іншого елемента.Валентність розставляють над знаками хімічних елементів римськими цифрами(показую це)
H2S — у Сульфуру в цій сполуці валентність ІІ;
PH3;— у Фосфору валентність ІІІ;
CH4— у Карбону валентність IV.
Демонстрація всього сказаного на моделях атомів(практично учні по групах).
2.Періодична система є джерелом інформації для визначення валентностей елементів.Слід запамʹятати такі правила:
• для атомів елементів І, ІІ, ІІІ груп головної підгрупи валентність завжди дорівнює номеру групи
• для атомів елементів IV, V, VI, VII груп номер групи показує найвищу валентність.
- для атомів елементів IV, V, VI, VII груп головної підгрупи валентність у сполуках з Гідрогеном дорівнює 8 мінус номер групи;
для елементів побічної підгрупи валентності змінні.
• для атомів елементів зі змінною валентністю валентність указується в дужках поряд з назвою або хімічним символом елемента;
- слід запамʹятати валентність у деяких хімічних елементів:Н (І),О (ІІ),F (І).
Завдання 1.Назвіть максимальну валентність С,Н,Аl,Ca,Cl,N,O
Завдання 2.Сумарна валентність кожного елемента в сполуках.що складаються з двох елементів має бути одинакова.Перевірте це твердження:
CH4 ;PH3; H2S; HCl:
;
3.Робота з таблицею «Валентність деяких елементів» стор.70.
|
Валентність деяких хімічних елементів |
|
|
Валентність стала |
|
|
І |
H,Li,Na,K,F |
|
ІІ |
O,Ca,Mg,Ba,Zn,Be |
|
ІІІ |
Al |
|
Валентність змінна |
|
|
І , ІІ |
Cu,Ag,Hg |
|
ІІ , ІІІ |
Fe,Co ,Ni |
|
ІІ , ІV |
C C, Sn,Pb ,Si |
|
III , V |
P ,As |
|
II , III, VI |
Cr |
|
II , IV , VI |
S |
|
I, II, III, IV, V |
N |
4.Поняття про бінарні сполуки.
Якщо речовина містить у своєму складі два хімічні елементи,вона називається бінарною сполукою.Бінарні сполуки розподіляються на типи в залежності від того,який елемент стоїть на другому місці у формулі сполуки.
Робота з карткою-таблицею «Бінарні сполуки,формули,типи та назва»
|
№з/п |
Загальна формула |
Назва типу бінарної сполуки |
Приклад |
|
1 |
ЕхОу |
Оксиди |
Na2 O-натрій оксид Fe2 O3-ферум (ІІІ) оксид |
|
2 |
ЕхSу |
Сульфіди |
K2 S-калій сульфід CaS- кальцій сульфід |
|
3 |
ЕхClу |
Хлориди |
CaCl2-кальцій хлорид CrCl3-хром (ІІІ) хлорид |
|
4 |
ЕхFу |
Флуориди |
KF- калій флуорид SF4-Сульфур (ІV)флуорид |
|
5 |
ЕхIу |
Іодиди |
MgI2-магній йодид FeI3-ферум (ІІІ)йодид |
|
6 |
ЕхBrу |
Броміди |
LiBr-літій бромід CuBr2-купрум (ІІ)бромід |
|
7 |
ЕхРу |
Фосфіди |
AlP-алюміній фосфід Ca3P2-кальцій фосфід |
|
8 |
ЕхCу |
Карбіди |
Al4C3 –алюміній карбід |
Завдання :Уважно розгляньте видані вам картки і спробуйте провести паралель між складом (будовою сполуки) та її назвою.Яку особливість ви помітили?
Відповідь: вірно назва будь-якої записаної сполуки у таблиці залежить від складу речовини.У хімії є 4 класи сполук,у таблиці таких класів-2-оксиди та солі.Про ці сполуки у нас піде мова далі при вивченні хімічних речовин у 7 та 8 класах.Отже,за цим принципом складаються і назви бінарних сполук.Наприклад.сполуки типу ЕхОу,де символ «Е» позначається будь-який елемент. «О»-Оксиген,називають оксидами.Оксид-це сполуки,що складаються з двох елементів,один з яких є обовʹязково Оксиген.Аналогічно складаються назви інших типів бінарних сполук:до кореня латинської назви елемента.який стоїть на другому місці (який визначає тип бінарної сполуки)додається суфікс –ид чи -ід.Крім того, в назвах обовʹязково вказується валентність елемента,розташованого на першому місці,якщо вона не є постійною,тому що деякі елементи мають змінну валентність.
Завдання:Яку назву мають бінарні сполуки і чому?(див таблицю)
Завдання :Проблемне питання.Як скласти формулу бінарної сполуки за відомими валентностями?
Відповідь:Щоб скласти формулу бінарної сполуки за відомими валентностями необхідно вивчити алгоритм складання формул за валентністю:
Алгоритм складання формул за валентністю
- Уважно прочитати текст завдання
- Записати символи елементів,які входять до складу сполуки.
- зверху позначити римськими цифрами валентність.
- якщо валентності однакові,то формула вже складена.
- Якщо валентності різні,то підбираємо індекси,які зрівняють валентності.
- Для цього підбираємо найменше спільне кратне (НСК) для чисел,що позначають валентності елементів
- найменше спільне кратне(НСК)ділимо на валентність кожного елемента і отримуємо індекси.(індекси означають кількість атомів кожного елемента,що входить до складу речовини.формулу якої ми складаємо)
ІV.Керована практика(застосування знань і навичок)
Разом із класом виконуємо завдання(фронтальна робота з класом)
Завдання1.:Складіть формули бінарних сполук з Оксигеном:Натрію,Карбону (ІІ).Силіцію (ІV),Феруму (ІІІ,ІІ).Нітрогену (V).
Завдання 2.
Складіть формули сполук:Кальцій сульфіду,Ферум (ІІ) хлориду,Калій оксиду,Алюміній карбіду, хлор (VІІ) оксиду
Завдання 3 Робота в групах за таблицею валентності.
Складіть формули речовин за валентністю.
Завдання 1
|
|
O |
S(ІІ) |
|
Na |
|
|
|
Fe (ІІ) |
|
|
|
Ca |
|
|
Завдання 2
|
|
O(ІІ) |
F (І) |
|
K (І) |
|
|
|
Fe (ІІІ) |
|
|
|
Мg(ІІ) |
|
|
Завдання 3
|
|
O(ІІ) |
S(ІІ) |
|
Cu(І) |
|
|
|
Ba (ІІ) |
|
|
|
Fe (ІІ) |
|
|
Завдання 4
|
|
O (ІІ) |
S(ІІ) |
|
Al (ІІІ |
|
|
|
Fe (ІІ) |
|
|
|
Ca (ІІ) |
|
|
Завдання 5
|
|
O (ІІ) |
Br(І) |
|
Na (І) |
|
|
|
Fe (ІІ) |
|
|
|
Ca (ІІ) |
|
|
Завдання 5 Визначте.які формули складено невірно.Вірний шлях-це правильно складені формули (гра «Хрестики -нулики»)прийом «лови помилку»
|
SO2 |
CO2 |
Na2Cl |
|
LiO2 |
ZnO |
FeO |
|
NaO4 |
H2O |
P2O5 |
Завдання 6 Графічний диктант «Вірю-невірю»
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
|
+ |
+ |
+ |
+ |
- |
- |
- |
+ |
- |
+ |
+ |
1.Атом-електронейтральна частинка
2.Молекула - це електронейтральна частинка,яка складається з двох або більшої кількості атомів.
3. Речовина-це те,з чого складається фізичне тіло,усе,що має масу.
4.Назви елементів пишемо з великої літери,а назви речовин з маленької
5.Період-це вертикальний ряд елементів
6.Груп у періодичній системі 10
7.Валентність Гідрогену завжди ІІ
8.Валентність атомів хімічних елементів-це здатність атома утворювати певну кількість звʹязків з атомами інших хімічних елементів.
9.Група - це горизонтальний ряд елементів.
10.Скласти формулу речовини це значить вірно записати її склад.
11.Бінарні сполуки-це сполуки які складаються з двох елементів.
Додаткові запитання:
1.що таке валентність?
2.Які елементи мають постійну валентністьІ?ІІ? ІІІ?
3.Які сполуки називають бінарними?Які з них ви запамʹятали і чому?
4.Що таке найменше кратне,як його знайти?
V.Підсумки уроку ( бліц-інтервʹю)
Матеріал уроку сьогодні був для мене …..
Найцікавішим для мене було…..
Тепер я зможу…..
VІ. Домашнє завдання
Прочитати параграф 13 до визначення валентості за формулами бінарних сполук., відповісти на запитання.1-7 усно. Вправи №11(серед.) (11-13 (п.достатній.високий)
Додатки до уроку:
|
Картка 1
Що означають такі записи:H2; 5O2 ; O3 ; 2 H2O ; N2.Яка з цих речовин є зайвою і чому? Доведи. Скільки атомів і молекул містить друга речовина? Що таке коефіцієнт?
|
Картка 2.
Запишіть формули речовин:аш-три-пе-о-чотири; натрій–два-ес-о-чотири;пе-аш-три;кальцій-о; ен-два, о-два.Яких речовин простих чи складних,записаних тобою більше? Відповідь аргументуй..
|
Картка 3
Склади формули трьох речовин: Молекула першої речовини містить 2 атоми Нітрогену,атом Оксигену; молекула другої речовини - 2 атоми Нітрогену,3 атоми Оксигену.У якої речовини в молекулі більша кількість атомів?Відповідь аргументуй.
|
Листок навчальних досягнень уч ____ 7-А __________________________________
|
№з/п |
Зміст завдання |
Отримані результати |
|
|
1. |
Робота біля дошки |
|
|
|
2. |
Хімічна розминка |
|
|
|
3. |
Практична робота .Складання формул за моделями атомів |
|
|
|
4. |
Робота з ПСХЕ |
|
|
|
5. |
Робота з карткою-таблицею «Бінарні сполуки» |
|
|
|
6. |
Складання формул речовин за картками (5 груп) |
|
|
|
7. |
Графічний диктант |
|
|
Група 1
Завдання Робота в парах за таблицею валентності
Складіть формули речовин за валентністю.
|
|
O |
S(ІІ) |
|
Na |
|
|
|
Fe (ІІ) |
|
|
|
Ca |
|
|
Група 2
Завдання . Робота в парах за таблицею валентності.
Складіть формули речовин за валентністю.
|
|
O(ІІ) |
F (І) |
|
K (І) |
|
|
|
Fe (ІІІ) |
|
|
|
Мg(ІІ) |
|
|
Група 3
Завдання . Робота в парах за таблицею валентності.
Складіть формули речовин за валентністю
|
|
O(ІІ) |
S(ІІ) |
|
Cu(І) |
|
|
|
Ba (ІІ) |
|
|
|
Fe (ІІ) |
|
|
Група 4
Завдання . Робота в парах за таблицею валентності.
Складіть формули речовин за валентністю.
|
|
O (ІІ) |
S(ІІ) |
|
Al (ІІІ |
|
|
|
Fe (ІІ) |
|
|
|
Ca (ІІ) |
|
|
Група 5
Завдання . Робота в групах за таблицею валентності.
Складіть формули речовин за валентністю.
|
|
O (ІІ) |
Br(І) |
|
Na (І) |
|
|
|
Fe (ІІ) |
|
|
|
Ca (ІІ) |
|
|
Практикум уч___7-А класу_______________________
Завдання Графічний диктант «Вірю-невірю»
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
|
|
|
|
|
|
|
|
|
|
|
|
1.Атом-електронейтральна частинка
2.Молекула - це електронейтральна частинка,яка складається з двох або більшої кількості атомів.
3. Речовина-це те,з чого складається фізичне тіло,усе,що має масу.
4.Назви елементів пишемо з великої літери,а назви речовин з маленької
5.Період-це вертикальний ряд елементів
6.Груп у періодичній системі 10
7.Валентність Гідрогену завжди ІІ
8.Валентність атомів хімічних елементів-це здатність атома утворювати певну кількість звʹязків з атомами інших хімічних елементів.
9.Група - це горизонтальний ряд елементів.
10.Скласти формулу речовини це значить вірно записати її склад.
11.Бінарні сполуки-це сполуки які складаються з двох елементів.
Робота з карткою-таблицею «Бінарні сполуки,формули,типи та назва»
|
№з/п |
Загальна формула |
Назва типу бінарної сполуки |
Приклад |
|
1 |
ЕхОу |
Оксиди |
Na2 O-натрій оксид Fe2 O3-ферум (ІІІ) оксид |
|
2 |
ЕхSу |
Сульфіди |
K2 S-калій сульфід CaS- кальцій сульфід |
|
3 |
ЕхClу |
Хлориди |
CaCl2-кальцій хлорид CrCl3-хром (ІІІ) хлорид |
|
4 |
ЕхFу |
Флуориди |
KF- калій флуорид SF4-Сульфур (ІV)флуорид |
|
5 |
ЕхIу |
Іодиди |
MgI2-магній йодид FeI3-ферум (ІІІ)йодид |
|
6 |
ЕхBrу |
Броміди |
LiBr-літій бромід CuBr2-купрум (ІІ)бромід |
|
7 |
ЕхРу |
Фосфіди |
AlP-алюміній фосфід Ca3P2-кальцій фосфід |
|
8 |
ЕхCу |
Карбіди |
Al4C3 –алюміній карбід |
Картка для фронтальної роботи з класом.Заповніть таблицю відповідно до свого завдання
|
І |
ІІ |
ІІІ |
IV |
V |
VI |
VII |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Картка №1
Виберіть з переліку Cr2O3, K2O, FeO, Fe2O3, As2O5, Cl2O7, CrO3, Li2O, HgO, SiO2, P2O5, SO3, PbO2, Mn2O7 сполуки Оксигену з атомами хімічних елементів з валентністю II:
Картка №2
Виберіть з переліку Cr2O3, K2O, FeO, Fe2O3, As2O5, Cl2O7, CrO3, Li2O, HgO, SiO2, P2O5, SO3, PbO2, Mn2O7.сполуки Оксигену з атомами хімічних елементів з валентністю IIІ:
Картка №3
Виберіть з перелік Cr2O3, K2O, FeO, Fe2O3, As2O5, Cl2O7, CrO3, Li2O, HgO, SiO2, P2O5, SO3, PbO2, Mn2O7.у сполуки Оксигену з атомами хімічних елементів з валентністю IV
Картка №4
Виберіть з переліку Cr2O3, K2O, FeO, Fe2O3, As2O5, Cl2O7, CrO3, Li2O, HgO, SiO2, P2O5, SO3, PbO2, Mn2O7.сполуки Оксигену з атомами хімічних елементів з валентністю V
Картка №5
Виберіть з переліку Cr2O3, K2O, FeO, Fe2O3, As2O5, Cl2O7, CrO3, Li2O, HgO, SiO2, P2O5, SO3, PbO2, Mn2O7.сполуки Оксигену з атомами хімічних елементів з валентністю I:
Картка №6
Виберіть з переліку Cr2O3, K2O, FeO, Fe2O3, As2O5, Cl2O7, CrO3, Li2O, HgO, SiO2, P2O5, SO3, PbO2, Mn2O7. сполуки Оксигену з атомами хімічних елементів з валентністю VI:
Картка №7
Виберіть з переліку Cr2O3, K2O, FeO, Fe2O3, As2O5, Cl2O7, CrO3, Li2O, HgO, SiO2, P2O5, SO3, PbO2, Mn2O7 сполуки Оксигену з атомами хімічних елементів з валентністю VII :
Основні поняття та терміни:
Хімічна формула;
Види формул (молекулярна,
структурна);
Валентність хімічних елементів;
НСК
Девіз уроку:
Запитуй!
Сперечайся!
Думай!
Аналізуй!
Висновком мудрим
думку хвилюй!
«Хімічні формули говорять хімікові цілу історію речовини»
Д.І.Менделєєв
Урок 13
Тема. Складання формул бінарних сполук за валентністю атомів елементів. Визначення валентності за формулами бінарних сполук
Цілі: продовжити формування вмінь на підставі знань валентності складати хімічні формули бінарних сполук і за формулами визначати валентності атомів хімічних елементів; узагальнити й поглибити знання про зміст хімічної формули, склад простих і складних речовин; підготувати учнів до тематичного оцінювання зі знання хімічних формул.
Тип уроку: поглиблення і систематизації знань.
Форми роботи: фронтальна бесіда, самостійна робота з опорною схемою, лабораторний експеримент.
Обладнання: періодична система хімічних елементів.
II. Перевірка домашнього завдання (у формі переклику)
ІІІ. Засвоєння і закріплення знань
1. На дошці заздалегідь написані формули сполук. По ланцюжку учні виходять до дошки й визначають валентності атомів:
|
CaCl2 |
якщо Хлор одновалентний
|
Li2S |
якщо Сульфур двовалентний
|
|
AlCl3 |
BaS |
||
|
KCl |
PbS2 |
||
|
PCl5 |
Аl2O3 |
||
|
SiCl4 |
CS2 |
||
|
Na2O |
якщо Оксиген двовалентний
|
Na3N |
якщо Нітроген тривалентний
|
|
MgO |
Zn3N2 |
||
|
Cr2O3 |
C3N4 |
||
|
SiO2 |
CrN |
||
|
As2O5 |
Mg3N2 |
2. Об’єднуємося в групи по три-чотири учні.
Завдання: вибрати в періодичній системі три атоми, для яких валентність у сполуці з Оксигеном дорівнює: група 1 — I; група 2 — II; група 3 — III; група 4 — IV.
Представник групи зачитує свій варіант відповіді. Наступна група виправляє, доповнює і коментує відповідь попередньої групи.
IV. Поглиблення і систематизація знань
1) Ми можемо скласти формулу сполуки, якщо ми знаємо валентність?
2) Яким правилом ми повинні скористатися, складаючи хімічну формулу?
(Сума одиниць валентності атомів одного елемента дорівнює сумі одиниць валентності атомів іншого елемента в бінарній сполуці)
3) Як можна зрівняти одиниці валентності елемента?
(Змінити відповідно кількість атомів у молекулі)
У цьому випадку сума одиниць валентності — це найменше спільне кратне валентності елемента та кількості цих атомів.
Спробуємо використовувати ці положення на прикладі:
![]()
НСК — 6; додатковий множник для Al — 2, додатковий множник для О — 3.
4) Групи одержують картки-завдання. Потрібно скласти формули бінарних сполук за відомими валентностями:
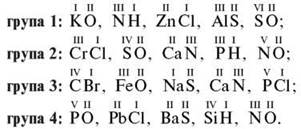
Групи під керівництвом учителя обговорюють, виконують завдання, записують відповіді на дошці, коригують їх.
5) Хімічні формули — «хімічні слова» — складаються не довільно, а в суворій відповідності до правил. Зміст хімічної формули значно глибший, ніж тільки якісний і кількісний склад.
Хімічна формула показує, як саме атоми хімічних елементів пов’язані між собою, в якому співвідношенні. Частково відповісти на це питання допомагає поняття валентності.
Ще раз пригадаємо:
1) Як можна визначити валентність атома?
2) Як скласти хімічну формулу, знаю
2) Як скласти хімічну формулу, знаючи валентність атома?
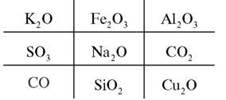
V. «Хрестики-нулики»
Виграшний шлях: одновалентні метали.
Виграшний шлях: тривалентні метали.
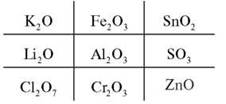
Експрес-опитування (письмово за варіантами)
Варіант І
1. У періодичній системі групи — це:
а) вертикальні стовпці;
б) діагоналі;
в) горизонтальні ряди.
2. Хімічний символ Фосфору:
а) Si;
б) H;
в) S;
г) P.
3. Відносна атомна маса Карбону:
а) 16;
б) 8;
в) 12;
г) 6.
4. У формулі H2 цифра 2 називається:
а) індекс;
б) коефіцієнт;
в) множник.
5. Формули простих речовин:
а) NaCl;
б) Cu;
в) O2;
г) CO2
6. До елементів-металів належать:
а) Cu;
б) Na;
в) Br;
г) C.
7. Валентність Оксигену в сполуках:
а) I;
б) II;
в) III.
8. Валентність атома металу дорівнює ііі у сполуці:
а) MnO2;
б) Mn2O7;
в) Mn2O3;
г) МnО.
9. Валентність Нітрогену в сполуці N2O дорівнює:
а) IV;
б) III;
в) II;
г) I.
10. Складіть формулу сполуки за валентністю: Mg(II) N(III)
Варіант ІІ
1. У періодичній системі періоди — це:
а) вертикальні стовпці;
б) діагоналі;
в) горизонтальні ряди.
2. Хімічний символ Сульфуру:
а) Si;
б) H;
в) S;
г) P.
3. Відносна атомна маса Оксигену:
а) 16;
б) 8;
в) 12;
г) 6.
4. У записі 2O3 цифра 2 називається:
а) індекс;
б) коефіцієнт;
в) множник.
5. Формули складних речовин:
а) NaCl;
б) Cu;
в) O2;
г) CO2.
6. До елементів-неметалів належать:
а) Cu;
б) Na;
в) Br;
г) C.
7. Валентність Гідрогену в сполуках:
а) I;
б) II;
в) III.
8. Валентність атома металу дорівнює IV у сполуці:
а) MnO2;
б) Mn2O7;
в) Mn2O3;
г) МnО.
9. Валентність Нітрогену в сполуці N2O3 дорівнює:
а) IV;
б) III;
в) II;
г) I.
10. Складіть формулу сполуки за валентністю: As(V) O(II)
Перевіряємо відповіді за ключем і виставляємо оцінки за урок.
VI. Домашнє завдання
Прочитати параграф, відповісти на запитання, повторити вивчений матеріал і підготуватися до проміжного оцінювання.
П одержують картку з номером валентності.
• Виберіть з переліку сполуки Оксигену з атомами хімічних елементів з валентністю:
пара 1 — II;
пара 2 — III;
пара 3 — IV;
пара 4 — V;
пара 5 — I;
пара 6 — VI;
пара 7 — VII.
Список сполук у всіх однаковий:
Cr2O3, K2O, FeO, Fe2O3, As2O5, Cl2O7, CrO3, Li2O, HgO, SiO2, P2O5, SO3, PbO2, Mn2O7.
Представник пари, яка швидше за інших виконала завдання, виписує формули своєї групи на дошці під відповідним номером валентності:
|
І |
ІІ |
ІІІ |
IV |
V |
VI |
VII |
|
Li2O |
FeO |
Cr2O |
SiO2 |
As2O5 |
SO3 |
Cl2O7 |
|
K2O |
HgO |
Fe2O3 |
PbO2 |
P2O5 |
CrO3 |
Mn2O7 |
Разом із класом коригуємо відповіді на дошці
Додаткові запитання:
1.що таке валентність?
2.Які елементи мають постійну валентністьІ?ІІ? ІІІ?
3.Які сполуки називають бінарними?Які з них ви запамятали і чому?
4.Що таке найменше кратне,як його знайти?
V.Підсумки уроку
VІ. Домашнє завдання
Прочитати параграф, відповісти на запитання. Визначити валентність атомів у сполуках:
SnO2, BeO, AsH3, MnO2, H2Se, Cu2O.
|
І |
ІІ |
ІІІ |
IV |
V |
VI |
VII |
|
Li2O
|
FeO |
Cr2O |
SiO2 |
As2O5 |
SO3 |
Cl2O7 |
|
K2O |
HgO |
Fe2O3 |
PbO2 |
P2O5 |
CrO3 |
Mn2O7 |
Картка №1
Виберіть з переліку Cr2O3, K2O, FeO, Fe2O3, As2O5, Cl2O7, CrO3, Li2O, HgO, SiO2, P2O5, SO3, PbO2, Mn2O7 сполуки Оксигену з атомами хімічних елементів з валентністю II:
Картка №2
Виберіть з переліку Cr2O3, K2O, FeO, Fe2O3, As2O5, Cl2O7, CrO3, Li2O, HgO, SiO2, P2O5, SO3, PbO2, Mn2O7.сполуки Оксигену з атомами хімічних елементів з валентністю IIІ:
Картка №3
Виберіть з перелік Cr2O3, K2O, FeO, Fe2O3, As2O5, Cl2O7, CrO3, Li2O, HgO, SiO2, P2O5, SO3, PbO2, Mn2O7.у сполуки Оксигену з атомами хімічних елементів з валентністю IV
Картка №4
Виберіть з переліку Cr2O3, K2O, FeO, Fe2O3, As2O5, Cl2O7, CrO3, Li2O, HgO, SiO2, P2O5, SO3, PbO2, Mn2O7.сполуки Оксигену з атомами хімічних елементів з валентністю V
Картка №5
Виберіть з переліку Cr2O3, K2O, FeO, Fe2O3, As2O5, Cl2O7, CrO3, Li2O, HgO, SiO2, P2O5, SO3, PbO2, Mn2O7.сполуки Оксигену з атомами хімічних елементів з валентністю I:
Картка №6
Виберіть з переліку Cr2O3, K2O, FeO, Fe2O3, As2O5, Cl2O7, CrO3, Li2O, HgO, SiO2, P2O5, SO3, PbO2, Mn2O7. сполуки Оксигену з атомами хімічних елементів з валентністю VI:
Картка №7
Виберіть з переліку Cr2O3, K2O, FeO, Fe2O3, As2O5, Cl2O7, CrO3, Li2O, HgO, SiO2, P2O5, SO3, PbO2, Mn2O7 сполуки Оксигену з атомами хімічних елементів з валентністю VII :

про публікацію авторської розробки
Додати розробку
