Валентність хімічних елементів. Визначення валентності елементів за формулами бінарних сполук.
Урок з хімії 7 клас
Тема. Валентність хімічних елементів. Визначення валентності елементів за формулами бінарних сполук.
Мета: сформувати поняття про валентність хімічних елементів; навчити визначати валентність елементів за формулами бінарних сполук; розвивати вміння встановлювати причинно-наслідкові зв’язки між місцем знаходження елементів у Періодичній системі хімічних елементів та їх валентностями; виховувати любов до праці шляхом залучення всіх учнів до навчальної діяльності;
формувати міжпредметні, комунікативні і здоров’язбережувальні компетентності.
Форми роботи: бесіда, демонстрація, робота в групі.
Обладнання та матеріали: Періодична система хімічних елементів Д.І.Менде лєєва, алгоритм визначення валентності в бінарних сполуках.
Тип уроку: засвоєння нових знань.
Хід уроку
І. Організаційна частина
ІІ. Актуалізація опорних знань
Робота в парі
Із наведеного переліку випишіть окремо формули простих і складних речовин: H2, Fe2O3, H2O, Al, BaCO3, Cl2, O2, CO2, Cu, H3PO4, NaCl, O3.
Бесіда
- Які речовини називають простими?
- Які речовини називають складними?
- Охарактеризуйте якісний і кількісний склад речовин: Н2O, NH3, CH4.
- Наведіть приклади складних речовин та сумішей.
ІІІ. Мотивація навчальної діяльності
Більше трьох сотень років тому вчені встановили, що атоми з'єднуються в молекули за допомогою особливих зв'язків, що мають назву хімічних. Спершу атоми уявляли у вигляді кульок, на поверхні яких є «гачки», за їх допомогою атоми поєднуються один з одним, як ланки одного ланцюга. Тільки на початку
XX ст. була встановлена істинна природа хімічного зв'язку.
Одна з основних властивостей атома — це здатність утворювати хімічні зв'язки. Атоми різних елементів можуть утворювати певне число зв'язків, притаманне лише їм. Число хімічних зв'язків, що утворюють атоми даного елемента, називають валентністю.
ІV. Вивчення нового матеріалу
Етап засвоєння нових знань
Поняття про валентність
Валентність — це властивість атомів хімічного елемента приєднувати певну кількість атомів інших хімічних елементів. Атоми різних елементів можуть утворювати певну кількість зв’язків. Валентність чисельно визначають за тим, скільки атомів інших елементів приєднує атом даного елемента.
Атоми Гідрогену не можуть приєднати більше одного атома іншого хімічного елемента, тому валентність Гідрогену прийнято за 1. Валентність інших атомів можна виразити числом, яке показує, скільки атомів Гідрогену може приєднати до себе атом цього елемента. Наприклад, у молекулі гідроген хлориду (HCl) атом Хлору приєднує один атом Гідрогену, отже, Хлор є одновалентним. Валентність Оксигену — 2, оскільки його атом приєднує два атоми Гідрогену. Нітроген у молекулі амоніаку (NH3) є тривалентним, а Карбон у молекулі метану (CH4) — чотиривалентним.
Числове значення валентності традиційно позначають римськими цифрами, які записують над символами хімічних елементів.
Валентність елементів можна розраховувати також за Оксигеном, який зазвичай є двовалентним. Наприклад, Меркурій у сполуці HgO є двовалентним, оскільки на один атом Оксигену припадає один атом Меркурію.
Деякі елементи мають сталу валентність у будь-яких сполуках. Інші можуть виявляти різні валентності в різних сполуках; це елементи зі змінною валентністю.
Валентність деяких елементів у хімічних сполуках
|
Валентність |
Хімічні елементи |
|
І ІІ ІІІ |
Стала валентність H, Na, K, Li; O, Be, Mg, Ca, Ba, Zn; Al, B |
|
І і ІІ ІІ і ІІІ ІІ і ІV ІІІ і V ІІ, ІІІ і VІ ІІ, ІV і VІ |
Cu; Fe, Co, Ni; Sn, Pb; P; Cr; S |
Робота з таблицею
Учитель пропонує учням розглянути таблицю й назвати елементи, що проявляють сталу й змінну валентність.
Завдання для учнів: використовуючи таблицю валентностей, скласти формули можливих оксидів Алюмінію, Феруму, Сульфуру, Фософру.
Демонстрація кулестрижневих молекул води, сірководню, амоніаку, хлороводню, метану. Учні визначають кількість зв’язків, які утворює атом Гідрогену, визначають яку валентність виявляють атоми.
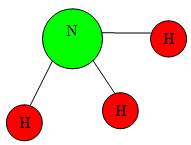
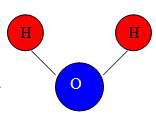
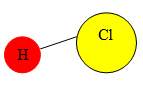
Валентність елементів можна визначати за допомогою Періодичної системи елементів. Номер групи, в якій міститься елемент показує максимальну валентність елемента. Майже всі елементи I, II, III груп ПС проявляють сталу валентність. Оксиген (VI група) виявляє тільки валентність II. Для позначення валентності використовують римські цифри.
V. Визначення валентності елементів за формулами бінарних сполук
Бінарними називають сполуки, які складаються з двох хімічних елементів.
Правило визначення валентності: число одиниць валентностей всіх атомів одного елемента дорівнює числу одиниць валентності всіх атомів іншого елемента.
Учні під керівництвом учителя складають алгоритм визначення валентності.
Алгоритм визначення валентності
|
Послідовність дій |
Приклади |
|
|
1. Запишіть формулу речовини |
H2S, Cu2O |
|
|
2. Позначте відому валентність елемента |
|
|
|
3. Визначте й запишіть загальну кількість одиниць валентності (найменше спільне кратне — НСК) атомів відомого елемента, помноживши валентність елемента на кількість його атомів |
|
|
|
|
|
|
|
4. Поділіть число одиниць валентності атомів на кількість атомів іншого елемента (тобто на його індекс). Отримана відповідь — це якраз і є шукана валентність |
|
|
|
5. Здійсніть перевірку, тобто підрахуйте число одиниць валентностей кожного елемента |
|
|
Способи визначення валентності за Періодичною системою
Визначати валентність можна за таблицею Д. І. Менделєєва. Ви вже знаєте, що структурними одиницями в Періодичній системі є періоди та групи. Усі групи в таблиці Д. І. Менделєєва поділено на підгрупи — А та Б.
Активні метали займають тільки три перші групи. Метали, які розташовані в І А-групі, мають валентність I. Метали, розташовані в ІІ А-групі мають валентність II.
Є метали зі змінною валентністю. У такому разі її вказують у дужках після назви або символьного позначення елемента, наприклад Ферум(III). Це вказує нам на те, що Ферум — тривалентний у даній сполуці.
Неметали мають дві валентності й більше (тоді її вказано в дужках): нижчу — обчислюють за формулою (8 – № групи), у якій перебуває елемент, і вищу — дорівнює номеру групи, у якій знаходиться цей елемент. Наприклад, Нітроген знаходиться в V групі Періодичної системи, отже, його найнижча валентність 8 – 5 = 3.
Усі можливі валентності можна з’ясувати за Періодичною таблицею, для цього необхідно від максимальної валентності віднімати числа, кратні 2. Наприклад, Сульфур міститься в VІ групі, відповідно його максимальна валентність дорівнює 6; віднімаючи двічі 2, отримуємо можливі валентності Сульфуру — ІV, ІІ.
VІ. Узагальнення і системактизація знань
Прийом «Тренажер».
Учні ланцюжком виходять до дошки.
Завдання: визначте валентність елементів у сполуках:
SiH4, CrO3, H2S, CO2, CO, SO3, SO2, Fe2O3, FeO, HCl, HBr, Cl2O5, Cl2O7, РН3, K2O, Al2O3, P2O5, NO2, N2O5, Cr2O3, SiO2, B2O3, SiH4, Mn2O7, MnO, CuO, N2O3.
Прийом «Лови помилку!».
Завдання: укажіть, у якому випадку валентність визначено неправильно, виправте помилки:
![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() .
.
Гра «Хрестики-нулики»
Виграшний шлях: одновалентні метали.
|
K2O
|
Fe2O3 |
AI2O3 |
|
SO3
|
Na2O |
CO2 |
|
CO
|
SiO2 |
Cu2O |
Виграшний шлях: тривалентні метали.
|
Сr2O3
|
Fe2O3 |
AI2O3 |
|
SO3
|
Na2O |
CO2 |
|
CO
|
SiO2 |
Cu2O |
Робота у групі.
Визначення валентності хімічних елементів за формулами бінарних сполук.
- Cu2O, CuO, FeO, Fe2O3
- P2O5, PH3, PbO, PbO2
- MnO, MnO2, Mn2O7, H2S
- CrO, Cr2O3, CrO3, SO2
- HCl, Cl2O5, Cl2O7, SO3
- N2O, NO, NO2, NH3
- CO, CO2, Hg2O, HgO
Тестування
1. Виберіть символи елементів, які виявляють сталу валентність:
а) О; б) Р; в) Mn; г) H; д) К.
2. Вкажіть в якому випадку валентність елементів визначена вірно:
I II ІІ І
а) Na2 O б) Na2 O
3. Визначіть відповідність елемента в сполуках з Оксигеном та його валентності:
1. CrO3 а) І
2. K2O б) ІІ
3. SO2 в) ІІІ
4. MgO г) ІV
д) VI
4. Вкажіть сполуку у якій валентність елемента, сполученого з Оксигеном, найвища:
а) Н2О; б) СаО; в) РbO2; г) CrO3; д) Br2O7
5. В якій із сполук валентність елемента, сполученого з Гідрогеном, найнижча:
а) Н2О; б) NH3; в) НI; г) SiH4
VII. Домашнє завдання, інструктаж щодо його виконання
6.1. Завдання для всього класу.
Підручник
Збірник завдань
VIII. Підбиття підсумків уроку
Учитель просить учнів відповісти на запитання:
— Що сьогодні відбувалося на уроці?
— Які знання й враження залишаться у вас після цього уроку?
— Які вміння ви сьогодні розвинули?
— Що нового ви дізналися?


про публікацію авторської розробки
Додати розробку
