Виховний захід с хімії . Урок . Початкові хімічні поняття.
Навчальний предмет: хімія, 7 клас
Виховний захід: Брейн-ринг з хімії на тему «Початкові хімічні поняття»
Мета: Закріпити та поглибити знання учнів, розширити кругозір про історію, застосування а також різні цікаві факти про початкові хімічні поняття, сприяти розвиткові логічного мислення учнів та вміння висловлювати свою думку.
Методи та методичні прийоми: Словесні (бесіда, розповідь, пояснення), практичні (спостереження, аналіз, висновки), наочні (періодична система хімічних елементів Д. І. Менделєєва, дидактичні картки).
Обладнання: мультимедійна презентація, періодична система хімічних елементів Д. І. Менделєєва.
Структура гри:
I. Організація класу
II. Узагальнення і систематизація знань, умінь і навичок
Конкурс 1 «Відділ хімічної безпеки»
Конкурс 2 «Дослідницький відділ»
Конкурс 3 «Теоретичний відділ»
Конкурс 4 «Математичний відділ»
III. Підведення підсумків
Хід проведення
(СЛАЙД 1)
Правила гри
Вступне слово вчителя
Учні класу об’єднуються у дві команди однакових за інтелектуальним рівнем розвитку для спільної роботи, кожна команда обирає капітана.
Сьогодні ми закріпимо знання з хімії у формі брейн-рингу на тему «Початкові хімічні поняття».
Команда, яка збере найбільшу кількість балів, стане переможцем гри.
Наприкінці змаганя ми проведемо підрахунки.
Кожна правильна відповідь – 1 бал.
Під час гри в класі панує повна тиша. За порушення дисципліни знімається 1 бал з рахунку відповідної команди
Якщо команда відповідає з помилками, то вчитель надає змогу відповісти іншій команді й отримати бал або пів бала. Якщо вірної відповіді немає, відповідає ведучий.
Переможці нагороджуються високими балами та дипломом переможця.
(СЛАЙД 2)
Конкурс 1 «Відділ хімічної безпеки»
Необхідно дати відповідь на тестові запитання.
1. Під час нагрівання рідини отвір пробірки має бути
А. повернутим управо
Б. повернутим уліво
В. напрямленим від себе у бік, де немає людей
Г. напрямленим до себе
(СЛАЙД 3)
2. Під час проведення дослідів з рідинами пробірка має бути наповненою
А. на 1 /2
Б. на 1 /3
В. на 1 /4
Г. не має значення, на скільки
(СЛАЙД 4)
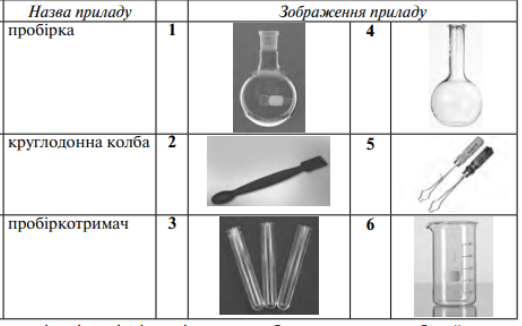
3. Установіть відповідність між назвою приладу та його зображенням.
Пробірка – 3
Круглодонна колба – 1
Пробіркотримач – 5
(СЛАЙД 5)
Склад речовин
4. Установіть відповідність між властивостями речовини і прикладами цих властивостей.
Властивості
А. хімічні – 2, 3, 5, 7, 8
Б. фізичні – 1, 4, 6
Приклади властивостей
1 здатність металів проводити теплоту
2 здатність паперу горіти
3 здатність заліза іржавіти
4 здатність води утворювати лід
5 здатність молока скисати
6 здатність цукру розчинятися у воді
7 здатність цукру утворювати карамель під час нагрівання
8 здатність крохмалю утворювати клейстер
(СЛАЙД 6)
Склад речовин
5. Установіть відповідність між фізичними тілами, речовинами і їхніми прикладами.
Об’єкти
А. фізичні тіла – 2, 3, 5, 8
Б. речовини – 1, 4, 6, 7
Приклади об'єктів
1 залізо
2 цегла
3 залізний цвях
4 золото
5 камінь
6 кисень
7 крохмаль
8 глиняна тарілка
(СЛАЙД 7)
Конкурс 2 «Дослідницький відділ»
6. Установіть відповідність між способом дослідження, що його необхідно застосувати під час певних досліджень, і прикладом такого дослідження.
Спосіб дослідження
А. спостереження – 2, 5
Б. експеримент – 1, 3, 4
Приклади дослідження
1 нагрівання суміші для вивчення властивостей її компонентів
2 життя комах у природних умовах
3 поведінка тварин у разі подразнення
4 зміна яскравості полум’я залежно від речовини, що спалюється
5 вивчення зміни клімату місцевості
(СЛАЙД 8)
7. Установіть відповідність між видом та прикладом суміші.
Однорідна – 1, 4, 5
Неоднорідна – 2, 3, 6

(СЛАЙД 9)
Конкурс 3 «Теоретичний відділ»
- Атом — найменша хімічно неподільна електронейтральна частинка речовини, що складається з позитивно зарядженого ядра та негативно заряджених електронів, які оточують ядро
- Ядро атома містить позитивно заряджені протони і нейтральні частинки — нейтрони.
- Порядковий номер елемента чисельно дорівнює заряду ядра його атома.
- Відносна атомна маса чисельно дорівнює сумі протонів і електронів у атомі.
- Кожен хімічний елемент має власну назву і позначається певним символом — однією першою або двома літерами за його латинською назвою. Назва хімічного елемента пишеться з великої літери.
(СЛАЙД 10)
Теоретичний відділ
- Маса атома в хімії виражається через відносну атомну масу (Ar ) та атомну одиницю маси (а. о. м.).
- Відносна атомна маса — відношення маси атома даного елемента до 1 /12 маси атома Карбону-12.
- Відносна атомна маса чисельно дорівнює сумі протонів і нейтронів у ядрі атома.
- Хімічний елемент — вид атомів з однаковим зарядом ядра, тобто з однаковим числом протонів у ядрі.
(СЛАЙД 11)
Теоретичний відділ
8. Поясніть, що означає запис:
а) Ar (C) = 12; б) Ar (Na) = 23; в) Ar (Al) = 27; г) Ar (H) = 1.
а) Відносна атомна маса Карбону дорівнює 12;
б) Відносна атомна маса Натрію дорівнює 23;
в) Відносна атомна маса Алюмінію дорівнює 27;
г) Відносна атомна маса Гідрогену дорівнює 1.
9. Назвіть елементи, відносна атомна маса яких становить:
а) 35,5; б) 40; в) 24; г) 56; д) 32.
а) Хлор; б) Кальцій; в) Магній; г) Сульфур.
10. Укажіть пропущені слова.
«Атомна маса — це … [фізична; хімічна] величина, яка дорівнює сумі мас… [протонів й електронів; протонів і нейтронів; нейтронів й електронів]. …[Атомна; відносна атомна] маса показує, у скільки разів … [маса; розмір] атома елемента … [більша; менша] за … [масу; розмір] атома Карбону-12».
(СЛАЙД 12)
Теоретичний відділ

- Кожна речовина позначається формулою. Формула речовини — умовне позначення її складу.
(СЛАЙД 13)
Теоретичний відділ
11. Укажіть пропущені слова.
Хімічна формула — це … [безумовний; умовний] запис … [агрегатного стану; зовнішнього вигляду; складу] … [атома; молекули; речовини] за допомогою … [фізичних формул; хімічних знаків; цифр; літер] і … [фізичних формул; індексів; літер]. Хімічна формула виражає … [якісний; сталий; змінний] й … [сталий; змінний; кількісний] склад речовини.
(СЛАЙД 14,15)
Теоретичний відділ
- Періодична система — впорядковане за зростанням порядкового номера розташування елементів у вигляді таблиці. Вона є класифікацією хімічних елементів за їх будовою і хімічними властивостями, розробленою на основі Періодичного закону.
- Періодична система складається з періодів і груп.
- Період — це горизонтальний ряд хімічних елементів.
- Група — це вертикальний стовпчик хімічних елементів.
- У клітинці Періодичної системи розміщено символ хімічного елемента, указано його порядковий номер і відносну атомну масу.
- Порядковий номер хімічного елемента чисельно дорівнює кількості протонів і електронів у його атомі.
(СЛАЙД 16)
Теоретичний відділ
12. Розташуйте елементи в порядку зростання їх порядкового номера.
Sn
Pb
Ge
C
C – Ge – Sn – Pb
13. Розташуйте елементи в порядку зменшення їх порядкового номера.
S
H
B
Na
H – B – Na – S
(СЛАЙД 17)
Конкурс 4 «Математичний відділ»
- Валентність — це здатність атомів утворювати хімічний зв’язок лише с певною кількістю інших атомів.
(СЛАЙД 18)
Математичний відділ
14. Запишіть формули сполук за їх будовою і визначте валентність атомів елементів, що входять до складу цих сполук:
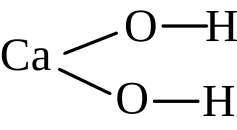
Ca(OH)2: Ca (II), O (II), H (I)
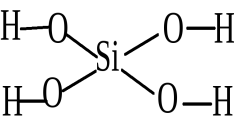
H4SiO4: H (I), O (II), Si (IV)
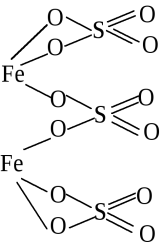
Fe2(SO4)3: Fe (III), O (II), S (IV)
(СЛАЙД 19)
Математичний відділ
- Відносна молекулярна маса дорівнює сумі відносних атомних мас усіх атомів, що містять ся в молекулі. Для речовин немолекулярної (атомної або йонної) будови існує поняття формульної маси, яка чисельно дорівнює відносній молекулярній масі і позначається так само Mr .
- Відносна молекулярна маса, так само як і відносна атомна маса, одиниць вимірювання не має.
- Масова частка елемента в складній речовині — це відношення маси, що припадає на елемент, до маси всіх складників речовини.
- Обчислюється за формулою: W(E) = Ar * n / Mr
- де W(E) — масова частка елемента; Ar — відносна атомна маса елемента; n — кількість атомів елемента у формулі (індекс елемента); Mr — відносна атомна маса речовини.
- Знаючи масові частки елементів, можна визначити найпростішу формулу (співвідношення атомів) її молекули.
(СЛАЙД 20)
Математичний відділ
15. Бертолетову сіль використовують у піротехніці. Знайдіть у довідниках формулу бертолетової солі й обчисліть масові частки елементів у її складі.
KCLO3 (Mr = 122.5)
W (K) = 31,8 %
W (Cl) = 28,9 %
W (O) = 39,3 %
(СЛАЙД 21)
Підведення підсумків гри.
Капітани команд підраховують бали. Вчитель оголошує переможців, команда-переможець нагороджується дипломом.


про публікацію авторської розробки
Додати розробку
