Вплив pH на напрям і швидкість хімічних і біохімічних процесів
Робота
Вплив pH на напрям і швидкість хімічних і біохімічних процесів.
Роботу виконала:
Цимбаленко Олена Максимівна,
учитель хімії
Білозерської загальноосвітньої
школи І-ІІІ ступенів №18
Білозерської міської ради,
спеціаліст вищої кваліфікаційної
категорії, учитель-методист.
Білозерське
2022
Тези
Науково-дослідницької роботи «Вплив pH на напрям і швидкість хімічних і біохімічних процесів».
Автор: Цимбаленко Олена Максимівна, учитель хімії
Білозерської загальноосвітньої школи І-ІІІ ступенів №18 Добропільської міської ради, спеціаліст вищої кваліфікаційної категорії, учитель-методист.
pH, водневий показник — величина, що показує міру активності іонів водню (Н+) в розчині, тобто ступінь кислотності або лужності цього розчину. Для розведених розчинів можна користуватись терміном «концентрація» замість «активність» у цьому визначенні. pH нейтрального розчину становить 7, розчини із більшим значенням водневого показника є лужними, із
меншими — кислими.
Це поняття було введено в 1909 датським хіміком Серенсеном. Показник називається pH, за першими літерами латинських слів potentia hydrogeni - сила водню.
Кислотно - основні властивості мають велике значення практично у всіх областях народного господарства. Від кислотності або основності води дуже сильно залежить розкладання хімічних забруднювачів в стічних водах, швидкість корозії металевих предметів, що знаходяться у воді, а також придатність водного середовища до проживання в ній риб і рослин.
Майже всі хімічні реакції, що відбуваються в живих клітинах, суттєво залежать від pH. Навіть невелика зміна кислотності може призвести до сильно виражених змін в цих процесах. Визначення водневого показника крові є рутинною процедурою в клінічній діагностиці. У нормі pH плазми крові становить 7,4, зниження цього показника називається ацидозом і може спостерігатись, наприклад, при важких формах цукрового діабету. Під час інших захворювань кров може, навпаки, ставати надто лужною, такий стан називається алкалозом.
Метою роботи є дослідження впливу pH на напрям і швидкість хімічних і біохімічних процесів, життя та здоров’я людини.
Актуальність теми. Актуальність досліджуваної теми зумовлена важливістю pH розчинів для здоров’я і життя людини. Визначення концентрації водневих іонів має дуже велике значення в різних галузях хімії, технології, грунтознавства, геології, біохімії, медицини та інших наук.
Як свідчать дослідження, мало хто з громадян обізнаний про кислотно-лужний баланс організму і його важливість не лише для здоров’я, а навіть і для життя. Тіло людини має певне кислотно-лужне співвідношення, що характеризується рН (водневий показник). Чим нижче рівень рН — тим середовище більш кисле (від 6.9 до 0), лужна ж середа має високий рівень рН (від 7.1 до 14). Тіло людини на 70% складається з води, тому вода — одна з найбільш важливих його складових. Тканини живого організму вельми чутливі до коливань показника pH. За межами певного діапазону (7.37-7.44) відбувається денатурація білків: руйнуються клітини, ферменти втрачають здатність виконувати свої функції, внаслідок чого можлива навіть загибель організму. Коли pH крові знижується, тіло починає накопичувати кислі речовини (зазвичай токсини) у клітинах, використовуючи клітини немов сміттєві баки, щоб врятувати кров від закислення. Клітини організму стають більш кислими і токсичними, що призводить до зменшення їх рівня кисню та пошкоджує їх ДНК.
Американські вчені зробили справжнє відкриття, коли виявили, що у будь-якого продукту, який ми вживаємо всередину, є фундаментальний показник, що має критичне значення для нашого життя. Це кислотне навантаження або кислотність їжі. Кислотне навантаження виражається співвідношенням в раціоні харчових компонентів, що в процесі переробки організмом утворюють кислоту або луг. Навіть визначення “кислотне навантаження” (на організм) говорить саме за себе. Більшість продуктів, що їх вживає в їжу середньостатистичний українець, підсилюють кислотне навантаження на організм. А зниження рівня рН в організмі в результаті “кислотного” харчування призводить до зниження імунітету і появи більш 200 захворювань, включаючи цукровий діабет, далекозорість та катаракту, хондроз і артроз, жовчно-та сечокам’яну хвороби, і навіть онкологічні захворювання. Якщо у людини почало проявлятися кілька захворювань одночасно — в наявності явне падіння рН крові і організму в цілому.
Отто Варбург ще в 1931 році отримав Нобелівську премію з фізіології та медицини за визначення умов життя злоякісних пухлин. Клітини пухлин (а також бактерії і патогенні мікроорганізми) чудово розвиваються при закисленні крові, тобто при падінні рН нижче 7.2-7.3 одиниць. При нормалізації рН пухлини спочатку припиняли ріст, а потім розсмоктувалися!
Якщо рН крові в нормі, чужорідні бактерії і мікроорганізми просто не мають сприятливих умов для розмноження, оскільки всі клітини можуть жити і розмножуватися лише в діапазоні рН між 6.5 і 7.5. Здорові клітини мають рН 7.35, в той час як ракова клітина має більш кисле середовище. Тому коли рН злоякісної клітини піднімається вище 7.5 — вона починає вмирати, а якщо pH підвищується до рівня 8.0 — ракова клітина гине протягом декількох годин.
Техногенне забруднення довкілля суттєво впливає не лише на склад атмосферного повітря, але й на процеси кругообігу енергії і речовин у природі. Зокрема, зміна хімічного складу повітря внаслідок діяльності людини та процеси кругообігу води в природі спричиняють виникнення феномена "кислотних дощів". Це явище було відкрито понад сто років тому назад А. Смітом. який виявив залежність між рівнем забруднення атмосферного повітря й кількістю опадів. Незабруднені опади самі собою мають кислу реакцію (рН = 5,5-6,0). Значне забруднення атмосфери сірчистим ангідридом, окислами азоту, сполуками хлору й фтору призводить до більшої кислотності. Збільшення вмісту кислих іонів і постійне вимивання лужних катіонів призводить до того, що буферна система рослин руйнується і кислотність ґрунтів збільшується. При рН = 4,5 гинуть всі риби, земноводні, комахи, а на дні розвиваються гриби й бактерії - анаероби, що виділяють вуглекислий газ, метан і сірководень. Сучасні дослідження науковців розглядають серед причин погіршення стану здоров’я і довголіття населення з позицій нового діючого фактору ризику – дефіциту електронів у навколишньому середовищі, а саме у питній воді та харчових продуктах. Враховуючи, що одним із шляхів надходження до організму електронів є вода та харчові продукти, забезпеченість їх негативними іонами водню має бути важливим показником їх біологічної цінності. Це вимагає встановлення додаткових вимог до якості питної води та харчових продуктів, а саме врахування таких показників як водневий і окисно-відновного потенціалу Саме тому кислотно - основні властивості мають велике значення практично у всіх областях народного господарства.
Мета і завдання досліджень. Метою роботи є дослідження впливу pH на напрям і швидкість хімічних і біохімічних процесів.
Для досягнення поставленої мети необхідно вирішити такі завдання:
- узагальнення відомостей наукової літератури про вплив pH на напрям і швидкість хімічних і біохімічних процесів, життя та здоров’я людини;
- визначення кислотності продуктів харчування, косметичних засобів, засобів побутової хімії;
- розроблення практичних рекомендацій з корекції паталогій та профілактики захворювань, які виникають при порушенні рівня рН в організмі людини;
- створення комп’ютерної програми для вивчення учнями теми «Значення рН для характеристики кислотного чи лужного середовища».
Об`єкт досліджень
Харчові продукти:
- молоко;
- чай;
- фрукти;
- соки.
Засоби побутової хімії:
- рідке мило;
- засіб для прання;
- засіб для миття посуду;
косметичні засоби;
слина;
кров;
сльози.
Предмет досліджень: вплив pH на напрям і швидкість хімічних і біохімічних процесів, життя та здоров’я людини.
Методи досліджень:
- аналіз наукової літератури та періодичних видань;
- лабораторний експеримент;
- аналіз, синтез і узагальнення результатів лабораторних експериментів.
Наукова новизна одержаних результатів. У роботі досить докладно узагальнені й обґрунтовані біохімічні та хімічні процеси, що проходять в організмі людини та в оточуючому середовищі залежно від рівня pH . Доведено негативний вплив на ці процеси підвищення рівня кислотності, що призводить до серйозних фізіологічних, функціональних, динамічних змін навіть на клітинному рівні. І на основі цих кількісних даних розроблений збалансований раціон харчування для корекції та профілактики паталогій, викликаних підвищенням рівня кислотності.
Практична цінність роботи. Результати проведених досліджень можуть бути використані:
- для профілактичних бесід з учнями та батьками;
- для розроблення раціонів збалансованого і раціонального харчування дошкільнят, учнів та студентів;
- для профілактики багатьох найбільш поширених захворювань: недокрів’я, хвороб серцево-судинної системи та підвищення імунітету;
- на уроках біології, екології, хімії, основ здоров’я, Захисту Вітчизни (медично-санітарної підготовки);
- створена комп’ютерна програма може бути використана для вивчення учнями теми «Значення рН для характеристики кислотного чи лужного середовища» на уроках хімії та інформатики.
Практичні дослідження
Методи визначення значення pH.
Для визначення значення pH розчинів широко використовують кілька методів. Водневий показник можна приблизно оцінювати за допомогою індикаторів, точно виміряти pH-метром або визначати аналітично шляхом, проведенням кислотно-основного титрування.
Кислотно-основні індикатори
Для грубої оцінки концентрації водневих іонів широко використовуються кислотно-основні індикатори - органічні речовини-барвники, колір яких залежить від pH середовища. До найбільш відомих індикаторів належать лакмус, фенолфталеїн, метиловий оранжевий (метилоранж) та інші. Індикатори здатні існувати в двох по-різному забарвлених формах - або в кислотній, або в основний. Зміна кольору кожного індикатора відбувається в своєму інтервалі кислотності, зазвичай становить 1-2 одиниці.
Універсальний індикатор
Для розширення робочого інтервалу вимірювання pH використовують так званий універсальний індикатор, який представляє собою суміш з декількох індикаторів. Універсальний індикатор послідовно змінює колір з червоного через жовтий, зелений, синій до фіолетового при переході з кислотної області в основну. Розчинами таких сумішей - «універсальних індикаторів» зазвичай просочують смужки «індикаторного паперу», за допомогою яких можна швидко (з точністю до одиниць рН, або навіть десятих часток рН) визначити кислотність досліджуваних водних розчинів. Для більш точного визначення отриманий при нанесенні краплі розчину колір індикаторного паперу негайно порівнюють з еталонною кольоровою шкалою, вид якої представлений на зображеннях.
Визначення pH індикаторним методом утруднено для мутних або забарвлених розчинів.
pH-метр.
Використання спеціального приладу - pH-метра - дозволяє вимірювати pH в ширшому діапазоні і більш точно (до 0,01 одиниці pH), ніж за допомогою універсальних індикаторів. Спосіб відрізняється зручністю і високою точністю, особливо після калібрування індикаторного електроду в обраному діапазоні рН. Дозволяє вимірювати pH непрозорих і кольорових розчинів і тому широко використовується.
Аналітичний об'ємний метод.
Аналітичний об'ємний метод - ацидиметрія - також дає точні результати визначення кислотності розчинів. Розчин відомої концентрації (титрант) по краплях додається до досліджуваного розчину. При їх змішуванні протікає хімічна реакція. Точка еквівалентності - момент, коли титранту точно вистачає, щоб повністю завершити реакцію, - фіксується за допомогою індикатора. Далі, знаючи концентрацію і об'єм доданого розчину титранту, обчислюється кислотність розчину.
Вплив температури на значення pH.
Значення pH може змінюватися в широкому діапазоні при зміна температури. Так, 0,001 молярний розчин NaOH при 20°C має pH = 11,73, а при 30°C pH = 10,83. Вплив температури на значення pH пояснюється різною дисоціацією іонів водню (H+ ) і не є помилкою експерименту. Температурний ефект неможливо компенсувати за рахунок електроніки pH-метра.
Дослідження pH харчової та косметичної продукції
Випробувати універсальним індикатором зразки харчових продуктів та косметичної продукції. Для випробування сухих зразків, як, наприклад, пральний порошок, їх необхідно розчинити в невеликій кількості води (1 шпатель сухої речовини на 0,5–1 мл води). Визначити pH розчинів.
Результати проведених досліджень наведені в таблицях та малюнках.
|
Продукція |
Колір універсального індикатора |
Значення рН |
Середовище |
|
лимон |
червонo-оранжевий |
3 |
кислотне |
|
шампунь |
жовтий |
6 |
слабокислотне |
|
зубна паста |
жовто-зелений |
7 |
нейтральне |
|
пральний порошок |
синій |
11 |
лужне |
|
кольорові газовані напої |
червонo-оранжевий |
3 |
кислотне |
|
соки |
оранжевий |
4 |
слабокислотне |
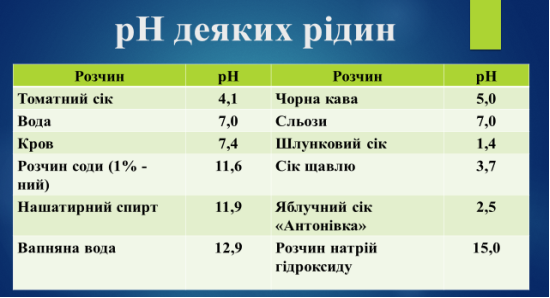
Методики визначення рівня рН деяких речовин(молока, тютюнового диму) наведені в додатку.
Результати роботи
узагальнено відомості наукової літератури про вплив pH на напрям і швидкість хімічних і біохімічних процесів, життя та здоров’я людини;
проведені лабораторні досліди по визначенню кислотності продуктів харчування, косметичних засобів, засобів побутової хімії;
розроблені практичні рекомендації з корекції паталогій та профілактики захворювань, які виникають при порушенні рівня рН в організмі людини;
створена комп’ютерна програма для вивчення учнями теми «Значення рН для характеристики кислотного чи лужного середовища».
ВИСНОВКИ.
Як бачимо, визначення концентрації водневих іонів має дуже велике значення в різних галузях хімії, технології, грунтознавства, геології, біохімії, медицини та інших наук.
Дотримуйтесь правильний рН баланс для збереження міцного здоров'я. Організм здатний правильно засвоювати і накопичувати мінерали та поживні речовини лише при належному рівні кислотно-лужної рівноваги. У ваших силах допомогти своєму організму отримувати, а не втрачати корисні речовини. Наприклад, залізо може засвоюватися організмом при рН 6,0 - 7,0, а йод - при рН 6,3 - 6,6. Наш організм використовує соляну кислоту для розщеплення їжі. У процесі життєдіяльності організму потрібні як кислі, так і лужні продукти розпаду, причому перші утворюються в 20 разів більше, ніж других. Тому захисні системи організму, що забезпечують незмінність його КЩР, "налаштовані" перш за все на нейтралізацію і виведення перш за все кислих продуктів розпаду. Основними механізмами підтримки цієї рівноваги є: буферні системи крові (карбонатна, фосфатна, білкова, гемоглобінова), респіраторна (легенева) система регуляції, ниркова (видільна система).
У Ваших інтересах підтримувати правильний рН-баланс.
Дедалі більше розширюються можливості медицини завдяки досягненням біохімії, яка за допомогою відстеження та корекції належного рівня рН допомагає регулювати деякі важливі функції людського організму.
Роль харчових продуктів для підтримання нормальної життєдіяльності організму дуже важлива. Знаючи, які корисні речовини і в якій кількості містять харчові продукти і при яких захворюваннях їх бажано застосовувати, можна регулювати рівень кислотності в організмі, покращуючи тим самим самопочуття, запобігаючи деяким недугам або навіть виліковуючи людину від тієї чи іншої початкової стадії хвороби. Зокрема рослинна їжа є прекрасним профілактичним засобом проти багатьох недуг. Недарма ж наші пращури здавна використовували рослини в народній медицині, якою користуються і зараз в клінічній медицині та в дієтології.
Дана робота ще раз доводить, що без досягнень хімічної науки практично неможливе існування багатьох галузей виробництва та медицини. І дійсно, справедливим є вислів М. В. Ломоносова: «Широко простягає хімія руки свої в справи людські».
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
1.Астахов О. І. Методика і техніка хімічного експерименту / О. І. Астахов. – К.: Школа, 2002. – 223 с.
2.Астафуров В. И. Основы химического анализа / В. И. Астафуров. – М.: «Просвещение», 2002. - 157с.
3.Гладюк Т. В. Біологія. Хімія (інтегровані заняття) / Т.В. Гладюк. – Тернопіль, 1997.– 84 с.
4.Губський Ю. І. Біологічна хімія / Ю.І. Губський. - Київ – Тернопіль: Укрмедкнига, 2000. - 437 с.
5.Майданник В. Г. Педиатрия / В. Г. Майданник. - К.: Медицина, 1999. - 832
6.Мамчур Ф. І. Овочі і фрукти у нашому харчуванні / Ф. І. Мамчур. – Ужгород: Карпати, 1999. - 201с.
7.Москаленко О. С. Основи хімічного аналізу / О. С. Москаленко. – К.: Наука, 2000. – 270 с.
8.Паталогічна фізіологія / [за ред. проф. М. Н. Зайка і проф. Ю. В. Биця]. – К.: Вища школа, 1995. – 672 с.
9. Рабинович В. А. Краткий химический справочник / В. А. Рабинович, З. Я. Хавин. – С. П.: Химия, 1991. – 431 с.
10.Химия биорегуляторных процессов / [под ред. В. П. Кухаря и А. И. Луйка]. – К.: Наукова думка, 1991. – 368 с.
11.Хімія харчування / [Упоряд. О. Каретникова, Г. Кальченко]. – К.: Ред. загальнопед. газ., 2005. – 125 с.
12. Циб А.Ф., Розіев Р.А., Бевз Н.І., Черняєв С.І., Черняєва М.М. Продукти з нетрадиційними біологічно активними добавками. Ж. Молочна промисловість. № 11, 1999 р.
ІНТЕРНЕТ-РЕСУРСИ.
1.Електронна енциклопедія. Вікіпедія. Хімічний портал / [Електронний ресурс] – Режим доступу до енциклопедії: http://ru.wikipedia.org/wiki/Портал: Хімія.
2. https://mozok.click/696-kislotnst-seredovischa-ponyattya-pro-ph-rozchinu.html
3. https://floragrowing.com/uk/encyclopedia/vodnevyy-pokaznyk-ph-faktor
Додаток.
Визначення кислотності молока.
Налити в колбу 10 мл молока або молочного напою, 20 мл дистильованої води і додати 5 крапель спиртового розчину фенолфталеїну. Вміст колби добре збовтати і титрувати його 0,1 н розчином їдкого натру до появи помітного рожевого забарвлення. Обсяг (мл) витраченого на титрування розчину лугу помножити на 10. Результат цього математичного дії і являє собою кислотність молока, виражену в умовних одиницях - градусах Тернера, які розраховуються на 100 мл молока або молочного напою (звідси зрозуміло, чому обсяг лугу необхідно помножити на 10). Свіже молоко має 16-18 градусів кислотності через що міститься в ньому казеїну - білка з кислотними властивостями, а також кислих солей ортофосфорної і лимонної кислот. Згодом кислотність молока зростає через молочнокислого бродіння лактози. Гранична кислотність свіжого молока - 20 градусів. Якщо кислотність вище, то молоко починає скисати.
Визначення реакції середовища розчину тютюнового диму.
У пробірку налити 2 мл розчину тютюнового диму і додати кілька крапель розчину лакмусу. Спостерігається характерне для кислого середовища забарвлення.
1


про публікацію авторської розробки
Додати розробку
