Загальна характеристика металічних елементів. Метали – прості речовини. Металічний зв’язок. Поняття про корозію.
Тема: Загальна характеристика металічних елементів. Метали – прості речовини. Металічний зв’язок. Поняття про корозію.
Мета:
навчальна: поглибити знання учнів про металічні елементи, їх положення в періодичній системі, про загальні фізичні властивості металів, особливості будови атомів, будови речовин, розширити знання учнів про види хімічного зв’язку введенням поняття про металічний зв’язок; показати його вплив на фізичні властивості речовин, утворених металічними елементами;
розвивальна: розвивати вміння аналізувати, порівнювати, узагальнювати та робити висновки на основі набутих знань; формувати навички пошукової роботи;
виховна: сприяти формуванню наукового світогляду, комунікативної та інформаційної компетентності.
Тип уроку: вивчення нового матеріалу
Основні поняття і терміни: карбонатна кислота, карбонати, гідроген карбонати.
Методи навчання: словесні: пояснення з елементами бесіди, розповідь, прийом «Мозковий штурм»; наочні: робота з таблицями; практичні: виконання вправ, вирішення кросворду .
Засоби навчання: Періодична система хімічних елементів Д.І. Менделєєва, таблиця розчинності, рід електронегативності, підручники з хімії, зошити.
Структура та хронометраж уроку
- Організаційний момент (2хв)
- Мотивація начально - пізнавальної діяльності (3хв)
- Актуалізація теоретичних знань (5хв)
- Виклад нового матеріалу (25хв)
- Узагальнення та закріплення нового матеріалу (15хв)
- Підсумок уроку (3хв)
- Виставлення оцінок та їх мотивація (4хв)
8. Інструктаж з домашнього завдання (3хв)
Перебіг уроку
1.Організаційний момент
(Слово вчителя)
- Привітання вчителя з учнями
- Перевірка готовності робочих місць до проведення уроку
- Перевірка присутніх
2.Мотивація начально-пізнавальної діяльності
Не було б у світі великих гарних міст, струнких хмарочосів, якби не наполеглива праця винахідників, інженерів та робочих. Природа дарує людині воду, землю, каміння, залізну руду, але тільки праця здатна перетворити їх на речі складніші, цивілізовані. Без праці ми не могли би пересуватися за допомогою літаків, пароплавів, машин. Та що там – навіть колесо не придумали би, не доклавши зусиль. Праця все може – за її допомогою перемагають труднощі, знаходять рішення проблем, які здавалися тупиками, досягають добробуту. Праця насправді творить, удосконалює людину, а людина – про це казали мислителі всіх часів – за своєю природою жадає вдосконалення.
Тому, діти, нам потрібно гарно попрацювати, адже лише ту роботу, яка приносить людям користь, можна назвати працею. Тому я бажаю вам успіху сьогодні та позитивних емоцій на шляху до досягнення своєї мети.
3. Актуалізація теоретичних знань
Прийом «Мозковий штурм»
1. Запишіть електронні формули Натрію, Магнію, Літію, Кальцію, Алюмінію, Карбону, Силіцію. Знайдіть елементи, у яких однакова кількість електронів на зовнішній оболонці. Згрупуйте їх попарно. Які з цих пар належать до металічних елементів? Де вони розташовані в періодичній системі?
2. На дошці записані основні поняття теми, які учні мають згадати й дати їм пояснення.
• Металічні елементи.
• Положення металічних елементів у ПС.
• Особливості будови атомів металів (електрони на зовнішньому рівні, радіус атомів).
• Зміна металічних властивостей у періодах.
• Зміна металічних властивостей у групах.
4. Виклад нового матеріалу
Розповідь з елементами бесіди
Пригадайте з попередньої теми «Неметалічні елементи та їх сполуки» і дайте відповідь на питання: яких елементів у природі більше: металічних чи неметалічних? (металічних, трохи більше 80%)
А тепер пригадайте, де в періодичній системі Д.І.Менделєєва розташовані елементи-неметали і дайте відповідь про те, де розміщені металічні елементи.
Зверніть увагу на їх положення в періодах, в яких рядах, групах, які це елементи.
- Елементи метали розташовані на початку періодів (виняток 1 період).
- Усі елементи побічних підгруп відносяться до металічних.
- Непарні ряди великих періодів утворені лише з металічних елементів.
- Хімічні елементи-метали розташовані переважно в лівій нижній частині ПСХЕ.
Проблемне питання:
Чим обумовлено те, що металічних елементів більш, ніж у 4 рази більше, ніж неметалічних? (Будовою атомів).
Запишемо будову атомів хімічних елементів натрію, магнію, алюмінію.
11Na 1S22S22P63S1 12Mg 1S22S22P63S2;
13Al 1S22S22P63S23Р1.
На зовнішньому енергетичному рівні знаходиться невелике число електронів (звичайно 1 – 3).
Радіуси атомів металів великі, порівняно з радіусами атомів неметалів того ж періоду.
Метали мають невелику електронегативність, тому легко віддають валентні електрони, тим виявляють відновні властивості.
Na – 1e- → Na+ (11Na+ 1S22S22P63So)
Mg – 2e- → Mg2+ (12Mg+ 1S22S22P63So)
АІ – 3e- → АІ3+ (13АІ+ 1S22S22P63So)
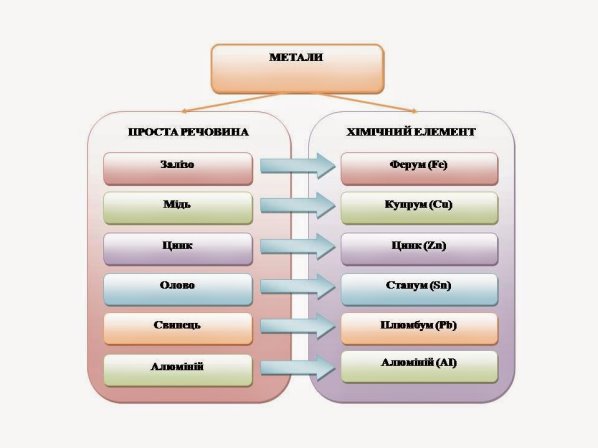
А тепер я попрошу вас пригадати, яку ви вивчали просту речовину – метал ще у 7 класі. Про який метал ми говорили? (Залізо). А яким елементом утворена ця проста речовина (Ферумом).
- Що називається хімічним елементом? (Хімічний елемент – вид атомів із певним зарядом ядра)
- Які речовини називають простими? (Речовини, які містять атоми одного хімічного елемента)
Металічним елементам відповідають прості речовини – метали. Часто назви співпадають, але є й такі, що мають різні назви.
Ви знаєте, що за (н.у.) метали тверді і здатні проводити електричний струм.
Як ви вважаєте, а яку кристалічну ґратку має твердий метал?
Усі метали мають подібні властивості, які можна пояснити подібністю будови їхніх кристалічних ґраток. У вузлах ґраток розташовані позитивно заряджені йони, а електрони зовнішніх рівнів усіх атомів металу вільно переміщуються по всьому зразку металу. Образно ці електрони «мандрівники» називають «електронним газом», оскільки вони рівномірно заповнюють увесь простір між йонами. Ці електрони можуть вільно пересуватися по всьому зразку металу, тому вони добре проводять струм і тепло.(У вузлах металічної кристалічної ґратки розташовані йони й атоми, а між ними рухаються електрони).
Поясніть, які сили не дають можливості атомам металів розлетітися?
Отже, металічний зв’язок - це зв'язок між наявними в металах усуспільненими електронами, катіонами й атомами, у яких зберігся зв'язок валентних електронів із ядром. Саме металічний зв'язок визначає фізичні властивості металів.
Метали мають загальні фізичні властивості: електропровідність, теплопровідність, металічний блиск, пластичність.
Чим можна пояснити наявність загальних фізичних властовостей у великого числа різноманітних простих речовин, які називають металами? Зв’яжіть свою відповідь із будовою атома. (Особлива будова атома: рухливість електронів, на зовнішньому електронному рівні невелика кількість електронів, які слабко взаємодіють з ядром, атом може легко їх віддавати).
Фізичні властивості металів:
- Агрегатний стан (тверді, за винятком ртуті)
- Колір: усі відтінки від сірого до чорного (виняток мідь та золото)
- Тепло-й електропровідність ( за рахунок вільних електронів)
Hg, Pb, Fe, Zn, Mg, AI, Au, Cu, Ag
→ збільшується
- Ковкість і пластичність (крихкі – ті, у яких 5-7 електронів на останьому рівні)
- Густина (легкі (літій ƍ = 0,53г/см3), важкі (осьмій ƍ =22,48 г/см3))
- Твердість (м’які та тверді )
- Температура плавлення (легкоплавкі та тугоплавкі )
Коро́зія мета́лів — процес автоматично-хімічного руйнування металів і сплавів при їх взаємодії з зовнішнім середовищем: повітрям, водою, розчинами електролітів тощо. До основних видів корозії за її механізмом відносять хімічну, електрохімічну, а також біологічну.
- Узагальнення та закріплення нового матеріалу
Брейн – ринг
- Скільки електронів мають метали на зовнішньому енергетичному рівні? (1-3)
- Яку кристалічну ґратку мають метали? (металічну)
- Які частинки лежать у вузлах ґратки? (катіони металу)
- Який метал має найбільшу електропровідність? (Ag)
- Який метал має найбільший блиск? (Ag)
- Який метал можна розплавити на руці?(t пл. Cs=28,5°C, t пл.Ga =29,7°C)
Які метали є в складі різних органів людини? (Са – в кістках, Сu – в печінці, Mn – в серці, Zn – в зубах, Fe– в крові, As – в нирках, Au – в крові).
Хімічний кросворд (назвати ключове слово)
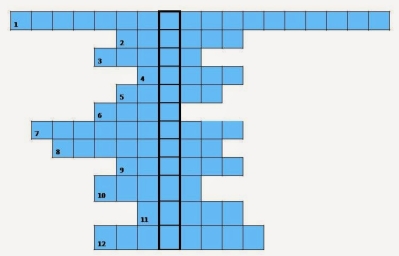
1. Одна із найважливіших фізичних властивостей металів (електропровідність).
2. Який метал має найбільшу пластичність? (Au)
3. Твердий розчин одного металу в іншому (сплав)
4. Найважчий з металів? (Os)
5. Найлегший з металів? (Lі)
6. Які частинки лежать у вузлах металічної ґратки? (катіони)
7. Особливий тип хімічного зв’язку, властивий металам та їхнім сплавам (металічний)
8. Метал, що характеризується легкістю, високими електропровідністю та теплопровідністю, пластичністю, широко застосовується в побуті і промисловості (Al)
9. Метал, що за електропровідністю стоїть на першому місці, має сильний металічний блиск (Ag)
10. Фізична властивість металів, що зумовлена здатністю відбивити світлові промені (блиск)
11. Який метал найбільш легкоплавкий? (Hg)
12. Який метал найбільш тугоплавкий? (W)
- Підсумок уроку
Де б ми не були нас повсюди оточують метали. На кухні – металевий посуд, холодильник, мікрохвильова піч, у ванній кімнаті - металевий змішувач, пральна машина, електрика в кожну кімнату також попадає по металевій проводці. Без цвяха і молотка не обійдеться жоден будівельник, без металевих конструкцій не зведеш моста, без транспорту, зробленого з металу (велосипед, автомобіль, літак, поїзд), подорожувати можна тільки пішки.
Закінчуючи урок, можна зробити такі висновки: (учні формулюють висновки про метали та їх значення).
- Виставлення оцінок та їх мотивація
8. Інструктаж з домашнього завдання
Вивчити конспект. Опрацювати §16. Підготувати повідомлення: «Значення металів у життєдіяльності організмів».


про публікацію авторської розробки
Додати розробку
