Загальна характеристика основ
Про матеріал
Основи – це складні речовини, в яких йони металів з’єднані з одною чи декільками гідроксид-йонами.
Схема утворення натрій: гідроксиду.
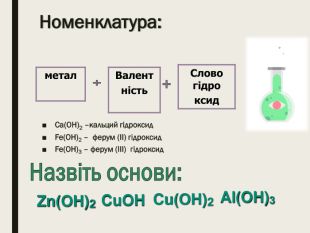
Номенклатура.
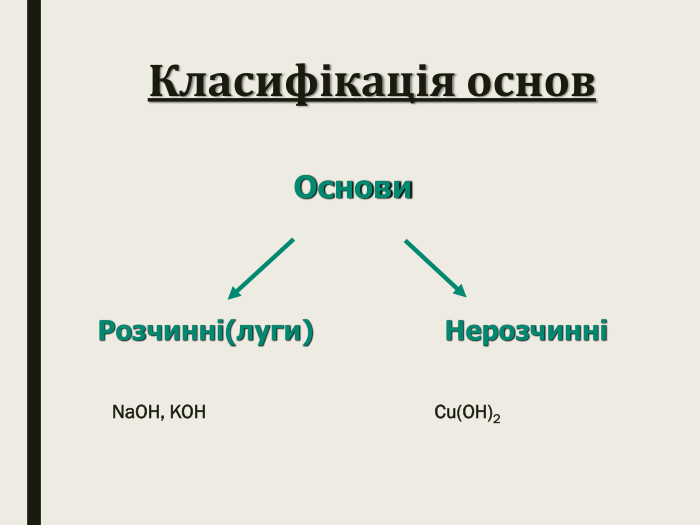
Класифікація основ. Основи поділяються на розчинні у воді та нерозчинні.
Фізичні властивості основ. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку