Закон збереження маси речовини під час хімічних реакцій
Урок вивчення нового матеріалу. Метою є ознайомлення з історією відкриття закону збереження маси речовини.
Тема. Закон збереження маси речовини під час хімічних реакцій
Мета: ознайомити учнів із законом збереження маси речовини, розкрити суть цього закону,сформувати уявлення про роботи Р. Бойля , А.Лавуазьє, М.Ломоносова в цій галузі, пояснити значення закону збереження маси речовини в хімії; розвивати предметну та ключові компетентності учня ,пізнавальний інтерес, логічне мислення;
виховувати самостійність,бережливе ставлення до навколишнього середовища
Обладнання: презентація, ПСХЕ, підручник
Тип уроку: вивчення нового матеріалу
Хід уроку.
І. Організація
Вправа “Бажаю тобі..” ( учні обводять на аркуші паперу долоню, на кожному пальчику пишуть побажання сусіду)
ІІ. Актуалізація опорних знань.
- Прийом “Мікрофон”
- яке явище називають фізичним?
- яке явище називають хімічним?
- як ще називаються хімічні явища?
- при яких явищах виділяється газ?
- яке явище супроводжується випаровуванням?
- які ознаки хімічних явищ?
- Знайти пару ( на дошці прикріплюються малюнки, а до них дібрати назву даного явища)








ІІІ. Мотивація навчально-пізнавальної діяльності.
Кожна наука базується на знаннях, які здобуло людство в процесі свого історичного розвитку. Знання, що відображають найсуттєвіші повторювальні або сталі зв’язки між явищами, процесами, предметами в навколишньому світі, називають законами.
Вивчені вами перші поняття періодичного закону дають деякі уявлення про існування в природі періодичності: відмирання листків на деревах восени та відродження їх навесні, зміна дня й ночі, пір року, фаз Місяця тощо.
Кожний закон, відкритий у науці, є формою узагальнених знань, на основі яких можна базувати або передбачувати нові, ще не відкриті людством знання.
Хімія вивчає закони, що пояснюють перетворення сполук.
Отже, тема нашого уроку “Закон збереження маси речовини під час хімічних реакцій”
ІV. Вивчення нового матеріалу.
Ми вже знаємо , що хімічні явища супроводжуються утворенням нових речовин. Можна передбачити , що маса речовин, які вступали в реакцію і маса речовин, що утворилися рівні. Це можливо, тому що атоми хімічних елементів не руйнуються. Сьогодні це є достовірне наукове твердження.
Але відкриттю будь-якого закону передує величезна експериментальна праця. Багато учених проводили досліди із нагріванням речовин. Одним з них був Р. Бойль.
-
 Знаменитий англійський фізик Роберт Бойль, прожарюючи у відкритій реторті різні метали та зважуючи їх до і після нагрівання, з’ясував, що маса металів збільшується. Він зробив висновок, що маса речовин у результаті хімічної реакції змінюється. Р. Бойль стверджував, що існує якась «вогняна матерія», що в разі нагрівання металу з’єднується з ним, збільшуючи його масу.
Знаменитий англійський фізик Роберт Бойль, прожарюючи у відкритій реторті різні метали та зважуючи їх до і після нагрівання, з’ясував, що маса металів збільшується. Він зробив висновок, що маса речовин у результаті хімічної реакції змінюється. Р. Бойль стверджував, що існує якась «вогняна матерія», що в разі нагрівання металу з’єднується з ним, збільшуючи його масу.

- Як і всіх хіміків, Антуана Лавуазьє цікавив процес горіння. У 1772 році Лавуазьє спільно з іншими хіміками придбав алмаз. Він помістив його в закриту посудину і нагрівав доти, поки алмаз не зник. При цьому утворився вуглекислий газ. Але маса посудини з умістом не змінилася. Продовжуючи досліди, він нагрівав у закритих посудинах метали. Обмірковуючи результати дослідів, Лавуазьє дійшов висновку, що, якщо враховувати всі речовини, які беруть участь у хімічній реакції й утворюються в результаті реакції, то жодних змін не відбувається.
-
Такі ж досліди проводив М. В. Ломоносов. Проаналізувавши проведені досліди попередниками, він змінив умови досліду - зважування речовин до і після прожарювання, він здійснював у запаяній реторті. Щоразу вчений виявляв, що маса запаяної реторти разом з її вмістом залишалась незмінною. Ще в 1748 році він сформулював результати своїх досліджень як закон збереження речовини.

Закон збереження маси ввійшов в історію як закон Ломоносова — Лавуазьє. Його сучасне формулювання :
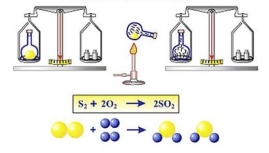
Загальна маса речовин, що вступили в хімічну реакцію, дорівнює загальній масі речовин, одержаних у результаті реакції.
Короткий запис закону:
m (реагентів) = m (продуктів)
V. Узагальнення та систематизація знань.
Розв”язування задач.
- Під час нагрівання нашатирю масою 53,5 г утворилось амоніаку масою 17г. Яка маса хлороводню утворилась?
- Літій масою 42 г реагує з азотом масою 28 г. Обчисліть масу продукту реакції?
- Визначте масу кальцій оксиду, який утворюється при взаємодії 3,43 г кисню й 8,57 г кальцію.
- 16 г метану повністю згоряє в кисні, в результаті реакції утворюється 44 г вуглекислого газу та 36 г води. Яка маса кисню бере участь в реакції?
VІ. Підсумок уроку.
Рефлексія.
«П‘ять відкриттів уроку»
Учням запропоновано подумати над тим, які відкриття кожен з них зробив для себе на уроці. Яку підказку варто використовувати незакінчені словесні конструкції:
*на уроці відкрив(-ла) для себе…
* сьогодні мене здивувало…
* виникли несподівані думки про …
*сьогодні на уроці я дізнався(-ла), (як ,що)…
* сьогодні я зрозумів (-ла), що … стане в пригоді мені в подальшому жит
VІІ. Д/з : опрацювати параграф 23, виконати завдання 9 с. 112


про публікацію авторської розробки
Додати розробку
