Заняття з фізики "Рівняння теплового балансу"
Заняття-змагання з теми «Рівняння теплового балансу для найпростіших теплових процесів». Групу поділено на 4 групи за професіями: І група – майстер виробничого навчання, слюсар, автослюсар; ІІ група – інженер – технолог; ІІІ група – військовий; ІV група – пожежний. Мета заняття повторити основні теплові процеси, рівняння і величини, що їх описують, і вміти застосувати знання при складанні рівнянь теплового балансу в ході розв'язання розрахункових задач та запитань, а також вміти доводити, що дані фізичні процеси мають місце у виробництві.
Тема: Рівняння теплового балансу для найпростіших теплових процесів.
Мета:
- повторити основні теплові процеси, рівняння і величини, що їх описують, і застосувати знання при складанні рівнянь теплового балансу в ході розв’язання розрахункових задач та запитань;
- довести, що дані фізичні процеси мають місце у виробництві;
- в ході розв’язання якісних та розрахункових задач прививати студентам інтерес і розвивати зацікавленість такими професіями, як інженер-технолог, військовий, пожежний, майстер виробничого навчання, автослюсар.
Обладнання та роздатковий матеріал:
- калориметр з водою, посудина з окропом, мідний брусок на нитці,
- таблиці температур кипіння, плавлення, питомої теплоємності, питомої теплоти згоряння палива, питомої теплоти плавлення, пароутворення;
- графік плавлення і кристалізації; роздатковий матеріал профільного характеру.
Тип заняття: лекція – бесіда з використанням інтерактивних форм організації навчальної діяльності:
- робота в малих групах за профілем.
І. Актуалізація опорних знань, вмінь і навичок.
Визначте, які із наступних тверджень вірні, а які хибні:
- коли сірник внесли у полум'я свічки, то внутрішня енергія збільшилась внаслідок механічної роботи; (хибна)
- коли сірник запалили об коробок, то внутрішня енергія збільшилась внаслідок теплопередачі; (хибна)
- коли пилка нагрілась після розпилювання дров, то внутрішня енергія збільшилась внаслідок механічної роботи; (вірна)
- коли штучний супутник нагрівся під час входження в атмосферу Землі, то внутрішня енергія збільшилась внаслідок теплопередачі; (хибна)
- коли склянку з водою кімнатної температури поставили в холодильник, то внутрішня енергія зменшилась внаслідок теплопередачі; (вірна)
- коли дах будинку нагрівся під прямими променями сонця, то внутрішня енергія збільшилась внаслідок теплопередачі. (вірна)
Наведіть власні приклади зміни внутрішньої енергії
ІІ. Мотивація навчальної діяльності.
Ми знаємо, що внутрішню енергію тіла можна змінити, виконавши роботу (за допомогою тертя чи стиснення газу).
А сьогодні ми розглянемо, як можна змінити внутрішню енергію тіла, не виконуючи роботи. Так, як це питання вивчалося у курсі фізики 8-го класу, то сьогодні ми проведемо заняття-змагання з теми «Рівняння теплового балансу для найпростіших теплових процесів».
Групу поділено на 4 групи за професіями:
І група – майстер виробничого навчання, слюсар, автослюсар;
ІІ група – інженер – технолог;
ІІІ група – військовий;
ІV група – пожежний
Кожна група студентів отримала випереджувальне завдання з даної теми. Теми завдань пов’язані з професіями. Сьогодні на занятті з нами буде працювати викладач дисципліни «Паливно-мастильні матеріали» Добранський С.С.
ІІ. Вивчення нового матеріалу
І виступ.
Кількість теплоти. Теплоємність. Рівняння теплового балансу
Всі ви знаєте, що гарячий чай у склянці з часом охолоджується – його температура наближається до кімнатної. А ложка, опущена у гарячий чай, нагрівається, її внутрішня енергія збільшується, але робота при цьому не виконується.
- Зміну внутрішньої енергії тіла без виконання роботи називають теплообміном.
Пояснимо цей процес з молекулярної точки зору:
Відбувається обмін енергіями молекул речовин, що безладно, хаотично рухаються. Це призводить до вирівнювання температур тіл. В процесі теплообміну внутрішня енергія одних тіл збільшується, а інших – зменшується.
- Енергія, яку одержує або віддає тіло при теплообміні, називають кількістю теплоти.
Тобто мірою цих змін є кількість теплоти, яку тіло одержує чи віддає.
-
Під час нагрівання чи охолодження тіла кількість переданої теплоти прямо пропорційна масі m і зміні його температури
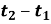 .
.
![]() – кількість теплоти, необхідна для
– кількість теплоти, необхідна для
нагрівання тіла.
Під час охолодження тіла його кінцева температура Т2 (t2) менша за початкову Т1 (t1) і кількість теплоти, яку тіло віддає, слід вважати від’ємною.
Але однакова кількість теплоти, передана тілу, може викликати різні зміни внутрішньої енергії, а значить і температури. Чому?
Різні речовини мають різну теплопровідність, тобто
- Кількість теплоти, яку треба надати 1 кг речовини, щоб змінити її температуру на 1 К. Одиниці вимірювання [С]= [ Дж/кг ∙ К]
Таблиця 1. Питома теплоємність деяких речовин
|
Тверде тіло |
Питома теплоємність Дж/кг ∙ К |
Рідина |
Питома теплоємність Дж/кг ∙ К |
|
Алюміній |
900 |
Бензин |
1400 |
|
Залізо, сталь |
450 |
Вода |
4200 |
|
Лід |
2100 |
Гас |
2100 |
|
Мідь |
380 |
Гліцерин |
2400 |
|
Полівінілхлорид |
920 |
Ртуть |
140 |
|
Сухе дерево (дуб) |
2400 |
Олія |
1800 |
|
Скло лабораторне |
840 |
Спирт |
2500 |
|
Цегла |
850 |
Фреон |
840 |
Викладач спецдисциплін:
Ви бачите, що чим менша теплоємність речовини, тим більша її теплопровідність. Велику теплопровідність мають метали, особливо мідь і срібло. Мідь – це метал червоного кольору. Його застосовують для виготовлення різних прокладок, припоїв, наконечників для паяльників. Мідь – це кольоровий метал. Але велику теплопровідність мають і чорні метали. Так, сірий чавун (сплав заліза з вуглецем – понад 2%) використовують для відливання батареї опалення.
Речовини з малою теплопровідністю використовують як утеплювачі і теплоізолятори. Дуже малу теплопровідність мають гази. Цим обумовлена мала теплопровідність пухнастих тканин, наприклад вовни: між їхніми волокнами багато повітря. З тієї ж причини мала теплопровідність пористих матеріалів (типу пінопласту), а також снігу, особливо який тільки-но випав.
Подивіться на питому теплоємність води у таблиці: 4200 Дж/кг ∙ К. Питома теплоємність дуже велика. Тому вода у морях і океанах, нагріваючись повільно, поглинає значну кількість теплоти. Завдяки цьому в тих місцях, які розташовані близько від великих водойм, улітку не буває так спекотно, як у місцях, віддалених від води.
Взимку вода, повільно охолоджуючись, віддає велику кількість теплоти, тому зима в цих умовах менш сувора. (Пригадайте, температурні показники, наприклад, у Одесі, взимку і у нас у Житомирі).
Саме завдяки великій теплоємності вода широко використовується в системі водяного опалення, у побуті й медицині, наприклад у грілках.
Викладач фізики: Розглянемо випадок, коли теплообмін відбувається тільки між двома тілами, тобто ні з якими іншими тілами вони теплом не обмінюються. Таку замкнуту систему можна отримати, розмістивши тіло у калориметр, а систему з цих 2-х тіл називають тепло ізольованою.
Наллємо, наприклад, у калориметр воду й зануримо в неї мідний брусок, вийнятий з окропу. Між бруском і водою почнеться теплообмін, внаслідок якого незабаром встановиться теплова рівновага: брусок і вода будуть мати однакову температуру t.
Кількість теплоти, що одержує вода: Кількість теплоти, що віддає мідь:
![]()
![]()
Так, як процес відбувався в теплоізольованій системі, то кількість теплоти, яку віддає одне тіло під час теплообміну, дорівнює кількості теплоти, прийнятої іншим тілом: ![]()
![]() – це рівняння теплового балансу
– це рівняння теплового балансу
Поетапний контроль за якістю засвоєння навчального матеріалу. (І тур змагання)
(Робота в малих групах профільного характеру, час обговорення – 1 хв.)
І група. Майстер виробничого навчання, слюсар, автослюсар.
- Питання: Чому воду вигідно використовувати для охолодження двигунів внутрішнього згоряння?
- Відповідь: Завдяки великій теплоємності води порівняно мала кількість води може забирати значну кількість теплоти у двигуна.
ІІ група. Інженер-технолог.
- Питання: Чому молоко охолоджується повільніше, ніж вода?
- Відповідь: Однією з причин є велика теплоємність і низька теплопровідність молока через наявність жирів.
ІІІ група. Військовий.
- Питання: Чому при мінусовій температурі навколишнього середовища пальці рук примерзають до металу?
- Відповідь: Теплопровідність металу дуже велика, тому тепло швидко відводиться від пальця. Отже, коли ми торкаємось холодного металу, волога, яка є на поверхні пальця, замерзне, і тому палець може «примерзнути» до предмету.
ІV група. Пожежний.
- Питання: Товстий металевий предмет туго загорнули в папір і піднесли до вогню. Чи одразу займеться папір?
- Відповідь: Завдяки великій теплопровідності металу значна кількість теплоти витрачатиметься на нагрівання металу і папір не зможе одразу загорітися.
ІІ виступ. Виділення енергії при згорянні палива.
Відомо, що джерелом енергії, яке використовується в промисловості, на транспорті, у сільському господарстві, у побуті, є паливо: вугілля, нафта, дрова, природній газ.
- Паливом називають речовини, які в результаті згоряння дають велику кількість теплоти.
Горіння – це хімічна реакція окислення речовин, яка супроводжується виділенням теплової енергії. У ході цієї реакції утворюються нові молекули (води, вуглекислого газу), що і призводить до виділення кількості теплоти.
При розрахунку двигунів інженерові необхідно достеменно знати, яку кількість теплоти може виділити спалюване паливо. Тому для енергетичної характеристики палива вводиться фізична величина, що називається питомою теплотою згоряння палива.
- Питома теплота згоряння палива чисельно дорівнює кількості теплоти, що виділяється при повному згорянні 1 кг палива.
[q]= [Дж/кг]
-
Кількість теплоти, що виділяється при згорянні палива, визначають за формулою:
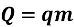
Таблиця 2: Питома теплота згоряння палива
|
Вид палива |
|
Вид палива |
|
|
Антрацит |
30 |
Нафта |
45 |
|
Бензин, гас |
46 |
Порох |
5 |
|
Буре вугілля |
15 |
Природний газ |
44 |
|
Дизельне паливо |
42 |
Солома |
14 |
|
Дрова (сухі), сланці |
10 |
Спирт |
26 |
|
Кам’яне вугілля |
25 |
Торф, тротил |
15 |
|
Мазут |
39 |
Умовне паливо |
29 |
Викладач спецдисциплін:
Теплота, що виділяється при згорянні палива (наприклад, природного газу) використовується для термічної обробки металів. Процес термічної обробки складається з трьох стадій: нагрівання деталі до певної температури, витримка й охолодження.
Види термічної обробки, які набули найбільшого поширення.
Це: 1) відпалювання – нагрівання сталі з 0,6 % вуглецю до температури 775-825 ˚С і поступове охолодження в печі. Це використовують для зняття внутрішніх напруг, що залишились у зразку після відливання.
2) нормалізація – нагрівання сталі до температури 750-950 ˚С, витримки при цій температурі й охолодження на повітрі. В результаті поліпшується обробка різальним інструментом.
3) гартування – нагрівання сталі до температури 780-850˚С, витримка і швидке охолодження у маслі або воді. Але загартовані вироби мають погані механічні властивості і тому їх піддають відпусканню.
4) відпускання – це процес нагрівання загартованої сталі до температури від 100 ˚С до 650 ˚С, витримування при заданій температурі і наступному охолодженні на повітрі.
Поетапний контроль за якістю засвоєння навчального матеріалу (ІІ тур змагання)
І група: Майстер виробничого навчання, слюсар, автослюсар.
- Питання: Коли автомобіль витрачає більше пального: коли під час руху зупиняється чи коли рухається, не зупиняючись? Поясніть.
- Відповідь: Коли автомобіль гальмує, його кінетична енергія перетворюється у внутрішню енергію гальмових колодок, шин та інших вузлів (вони нагріваються). Щоб після зупинення набути необхідної швидкості, а отже, і кінетичної енергії, двигун повинен витратити деяку кількість пального. Тому, коли автомобіль рухається, часто зупиняючись, потрібно більше пального.
ІІ група: Інженер-технолог
- Питання: Відомо, що температура полум’я найбільша у верхній його частині. Чому ж часто, поспішаючи нагріти воду у чайнику, збільшують полум’я, відкриваючи кран пальника?
- Відповідь: Щоб збільшити швидкість нагрівання води, їй треба передати більшу кількість теплоти за одиницю часу, тобто спалювати більше палива.
ІІІ група: Військовий
- Питання: Чому порох невигідно використовувати як паливо, а в артилерійських знаряддях бензином його замінити не можна?
- Відповідь: Порох на відміну від бензину має меншу питому теплоту згоряння, але більшу швидкість згоряння. Уся енергія пороху виділяється в тисячні частки секунди.
ІV група: Пожежний
- Питання: Чому будинок вигідніше опалювати, використовуючи вугілля, природний газ чи рідинне паливо, ніж дрова й солому?
- Відповідь: Будинок вигідніше і безпечніше опалювати вугіллям, природним газом, ніж дровами чи соломою, так як їх питома теплота згоряння палива більша і довший час горіння. У соломи та дров хоч питома теплота згоряння і менше, але і час згоряння теж набагато менший, що призводить до миттєвого виділення великої кількості теплоти – а це вже небезпечно.
ІІІ виступ. Плавлення та тверднення тіл. Температура плавлення.
Питома теплота плавлення.
Речовина може існувати в трьох агрегатних станах: твердому, рідкому і газоподібному, а також може переходити за певних умов з одного стану в інший.
- Плавленням називають перехід речовини з твердого стану в рідкий.
Щоб розплавити тіло, треба спочатку нагріти його до певної температури.
- Температура, за якої відбувається плавлення речовини, називають температурою плавлення.
Різні речовини при нормальному атмосферному тиску мають різну температуру плавлення.
Таблиця 3: Температура плавлення речовин
|
Речовина |
|
Речовина |
|
Речовина |
|
|
Азот |
-210 |
Кисень |
-219 |
Ртуть |
-39 |
|
Алюміній |
660 |
Лід |
0 |
Свинець |
327 |
|
Водень |
-259 |
Мідь |
1085 |
Срібло |
962 |
|
Вольфрам |
3387 |
Натрій |
98 |
Спирт |
-115 |
|
Залізо |
1535 |
Нікель |
1453 |
Титан |
1660 |
|
Золото |
1065 |
Олово |
232 |
Цинк |
420 |
|
Калій |
63 |
Платина |
1772 |
Чавун |
1200 |
Щоб розплавити тіло, необхідно передати йому певну кількість теплоти. Ця додаткова енергія потрібна для руйнування кристалічної гратки, тобто для послаблення взаємного притягання між атомами чи молекулами твердого тіла.
Під час плавлення температура речовини не змінюється, оскільки кількість теплоти йде на зміну внутрішньої енергії тіла. Різним речовинам необхідна неоднакова кількість для плавлення, так як їх молекули зв’язані між собою з неоднаковими силами і розташовані на різних відстанях.
- Питомою теплотою плавлення називають фізичну величину, що характеризує енергетичні затрати на плавлення і чисельно дорівнює кількості теплоти, яка необхідна для перетворення 1 кг твердої речовини в рідину за її температури плавлення.
Позначають питому теплоту плавлення ![]()
Таблиця 4: Питома теплота плавлення речовин
|
Речовина |
|
Речовина |
|
Речовина |
|
|
Алюміній |
393 |
Лід |
332 |
Свинець |
24 |
|
Водень |
59 |
Мідь |
213 |
Срібло |
87 |
|
Вольфрам |
185 |
Олово |
58 |
Сталь |
84 |
|
Залізо |
270 |
Платина |
113 |
Цинк |
112 |
|
Золото |
67 |
Ртуть |
12 |
Чавун |
96 |
-
Кількість теплоти, що витрачається на плавлення визначають за формулою
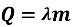
Якщо рідина віддає теплоту, вона охолоджується. При охолодженні до температури плавлення рідина, втрачаючи енергію, твердне. Тверднення – процес, обернений до плавлення.
- Твердненням або кристалізацією називають процес переходу речовини з рідкого у твердий стан.
Під час тверднення температура речовини не змінюється.
-
Температура плавлення речовини є водночас і температурою кристалізації. Питома теплота плавлення речовини є одночасно і питомою теплотою її кристалізації. Кількість теплоти, що виділяється під час кристалізації, дорівнює кількості теплоти, затраченій на плавлення даної речовини, і визначається формулою
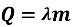
Графік плавлення і кристалізації води:
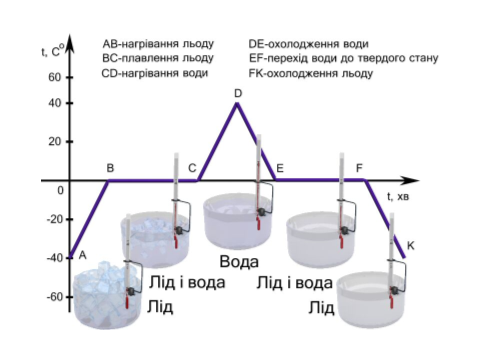
Викладач спецдисциплін:
Паянням називають технологічний процес з’єднання металевих частин за допомогою розплавленого металу – припою. При з’єднанні металів паянням відбувається дифузія, тобто проникнення одного металу (припою) в інший, за рахунок чого і забезпечується міцність з’єднання. Припої повинні мати температуру плавлення нижчу, ніж у основного металу, і хорошу змочуваність поверхні. Для захисту з’єднань металів від окислення застосовують флюси (кислоти, солі металів), вони плавляться раніше за припій і захищають місце паяння від окислення (наприклад, каніфоль).
Методом паяння можна з’єднати між собою деталі зі сталі, міді, алюмінію, латуні.
При охолодженні (кристалізації) більш легкоплавкого зв’язувального металу, що вступив у взаємодію з паяними металами, утворюється паяне з’єднання. Залежно від застосування припоїв виділяють 3 види паяння, що розрізняються за температурою плавлення та механічною міцністю припоїв: паяння м’якими, твердими та легкими припоями.
Для з’єднання деталей, які не підлягають значним механічним навантаженням, використовують м’які припої (сплав олова зі свинцем) при t до 450˚С. Для паяння м’якими припоями використовують паяльники з червоної (чистої) міді. Мідні паяльники добре нагріваються і зберігають тепло. Нагрівають їх електричним струмом або полум’ям газового пальника. Легкоплавкі припої застосовують для паяння тонких олов’яних предметів, скла з металевою арматурою, деталей, особливо чутливих до перегрівання, а також у тих випадках, коли припій повинен виконувати роль температурного запобіжника, наприклад, в електричних та теплових приладах. Паяння твердими припоями здійснюють за допомогою припоїв, які мають температуру плавлення понад 700˚С.
ІV виступ. Пароутворення і конденсація
Випаровування рідини з її поверхні відбувається за будь-якої температури. Під час випаровування з рідини вилітають найшвидші молекули, а значить зменшується і внутрішня енергія – тобто рідина охолоджується. Швидкість випаровування рідини залежить від її температури, роду рідини, площі поверхні випаровування та наявності потоку повітря (вітру).
А от утворення пари всередині рідини відбувається тільки за певної температури. З наближенням до поверхні рідини, бульбашки, що утворюються в рідині, збільшуються в об’ємі, всередині бульбашки внаслідок випаровування пара стає насиченою. Коли тиск насиченої пари дорівнює атмосферному тиску, бульбашка лопається. Вода починає кипіти.
- Кипіння – це процес внутрішнього випаровування рідини, який супроводжується швидким утворенням і збільшенням бульбашок пари всередині всього об’єму рідини, які спливають назовні.
- Температура, при якій рідина кипить, називають температурою кипіння.
Таблиця 5: Температура кипіння рідин при нормальному атмосферному
тиску
|
Речовина |
|
Речовина |
|
Речовина |
|
|
Азот |
-196 |
Вода |
100 |
Кисень |
-183 |
|
Аміак |
-33 |
Гліцерин |
290 |
Мідь |
2567 |
|
Ацетон |
56 |
Ефір |
35 |
Ртуть |
357 |
|
Бензин |
70…200 |
Залізо |
2750 |
Спирт |
78 |
Речовини, які в звичайних умовах є твердими, перетворюються під час плавлення на рідини, а при продовженні нагрівання ці рідини киплять при дуже високій температурі.
Ті речовини, що в звичайних умовах є газами, при значному охолодженні перетворюються в рідини, що киплять при дуже низькій температурі.
Температура кипіння залежить від зовнішнього тиску. Чим вищий зовнішній тиск, тим температура кипіння вища, і навпаки.
Під час кипіння температура рідини не змінюється.
Щоб рідина, випаровуючись, не змінювала своєї температури, їй треба передавати енергію. Під час кипіння потрібно підводити до рідини певну кількість теплоти, яка йде на збільшення внутрішньої енергії утвореної пари.
- Питомою теплотою пароутворення називають фізичну величину, яка показує, на скільки зростає енергія 1 кг речовини при переході її з рідкого стану в пару без зміни температури.
Позначають питому теплоту пароутворення L. За одиницю вимірювання питомої теплоти пароутворення взято Дж/кг.
Таблиця 6: Питома теплота пароутворення речовин при нормальному
атмосферному тиску
|
Речовина |
|
Речовина |
|
Речовина |
|
|
Азот |
199 |
Вода |
2260 |
Мідь |
4820 |
|
Аміак |
1370 |
Гліцерин |
830 |
Ртуть |
282 |
|
Ацетон |
520 |
Ефір |
355 |
Свинець |
855 |
|
Бензин |
290 |
Залізо |
6120 |
Спирт |
900 |
Оскільки для випаровування 1 кг рідини, взятої при її температурі кипіння, треба затратити кількість теплоти, що дорівнює питомій теплоті пароутворення, то для перетворення на пару масою m потрібна кількість теплоти ![]()
Під час конденсації пари виділяється та сама кількість теплоти, яка була затрачена на її випаровування. Питома теплота пароутворення дорівнює питомій теплоті конденсації. Конденсація пари відбувається за тієї самої температури, що й кипіння, тому температурою конденсації пари є температура кипіння рідини.
Поетапний контроль за якістю засвоєння навчального матеріалу. (ІІІ тур змагання)
(робота в малих групах профільного характеру, час обговорення – 1 хв.)
І група. Майстер виробничого навчання, слюсар, автослюсар
- Питання: Чому лампочка розжарювання з часом стає сірою? Чи рівномірно вона темніє?
- Відповідь: Колба лампи стає темно-сірою, тому що метал випаровується і осідає на склі. Молекули металу піднімаються у верхню частину лампи конвекційними потоками і осідають саме у верхній частині лампи.
ІІ група. Інженер-технолог
- Питання: У кондитерському виробництві воду з розчину цукру випаровують при температурі значно нижчій, ніж 100˚С. Як цього вдається досягти?
- Відповідь: Температуру знижують для того, щоб не підгорав цукор. А досягають цього зниженням тиску в посудинах, де відбувається випаровування.
ІІІ група. Військовий
- Питання: Чому в північних районах користуються не ртутними термометрами, а спиртовими?
- Відповідь: Тому, що температура повітря в цих місцях буває нижчою від температури замерзання ртуті (-39˚С).
ІV група. Пожежний
- Питання: Якою водою краще гасити вогонь: гарячою чи холодною?
- Відповідь: Гасіння вогню супроводжується перетворенням води у пару, що перешкоджає доступу до полум’я. Гаряча вода швидше перетворюється у пару, а тому вона легше гаситиме вогонь.
ІV. Повторення вивчених фізичних величин та формул «Фізичний волейбол».
Викладач у швидкому темпі називає фізичні величини та назви формул, учні дають відповідь.
- Закріплення знань, навичок і вмінь. Розв’язування задач.
Групі пропонується умова задачі, яку необхідно розв’язати двома шляхами:
- Експериментальним.
- Розрахунковим.
Час виконання – 7 хв. Після виконання коментують розв’язок задачі студенти біля дошки.
Підсумок заняття.
Таким чином, у ході інтегрованого заняття - змагання ми повторили, як можна змінити внутрішню енергію тіла під час теплопередачі (в процесі нагрівання й охолодження, плавлення й тверднення, пароутворення, конденсації і згоряння палива). Процес плавлення і тверднення речовини широко використовується в техніці. На них ґрунтується ливарне виробництво, виготовлення різних сплавів.
Якщо в теплообміні беруть участь кілька тіл, то кількість теплоти, що її віддають тіла, внутрішня енергія яких зменшується, має дорівнювати кількості теплоти, одержаної тілами, внутрішня енергія яких збільшується, тобто має місце рівняння теплового балансу, яке лежить в основі розв’язку багатьох практичних задач. Ми побачили це використання у таких професіях, як інженер-технолог, майстер виробничого навчання, слюсар, автослюсар, військовий та пожежний. Матеріал, що вивчається на заняттях фізики використовується у зазначених професіях.
Підведемо підсумки заняття – змагання між групами, студенти яких занурювались у професії:
Зведена таблиця результатів змагання
|
№ туру |
Макс. кількість балів |
І команда |
ІІ команда |
ІІІ команда |
ІV команда |
|
1 |
3 |
|
|
|
|
|
2 |
3 |
|
|
|
|
|
3 |
3 |
|
|
|
|
Домашнє завдання:
І група. Майстер виробничого навчання, слюсар, автослюсар.
Задача. Автомобіль проїхав 60 км, витративши 8 кг бензину. Двигун автомобіля розвивав потужність 45 кВт. З якою швидкістю рухався автомобіль, якщо ККД його двигуна 30%.
ІІ група. Інженер-технолог
Задача. У бак, що містить воду масою 10 кг при температурі 20˚С, кинули шматок заліза масою 2 кг, нагрітий до температури 500˚С. При цьому деяка кількість води перетворилася на пару. Кінцева температура, що встановилася у баці, дорівнює 24˚С. Визначте масу води, що перетворилась на пару.
ІІІ група. Військовий
Задача. Полярники отримують необхідну їм воду, розтоплюючи лід. Скільки гасу буде потрібно спалити, щоб отримати 15 л окропу, якщо температура навколишнього середовища - 40˚С. Вважати, що вода отримує 50 % енергії, що виділяється під час згоряння гасу.
ІV група. Пожежний
Задача. У сніжний замет, що має температуру 0˚С, викинули розпечену до температури 300˚С мідну кулю масою 2 кг. Яка маса снігу, що розтанув?


про публікацію авторської розробки
Додати розробку
