Застосування сульфатної кислоти
Дилема 2.
Ви дізналися, що шкідливі викиди транспортних засобів є однією з основних причин утворення кислотних опадів. Ваші родичі або друзі планують придбати новий автомобіль. Які з цих варіантів ви б порекомендували?
- Автомобіль має бути обладнаним каталітичним конвертером ( конвертер – пристрій, що зменшує токсичність викидів з двигуна внутрішнього згоряння).
Передбачувана відповідь Конвертер зменшує кількість викидів, що спричиняють утворення кислотних опадів, але вартість його обслуговування досить висока. Він практично не впливає на рівень викидів парникових газів і, таким чином, не запобігає глобальному потеплінню.
- Автомобіль повинен мати двигун, що працює на зрідженому газі.
Енергоефективність двигуна на зрідженому газі у 2 рази вища за енергоефективність стандартного бензинового двигун. Такий двигун має низький рівень викидів речовин, що зумовлюють утворення кислотних опадів.
- Автомобіль потрібно заправляти якісним бензином з низьким вмістом сполук Сульфуру.
Рівень викидів сполук Сульфуру в цьому випадку є нижчим, але бензин коштує дорожче.
- Автомобіль повинен мати стандартний дизельний двигун.
Автомобілі, що працюють на дизельному паливі, є енергоефективнішими за звичайні автомобілі. Однак рівень забруднення твердими частками є набагато вищим, що негативно впливає на здоров`я людей. Зараз триває робота над створенням нового покоління екологічно чистих дизельних двигунів.
- Вони можуть розглядати можливість використання нових технологічних підходів: електричний двигун або двигун на етанолі.
Ці варіанти автотранспорту є екологічно чистішими. Такі автомобілі не запущені в серійне виробництво, тому вони не доступні для широкого загалу.
- Вони можуть розглянути можливість придбати гібридний автомобіль, що працює на електроенергії та бензині.
Гібридні автомобілі працюють на електроенергії на невеликій швидкості Це доцільно під час руху в місті) та на звичайному паливі на високих швидкостях, коли воно максимально ефективне. Викидів менше, однак повітря забруднюється. Вартість таких автомобілів зараз набагато вища за вартість звичайних автомобілів.
План-конспект уроку на тему:
Застосування сульфатної кислоти і сульфатів. Охорона навколишнього середовища від забруднення викидами сульфуровмісних речовин
Підготувала і провела
вчитель хімії
Нетішинської зош I-IIIст. №2
Радовинчик
Алла Володимирівна
Нетішин – 2014
Тема: Застосування сульфатної кислоти і сульфатів. Охорона навколишнього середовища від забруднення викидами сульфуровмісних речовин.
Мета уроку:
навчальна: узагальнити знання про склад, фізичні та хімічні властивості, відношення до води сульфатної кислоти; розширити знання про сульфати та їх властивості, практичне застосування сульфатної кислоти та її солей; ознайомити із сировиною та хімічними реакціями, що покладені в основу виробництва сульфатної кислоти, з умовами їх здійснення;
виховна: виховувати бережливе ставлення до оточуючого середовища і власного здоров’я, формувати переконання правильно поводитися з хімічними речовинами в побуті, використовувати їх у відповідності до інструкцій; формувати в учнів екологічне мислення, виховувати свідому громадянську позицію, небайдужість до екологічних проблем нашого регіону та в цілому;
розвивальна: розвивати креативне і критичне мислення, вміння самостійно аналізувати, робити висновки, сприяти розвиткові вміння виділити головне в пізнавальному об’єкті та розглядати його з різних точок зору; формувати вміння швидко і чітко формулювати свої думки, логічно викладати їх і обстоювати свою точку зору; вдосконалювати навики самостійної пошукової діяльності, під час роботи з додатковими джерелами інформації, роботи в групах.
Тип уроку: узагальнення та систематизація знань
Форма проведення: урок-захист проектів
Методичний інструментарій уроку: система запитань та хімічних реакцій до теми, індуктивна техніка вивчення нового матеріалу, захист учнівських проектів, мультимедійна презентація, дилеми, тематичні евристичні бесіди, завдання дослідницького характеру, проблемні ситуації, творчі завдання
Базові поняття: Сульфатна кислота, купороси, залізний колчедан, оксиди, олеум, сірководень, кислотні дощі, смог, екологія.
Очікувані результати навчальної діяльності: сформовані уявлення про практичне значення сполук Сульфуру, їх вплив на навколишнє середовище, причини кислотних дощів, важливість охорони довкілля від забруднення продуктами та відходами хімічних виробництв.
Місце уроку в навчальній темі: поточний.
Обладнання: періодична система хімічних елементів Д. І. Менделєєва, електрохімічний ряд напруг металів, таблиця розчинності кислот, основ та солей, тексти із завданням, пам`ятки для учнів «Що може зробити суспільство для зменшення кислотних опадів?», картки « Дилеми», публікації, комп`ютер, проектор, мультимедійні презентації, зошити.
Девіз уроку:
«Навряд чи знайдеться інша, штучно добута речовина, яка б так часто застосовувалась у техніці, як сульфатна кислота. Там, де технічна діяльність розвинена, там використовується і багато сульфатної кислоти».
Д.І.Менделєєв
Хід уроку
- Організаційний етап.
Доброго дня. Рада бачити вас у доброму здоров`ї та гарному настрої.
Доброго здоров`я, любі учні, Хай сьогодні радісно всім буде, Хай мозок повниться знаннями І щастя у навчанні та житті буде з вами.
Сподіваюся, що сьогоднішній урок не стане цьому на заваді. Отже, я покладаюся на ваші здібності, ваш розум, ваше мислення. А зараз напишіть свої сподівання від уроку і прикріпіть їх до кораблика.
Вчитель демонструє малюнок Річки Очікувань з двома берегами – Берег Сподівань і Берег Звершень. Учні до моделі кораблика прикріплюють свої сподівання від уроку, а в кінці переносять кораблик на другий берег.
На минулому уроці ви познайомилися з фізичними та хімічними властивостями сульфатної кислоти, якісною реакцією на сульфат-йон. Сьогодні повторимо вивчене, адже добування та застосування речовин тісно пов`язане з їх властивостями.
ІІ. Актуалізація опорних знань
- Робота біля дошки.
а) запропонуйте три способи добування алюміній сульфату.
б) напишіть рівняння взаємодії концентрованої сульфатної кислоти з магнієм.
2. Самостійна робота на картках (із взаємоперевіркою)
(відповідь «+» або «-» )
Варіант 1.
- Розчин сульфатної кислоти є слабким електролітом.
- При розчиненні концентрованої H2SO4 кислоту приливають до води.
- Концентрована H2SO4 є дуже леткою.
- Концентрована H2SO4 активно взаємодіє із залізом.
- Розведена H2SO4 не взаємодіє з міддю.
- Розведена H2SO4 змінює забарвлення лакмусу на червоний.
- Якісним реактивом на сульфат-йон є солі Барію.
- Концентрована H2SO4 не дисоціює на йони.
- Внаслідок взаємодії конц. H2SO4 із сріблом одним із продуктів є SO3.
- Розведена H2SO4 не взаємодіє із нерозчинними основами.
- При взаємодії розведеної H2SO4 з металами ніколи не виділяється водень.
Варіант 2.
- Розбавлена сульфатна кислота активно поглинає вологу.
- При розчиненні концентрованої H2SO4 відбувається сильне розігрівання розчину.
- Концентрована H2SO4 обвуглює органічні речовини.
- Концентрована H2SO4 активно взаємодіє із алюмінієм.
- Розведена H2SO4 не взаємодіє з малоактивними металами .
- Розведена H2SO4 не взаємодіє з розчинами солей.
- Олеум – це розчин SO2 у концентрованій H2SO4 .
- Концентрована H2SO4, як і розведена, дисоціює на йони.
- Внаслідок взаємодії конц. H2SO4 з міддю одним із продуктів є H2S.
- Розведена H2SO4 взаємодіє із нерозчинними основами.
- Взаємодія розведеної H2SO4 з металами до Н супроводжується виділенням водню.
Ключ до розв`язку
1 варіант.
1 2 3 4 5 6 7 8 9 10 11
- + - - + + + + - - -
2 варіант.
1 2 3 4 5 6 7 8 9 10 11
- + + - + - - - - + +
ІІІ. Мотивація навчальної діяльності.
Розпочинаючи вивчення неметалічних елементів, не раз розмірковували: «Чи справді сполуки Сульфуру, зокрема сульфатна кислота і сульфати мають таке велике значення у розвитку промисловості та сільського господарства? Як впливають викиди сульфуровмісних речовин на довкілля?» Було поставлено завдання дослідити дані питання.
Як сказав видатний педагог Йоганн Генріх Песталоцці, «мої учні дізнаватимуться про нове не від мене, вони відкриватимуть це нове самостійно; моє основне завдання – допомогти їм розкритися». Сьогоднішній урок має стати цьому підтвердженням.
Наші пошуковці розділились на три групи, а саме:
«Технологів», які вивчали питання відкриття сульфатної кислоти та її добування в промисловості;
«Дослідників», які досліджували значення сульфатної кислоти і сульфатів у промисловості та сільському господарстві;
«Екологів», які вели дослідження щодо впливу на природні процеси сульфуровмісних речовин.
Створена експертна група, яка здійснювала керівництво пошуковою діяльністю та підвела підсумок дослідження у вигляді публікації.
IV. Представлення результатів дослідження (захист проектів)
Завдання для учнів:
- Конспект основних тез проекту, висновків;
- Участь в обговоренні питань проекту.
Отже, слово групі технологів
«Технологи».
Метою нашого дослідження було прослідкувати, коли з`явилися перші згадки про сульфатну кислоту, етапи їх розповсюдження та способи промислового виробництва кислоти. Капітан «Технологів» ілюструє зміст інформації, яка була досліджена. (Мультимедійна презентація. Додаток 1)
Сульфатна кислота (або стара назва — купоросне масло) була відома з давніх часів. Перші згадки про неї можна знайти в текстах алхіміка Джабіра ібн Хайяна VІІІ ст. Можливі методи виробництва описані в працях Альберта Великого (1200–1280) і Василя Валентина (1600). В основі цього методу лежить утворення кислоти з хальканинту, та галунів. Застаріла назва походить від застарілої назви мінералів, з яких вона отримувалася —купороси.
Перші наукові дослідження за допомогою сульфатної кислоти провів Йоганн Рудольф Ґляубер. Він провів реакцію між сульфатною кислотою і сіллю та отримав хлоридну кислоту і сіль, яка була названа на його честь — глауберова сіль.
Виробництво сульфатної кислоти у ХVІІІ столітті
Сульфатна кислота була відома ще і середньовіччі, але отримували її з оксидів, що утворюються при спалюванні мінеральної сірки в скляних посудинах. У 1746 році Джон Робак замінив їх на більш об'ємні, виготовлені з листів свинцю, що значно збільшило ефективність процесу (приблизно 50 кг за один процес, принаймі вдесятеро більше, ніж раніше). Сульфатна кислота, одержана за процесом Джона Робака, мала концентрацію тільки 35-40%.
Пізніше поліпшення методу французьким хіміком Жозефом Луї Гей-Люссаком і англійським Джоном Гловером дало вихід кислоти 78% концентрації.
Протягом ХVІІІ ст. сульфатна кислота отримувалася сухою перегонкою мінералів, процес схожий на оригінальні алхімічні процеси.
У 1831 році британський купець Перегрін Філліпс запатентував контактний процес, який був більш економічний. Сьогодні майже вся сульфатна кислота у світі виробляється з використанням цього методу.
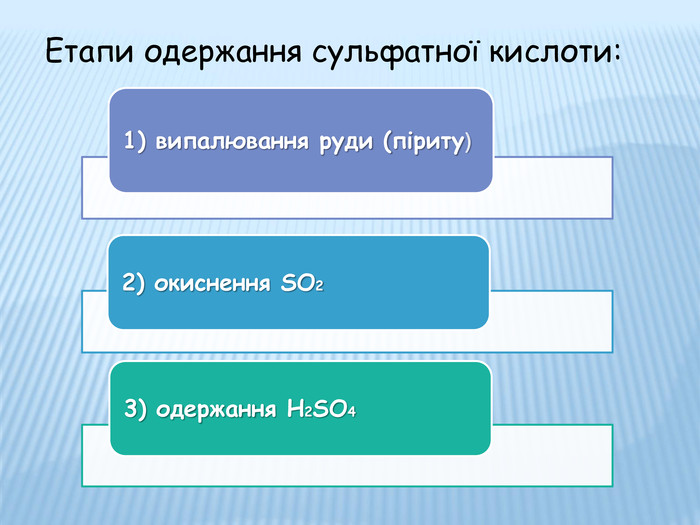
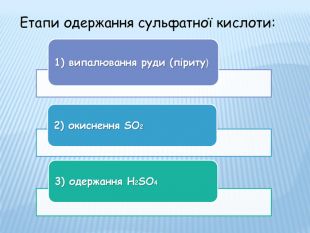
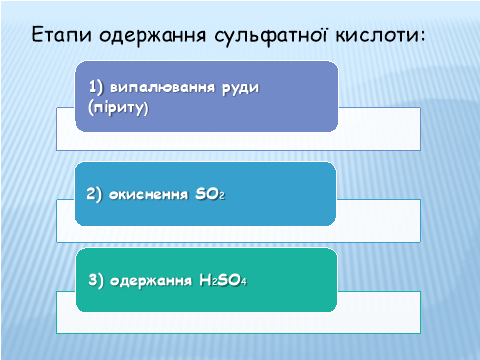
Етапи одержання сульфатної кислоти:
1) Випалювання руди (піриту)
Одержання сульфур (IV) оксиду, якщо сировиною є пірит (колчедан):
2FeS2 + 11O2 → 2Fе2O3 + 8SO2 + Q
Реакцію проводять за таких умов, щоб Сульфур, який міститься в колчедані, найбільш повно використовувався для одержання сульфур (ІV) оксиду. Реакція протікає швидко, особливо якщо обпалювання проводять не повітрям, а киснем. Утворюється «киплячий шар» — у печі обпалювання цей процес триває кілька секунд
2) Окиснення діоксиду сульфуру і добування триоксиду сульфуру:
2SO2 + O2 → 2SO3 + Q
Каталізатори:V2O5, Pt
Характеристика етапу:
а) очищення SO2 від домішок: твердих — циклон-апарат, рідких — електрофільтр;
б) осушування газу (принцип протитечії);
в) утворення SO3 — контактний апарат. Метод одержання сульфатної кислоти називають контактним, оскільки взаємодія газів відбувається на поверхні твердого каталізатора.
3) Одержання H2SO4
SO3 + Н2О = H2SO4
Добутий у контактному апараті триоксид сульфуру SO3 надходить у поглинальну башту — абсорбер, де поглинається концентрованою сульфатною кислотою. В абсорбері SO3 взаємодіє з водою, що міститься у концентрованому розчині сульфатної кислоти, утворюючи безводну, 100%-ву сульфатну кислоту, яка називається моногідратом.
Запитання доповідачам
- Де застосовують в подальшому ферум (III) оксид, який одержують в процесі випалювання піриту?
- Якими за тепловим ефектом є процеси добування сульфатної кислоти?
- Які є методи окиснення сірчистого газу?
- Чому сульфур (VI) оксид розчиняють не у воді, а в сульфатній кислоті?
«Дослідники».
Мета нашого дослідження — обґрунтувати особливе значення сульфатної кислоти і сульфатів для розвитку різних галузей промисловості та сільського господарства. Представлення інформації, яка була одержана під час дослідження. (Мультимедійна презентація. Додаток 2)
Світове виробництво сульфатної кислоти
Сульфатна кислота є дуже важливою речовиною у хімічній промисловості і виступає індикатором її промислової потужності. Світове виробництво приблизно має наступний географічний розподіл:
Азія 35%
Північна Америка 24%
Африка 11%
Західна Європа 10%
Східна Європа і Росія 10%
Австралія і Океанія 7%
Південна Америка 7%
Використання сульфатної кислоти
Близько 20% використовується в хімічній промисловості для виробництва:
- миючих засобів,
- синтетичних смол,
- барвників,
- фармацевтичних препаратів,
- інсектицидів,
- антифризу.
- Близько 6% використовують для виробництва пігментів, фарб, емалей, типографських фарб. Використовується також як осушувач газів.
- Добування інших кислот: H3PO4, HCl, CH3COOH.
- Виготовлення мінеральних добрив, головним чином суперфосфату.
- Сульфатна кислота діє як електроліт в свинцево-кислотних акумуляторах
- Сульфатна кислота використовується в нафтопереробній промисловості в якості каталізатора реакції утворення ізобутану з ізобутилену,
- для утворення ізооктану (сполуки, що підвищує октанове число бензину).
Сульфати у природі
- MgSO4х7H2O – гірка сіль, застосовують як проносне, жовчогінний засіб, ліки проти правця, кору, в разі гіпертонії, судом різного походження.
- Na2SO4х10H2O – мірабіліт, або глауберова сіль. На початку XVII ст. в Німеччині тяжко хворий Йоган-Рудольф Глаубер почав пити воду з одного із джерел і вилікувався. Дослідивши дану сіль, на пам’ять про своє видужання Глаубер назвав її чудовою сіллю, або мірабалітом. Також Na2SO4 використовують для виготовлення скла, сірки, амоній сульфату, у паперовій промисловості.
- ZnSO4 x H2O – цинк сульфат. Входить до складу очних крапель як засіб для лікування кон`юктивітів.
- MnSO4 – манган сульфат проявляє себе у лікуванні атеросклерозу.
- CaSO4х2H2O - гіпс
- Широко використовують у медицині для гіпсових пов`язок у разі переломів кісток;
- Гіпсування грунтів (як сульфатне добриво, для усунення лужності, поліпшення структури грунтів);
- У будівництві (гіпсокартон, перегородкові панелі, суха штукатурка) ;
- CuSO4х5H2O - мідний купорос. Застосовують:
- Засіб для запобігання гниттю речовин;
- Знезаражувальний засіб у сільському господарстві;
- У будівництві: для нейтралізації наслідків протікань; для ліквідації плям іржі; для видалення ”висолів” з поверхонь.
Галуни – кристалогідрати подвійних солей
- K2SO4хAl2(SO4)3х24H2O(KАl(SO4)2х12H2O) – алюмокалієві галуни – кровоспинний засіб
- K2SO4хCr2(SO4)3х24H2O – хромокалієві галуни – вичинка шкіри, “хромові чоботи ”.
Запитання доповідачам
- Для добування яких кислот застосовують сульфатну кислоту?
- Що таке квасці?
- Чим гіпс відрізняється від алебастру?
- Яке походження поняття « купороси»?
«Екологи».
Наша група поставила за мету дослідити вплив викидів сульфуровмісних речовин на навколишнє середовище, а також розглянути шляхи вирішення даної проблеми. Підсумком нашої роботи є створення презентації. (Мультимедійна презентація. Додаток 3)
Небезпечні фактори забруднення середовища
У сучасних індустріальних країнах основними хімічними забруднювачами повітря є:
- діоксид Карбону;
- сполуки Сульфуру;
- оксиди Нітрогену
Основні хімічні забруднювачі атмосферного повітря, поступаючи безпосередньо в атмосферу, швидко змішуються з повітрям нижніх шарів атмосфери (тропосфери). За певних умов, деякі з них вступають у хімічні реакції з іншими забруднювачами або з основними компонентами повітря (киснем, азотом, водяною парою), утворюючи нові, так звані вторинні забруднювачі. Один з найтиповіших прикладів – утворення кислотних опадів.
Кислотні дощі
Кислотоутворюючі речовини (оксиди Сульфуру та Нітрогену) можуть перебувати у повітрі досить довго та переміщатися на великі відстані. Сульфур (IV) оксид та оксиди Нітрогену, розчиняючись у краплинах атмосферних опадів, в результаті складних реакцій окиснюються і перетворюється на сульфатну та нітратну кислоти, що випадають на Землю у вигляді кислотних опадів – дощів, снігу, роси, туману – та змінюють кислотний склад грунтів та води.
Вплив кислотних дощів
Кислотні опади впливають на екосистеми та призводять до підкислення. Наслідком цього є:
-- загибель лісів у Центральній та Східній Європі;
-- велика кількість мертвих озер у Скандинавії та Альпах;
-- роз'їдання металів, фарб, синтетичних сполук;
-- руйнування архітектурних пам'ятників. (За матеріалами «Зеленого пакету»)
Багато скульптур і будинків в Римі, Венеції й інших містах, пам'ятники зодчества, такі, як Акрополь в Афінах, Кельнський собор та інші, за кілька останніх десятиліть одержали значно більші ушкодження, ніж за весь попередній час. (Відеофрагмент матеріалів «Зеленого пакету» ( диск № …1)
Смог
Вели́кий смог огорнув Лондон 5 грудня 1952 року і розвіявся тільки до 9 грудня. Ця подія стала справжньою екологічною катастрофою, в результаті якої загинуло 12000 людей. Вважається, що Великий смог став відправною точкою сучасного природоохоронного (екологічного) руху Англійські спеціалісти визначили, що смог містив кілька тонн диму з сульфур (IV) оксидом.
Сірководень H2S
Сірководень — безбарвний, дуже отруйний, горючий газ з характерним неприємним запахом тухлих яєць. Сірководень зустрічається у вулканічних газах, а також у воді деяких мінеральних джерел.
Фізіологічна дія H2S
Сірководень належить до акумулятивних отрут, що поступово накопичуються в організмі. Тривале вдихання повітря, що містить цей газ навіть в невеликих кількостях, спричинює сильні отруєння
Характерною особливістю Чорного моря є повна (за винятком ряду анаеробних бактерій) відсутність життя на глибинах понад 150-200 м за рахунок насиченості глибинних шарів води сірководнем.
Хімічна промисловість України, як і решта галузей промисловості, за радянських часів розвивалася, задовольняючи насамперед потреби Москви. Тому її структура нині не зовсім відповідає потребам народного господарства нашої країни. Крім того, у спадок від командно-адміністративної системи країні Дісталися підприємства здебільшого із застарілим устаткуванням 1 мало ефективними очисними системами. Тому розвиток хімічної промисловості України за ринкових відносин починає чимдалі більше залежати від екологічних проблем. Для поліпшення становища потрібні кошти і значні організаційні заходи.
Попередження забруднення атмосфери
- Своєчасний ремонт апаратури;
- Встановлення фільтрів, поглиначів, вентиляції;
- Суворе дотримання технологічного режиму;
- Удосконалення і автоматизація виробничих процесів;
- Герметизація устаткування;
- Впровадження принципу безвідходності;
- Ефективні методи очищення вихідних газів.
Запитання доповідачам
- Де можна використати сульфур (IV) оксид, що вловлюється фільтрами та є побічним продуктом промисловості?
- Які природні джерела надходження сульфур (IV) оксиду?
- Яким би було pH середовища дощу, якби повітря було ідеально чистим?
- Чи може закриття підприємств вирішити екологічні проблеми?
Робота учнів класу з інформаційним матеріалом «Що може зробити суспільство для зменшення кислотних опадів?»
«Мозковий штурм». Яких заходів можна вжити для запобігання підкисленню?
Пам`ятка для учнів
Що може зробити суспільство для зменшення кислотних опадів?
- Раціональне використання аміачних добрив та їх належне зберігання.
- Просування та розробка електричних та гібридних транспортних засобів для зменшення викидів.
- Використання природного газу замість твердого палива.
- Посилення теплоізоляції будинків та обладнання.
- Ширше використання відновлювальних джерел енергії – сонця, вітру, води, біомаси, геотермальних джерел енергії, приливно-відпливних течій тощо
- Облаштування автодвигунів каталітичними перетворювачами, запровадження на підприємствах і теплоелектростанціях систем очищення повітря.
- Очищення палива від Сульфуру перед використанням.
- Сприяння запровадженню енергоефективних технологій та користуванню громадським транспортом.
- Ухвалення суворих нормативно-законодавчих актів щодо транспортних засобів.
- Демонстрація переваг залізниці та водного транспорту перед автотранспортом.
- Заохочення використання велосипедів для пересування на невеликі та середні відстані у містах.
- Обмеження на викиди повітряного транспорту на міжнародному рівні.
«Експертна група».
Завданням нашої групи було слідкувати за ходом досліджень та узагальнити добуту інформацію. Підсумком нашої роботи є створена публікація «Її величність Сульфатна кислота». (Мультимедійна презентація. Додаток 4)
Додаткова інформація. (Мультимедійна презентація. Додаток 5)
ЧИ Є ЖИТТЯ У КОНЦЕНТРОВАНІЙ СУЛЬФАТНІЙ КИСЛОТІ?
Вулканічне кратерове озеро Каваг Ієн на острові Ява, що в Індонезії, переповнене концентрованою сульфатною кислотою – найбільша природна кислотна водойма у світі. За концентрацією кислоти у його водах немає аналогів у світі – ph становить 0,3. Подібними до нього є, хіба, арґентинські ріка Аґріо (ph 0,37) та озеро Кавіагве (ph 2,5), які пов’язані із вулканом Копагве. Вода у цих водоймах кисла, то ж зрозуміло, що біологічні тканини, не те що живі орґанізми, у кислотних водоймах руйнуються і не можуть жити… Наявність археїв та відсутність бактерій у озері пов’язана, у першу чергу, із високою концентрацією сульфатної кислоти, а як відомо, археї є визнаними екстремофілами. Вони живляться за рахунок хемосинтезу, метаболізуючи сполуки заліза та сірки.
Біологам вдалось виявити цілі екосистеми мікроорґанізмів, які населяють саме озеро Каваг Ієн та ріку Банюпагіт-Банюпутіг, яка витікає з нього. Вони знайшли тут угруповання лише 3 видів археїв, які здатні виживати у його екстремально токсичних умовах. Яким чином мікроорґанізми, що живуть на глибинах понад 2000 м під поверхнею океану потрапили у високогірне озеро на висоті 2700 м над морем, залишається незрозумілим.
ВИПАДКОВІ ВІДКРИТТЯ
Речовина Куртуа
Якось, зачиняючи аптеку, аптекар Куртуа вирішив вигнати кішку на вулицю. Перелякана кішка стрибнула з полиці й перекинула склянку з концентрованою сульфатною кислотою. Склянка впала, розбилася, кислота пролилася на попіл із водоростей. Здивований аптекар відразу побачив фіолетовий дим.
Так випадково було відкрито нову речовину — йод («йодос» перекладається як фіолетовий).
V. Створення і розв`язання дилеми (матеріали «Зелений пакет «Дилеми»)
Дилема 1.
Уявіть, що ви – Міністр екології та природних ресурсів України і бажаєте зменшити обсяги атмосферного забруднення. Ваші експерти пропонують вам кілька альтернатив. Яку з цих альтернатив ви вважаєте найефективнішою?
- Підвищити ціни на електроенергію, щоб сприяти її меншому використанню, а відтак – меншому забрудненню.
Передбачувана відповідь. Ці витрати можна перекласти з виробника енергії на споживачів. Можливо, варто з`ясувати електроефективність побутових приладів, що відповідають за «реальне» споживання електроенергії.
- Закрити старі промислові заводи, що спричиняють значне забруднення атмосферного повітря.
Передбачувана відповідь. Завдяки цим заходам можна припинити забруднення, особливо на місцевому рівні. Але ці заходи можуть спричинити скорочення робочих місць та бути непопулярними.
- Скоротити дозволені рівні атмосферного забруднення, особливо діоксиду сульфуру, оксидів нітрогену та викидів пилу.
Передбачувана відповідь. Чи ви замислювалися над тим, яким чином визначають прийнятні рівні викидів? Ці норми буде складно впроваджувати, оскільки вони вимагають значних інвестицій і навіть закриття заводів.
- Сприяти впровадженню нових технологій та обладнання для скорочення викидів.
Передбачувана відповідь. Це передбачає стимулювання, надання заводам фінансової підтримки (наприклад, пільгових банківських позик), значні інвестиції в розвиток «зелених технологій»
VI. Узагальнення та систематизація знань
- Письмова вправа «Сніжний ком»
Знайти генетичний звязок сірки з її сполуками за схемою і відобразити його у вигляді молекулярних рівнянь:
S→H2S → SO2 →SO3 → H2SO4→ SO2 → Na2SO3 → SO2 → CaSO3
- Інтерактивна гра «Мікрофон».
а) Давайте поміркуємо, де і як ми зможемо використати свої знання на практиці?
б) Які професії пов’язані з темою уроку?
в) Підсумуйте, що вам найбільше запам`яталося із вивченого про сульфатну кислоту та її похідні.
VII. Підведення підсумків уроку, оцінювання роботи учнів.
1. Завдання: складіть сенкан «Сульфати», дотримуючись таких правил-орієнтирів:
- Перший рядок складається з одного слова (іменника) – назва поняття, терміна, теми.
- У другому рядку представлено опис, який складається з двох слів (прикметників).
- У третьому рядку визначені характерні властивості. Він складається з трьох слів (дієслів).
- У четвертому рядку формується фраза, яка складається з чотирьох слів і розкриває ставлення до теми.
- П'ятий рядок складається з одного слова (синоніма до теми), в якому відбита сутність предмета або сформульовано висновок.
Наприклад: Сульфати
Середні, кислі
Будують, знезаражують, лікують
Якісна реакція з солями барію
Купороси
- Перенесення кораблика до берега Звершень, визначення здійснення сподівань.
- Оцінювання навчальних досягнень учнів (Враховуючи вашу роботу на різних етапах уроку я ставлю такі оцінки….Значно краще, ніж завжди, сьогодні на уроці працювали …………А від учнів ………я чекала більшої активності та вищих результатів роботи
- Побажання учням:
І повітря, і вода –
Взагалі природа вся!
Хімію вивчай охоче –
І в халепу ти не вскочиш.
Будеш знать про неї все,
Вона користь принесе.
VIII. Домашнє завдання
- Прочитати параграф 9 (ст.68-70)
- Знайти інформацію (зробити припущення) про те, викиди яких підприємств у їхній місцевості можуть викликати кислотні дощі.
- Обговорити з батьками «Дилему 2» та можливі шляхи її вирішення.
Використана література
- Попель П. П., Крикля Л.С. Підручник Хімія 10 клас.—К.: ВЦ «Академія», 2010.
- Зелений пакет. Посібник для вчителя. -- Regional environmental center ОБСЄ, ст. 192-194.
- Зелений пакет. Дилеми. Посібник для вчителя
- Хімія: Довідник для абітурієнтів та школярів загальноосвітніх навчальних закладів: навч.-методичний посібник. – К.: Літера ЛТД, 2009.
- Слободяник М.С., Гордієнко О.В.та ін. Хімія. Посібник для старшокласників, вчителів, абітурієнтів.-- К.: «Либідь», 2003.
- Березан О. Збірник задач з хімії. – Тернопіль: Підручники і посібники, 2009.
- Хомченко Т.П. Посібник з хімії. -- Київ: «Вища школа», 1999.
.
Інтернет-видання
- http://rmworld.ru/publ/15-1-0-1861
- http://ido.tsu.ru/schools/chem/data/res/neorg/uchpos/text/g3_5_19.html
- http://ru.wikipedia.org/wiki/%D0%A1%D0%B5%D1%80%D0%BD%D0%B0%D1%8F_%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D0%B0
- http://festival.1september.ru/
.
Додаток1
Мультимедійна презентація
« Добування сульфатної кислоти»







Додаток 2
Мультимедійна презентація
« Застосування сульфатної кислоти і сульфатів»














.
Додаток 3
Мультимедійна презентація
«Забруднення навколишнього середовища сульфуровмісними сполуками»










Додаток 5
Додаткова інформація.




Дилема 2. (Для обговорення вдома з батьками)
Ви дізналися, що шкідливі викиди транспортних засобів є однією з основних причин утворення кислотних опадів. Ваші родичі або друзі планують придбати новий автомобіль. Які з цих варіантів ви б порекомендували?
- Автомобіль має бути обладнаним каталітичним конвертером ( конвертер – пристрій, що зменшує токсичність викидів з двигуна внутрішнього згоряння).
Передбачувана відповідь Конвертер зменшує кількість викидів, що спричиняють утворення кислотних опадів, але вартість його обслуговування досить висока. Він практично не впливає на рівень викидів парникових газів і, таким чином, не запобігає глобальному потеплінню.
- Автомобіль повинен мати двигун, що працює на зрідженому газі.
Енергоефективність двигуна на зрідженому газі у 2 рази вища за енергоефективність стандартного бензинового двигун. Такий двигун має низький рівень викидів речовин, що зумовлюють утворення кислотних опадів.
- Автомобіль потрібно заправляти якісним бензином з низьким вмістом сполук Сульфуру.
Рівень викидів сполук Сульфуру в цьому випадку є нижчим, але бензин коштує дорожче.
- Автомобіль повинен мати стандартний дизельний двигун.
Автомобілі, що працюють на дизельному паливі, є енергоефективнішими за звичайні автомобілі. Однак рівень забруднення твердими частками є набагато вищим, що негативно впливає на здоров`я людей. Зараз триває робота над створенням нового покоління екологічно чистих дизельних двигунів.
- Вони можуть розглядати можливість використання нових технологічних підходів: електричний двигун або двигун на етанолі.
Ці варіанти автотранспорту є екологічно чистішими. Такі автомобілі не запущені в серійне виробництво, тому вони не доступні для широкого загалу.
- Вони можуть розглянути можливість придбати гібридний автомобіль, що працює на електроенергії та бензині.
Гібридні автомобілі працюють на електроенергії на невеликій швидкості Це доцільно під час руху в місті) та на звичайному паливі на високих швидкостях, коли воно максимально ефективне. Викидів менше, однак повітря забруднюється. Вартість таких автомобілів зараз набагато вища за вартість звичайних автомобілів.


про публікацію авторської розробки
Додати розробку