Оксиди неметалічних елементів
10 клас
Тема. Оксиди неметалічних елементів. Кислотний характер оксидів та гідратів оксидів неметалічних елементів.
Мета уроку: поглибити знання учнів про оксиди, їх класифікацію, удосконалити навички складання рівнянь хімічних реакцій з участю оксидів неметалів;
розвивати в учнів розуміння причинно-наслідкових зв’язків між складом, будовою, властивостями та застосуванням речовин, логічне мислення, вміння порівнювати та спостерігати;
формувати пізнавальний інтерес та інтерес до вивчення предмета.
Обладнання: колба , сірка, вода, лакмус, розчин натрій гідроксиду, ложка для спалювання .
Тип уроку: урок вивчення нового матеріалу.
Методи і форми роботи: інтерактивна вправа «Мозковий штурм», гра, розповідь, досліди.
Девіз уроку: Працюючи від душі, ви зробите все і для близьких, і для себе ,
а якщо при цьому успіху не буде,
спробуйте ще раз.
(Д. І. Менделєєв.)
Хід уроку
І. Організаційний етап.
Створення емоційного настрою.
Учитель. Добрий день,учні. Доброго вам здоров’я, настрою! На початку уроку хочу прочитати вам слова відомого російського ученого Д.І.Менделєєва: «Головний секрет життя: одна людина – нуль, разом тільки – люди», «Праця, праця, не будь – яка, а свідома, осмислена, потрібна людям. Працюючи самі, ви зробите все і для своїх близьких і для себе, а якщо при цьому успіху не буде, а буде невдача – не біда, спробуйте ще раз».
ІІ. Перевірка домашнього завдання
Хімічний диктант( відповідь «так» або «ні»)
- У сполуках неметалічних елементів з Гідрогеном зв`язок йонний (-)
- Тривіальна назва хлоридної кислоти – соляна (+)
- Якісним реактивом на хлориди є сіль арґентуму (+)
- Метан добре розчиняється у воді (-)
- Побутова назва розчину амоніаку – нашатирний спирт (+)
- Розчин амоніаку не взаємодіє з кислотами (-)
- Водний розчин амоніаку виявляє основні властивості (+)
- Хлоридна кислота входить до складу шлункового соку (+)
- Концентрована хлоридна кислота переважно 90% (-)
- Лакмус у водному розчині амоніаку червоніє (-)
- Якісним реактивом на солі амонію є розчин лугу (+)
- Амоніак застосовують як холодоагент (+)
ІІ. Актуалізація опорних знань.
Учитель.
Завдання. Записати на дошці формули даних оксидів за їх назвами.
Мозковий штурм «Поговоримо про оксиди»
1.Які речовини називають оксидами?
2.Які за характером бувають оксиди?
3.Які речовини утворюються в результаті взаємодії їх з водою?
4. Наведіть приклад хімічної реакції взаємодії оксиду активного металу з водою. Дайте назву утвореній речовині.
5. Наведіть приклад хімічної реакції взаємодії оксиду неметалу з водою. Дайте назву утвореній речовині.
6. Наведіть приклади оксидів, які мають практичне значення для людини.
ІІІ. Мотивація навчальної діяльності учнів.
Гра «Третій зайвий»
( Пояснити, чому зайвий)
Na2O SO3 BaO
MgO SO2 FeO
K2O P2O5 CaO
Отже, в кожному рядку ви виділили оксид неметалу. Вам відомо, що оксиди неметалів становлять цілу групу речовин з характерними для них властивостями. Сьогодні нам потрібно узагальнити знання про дані оксиди, показати їх зв’язок з іншими речовинами, зокрема з гідратами даних оксидів.
ІІІ. Вивчення нового матеріалу.
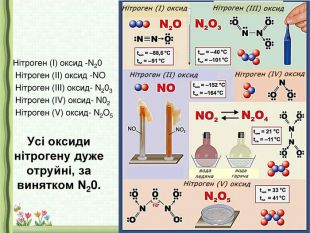
1. Оксиди неметалічних елементів.
Учитель. Розглянемо склад та властивості оксидів елементів ІІІ періоду:
Na2O MgO Al2O3 SiO2 P2O5 SO3 Cl2O7
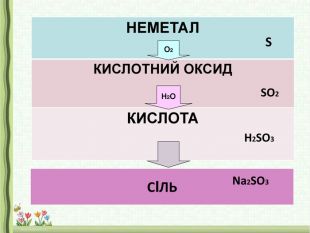
У періоді зліва направо властивості елементів змінюються від металічних до неметалічних, а в складних речовин, оксидів – від основних до кислотних. Кислотні оксиди знаходяться в кінці періоду.
2.Кислотний характер оксидів неметалічних елементів.
Демонстрація №1.
Спалювання сірки і доведення кислотного характеру утвореного оксиду.
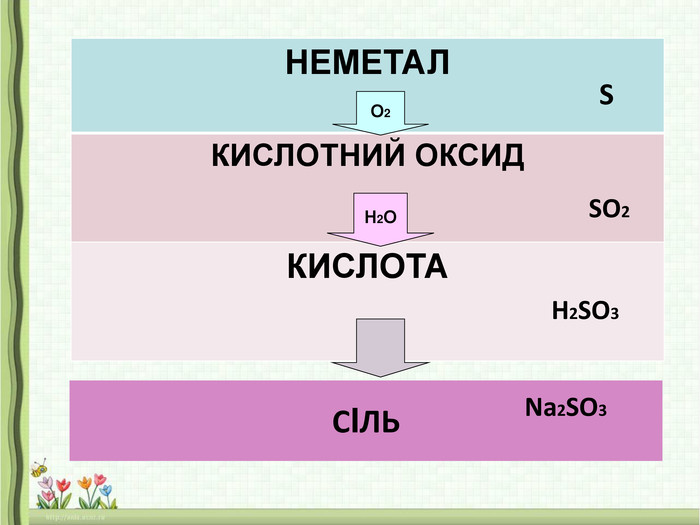
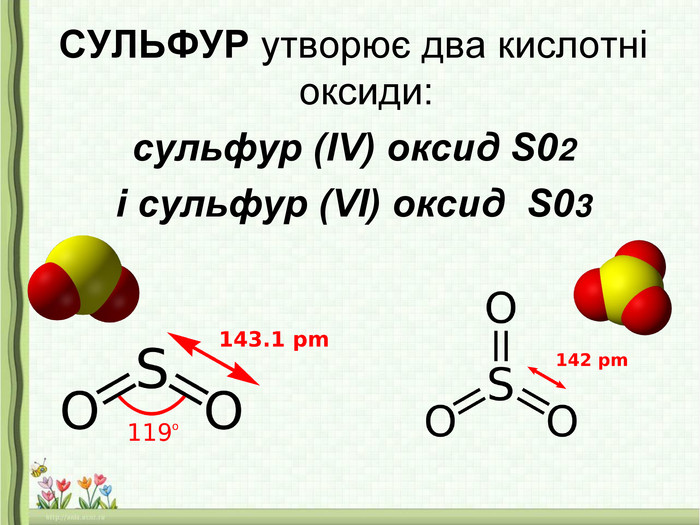
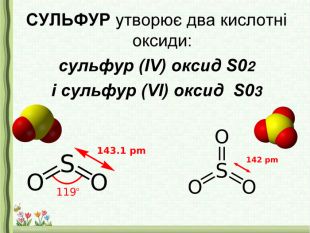
- Сірку помістити у залізну ложечку і внести у полум’я пальника. Сірка спочатку розплавиться, далі почне горіти. Внести сірку у посудину з киснем, горіння посилиться, синювате полум’я стане яскравим. При цьому утвориться газ з різким запахом – сульфур (IV) оксид SO2:
S + O2 = SO2
- У посудину з сульфур (IV) оксидом доливаємо невелику кількість води.
- Через деякий час до утвореної речовини доливаємо невелику кількість індикатора – лакмусу.
- Спостерігаємо появу червоного забарвлення, робимо висновки.
Висновок: поява червоного забарвлення лакмусу свідчить про кисле середовище, отже утворилася кислота – сульфітна.
SO2 + Н2O = Н2 SO3
Отже, оксиди неметалів при взаємодії з водою утворюють кислоти.
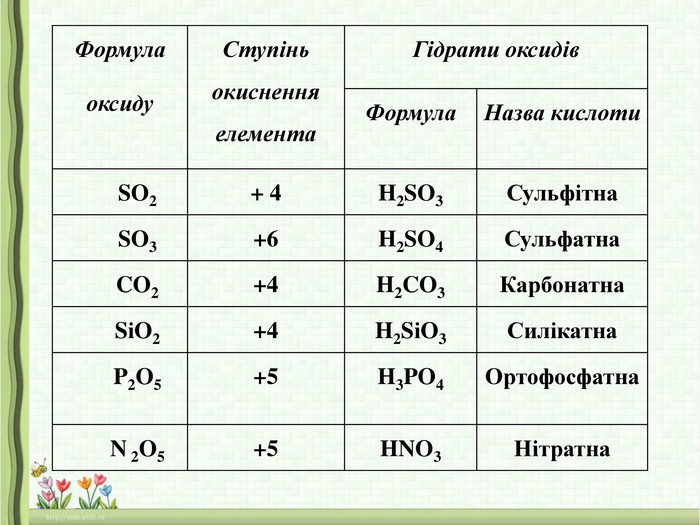
|
Формула оксиду |
Ступінь окиснення неметалічного елемента |
Гідрати оксидів |
|
|
Формула |
Назва кислоти |
||
|
SO2 |
+ 4 |
H2SO3 |
Сульфітна |
|
SO3 |
+6 |
H2SO4 |
Сульфатна |
|
CO2 |
+4 |
H2CO3 |
Карбонатна |
|
SіO2 |
+4 |
H2SіO3 |
Силікатна |
|
P2O5 |
+5 |
H3PO4 |
Ортофосфатна |
|
N 2O5 |
+5 |
HNO3 |
Нітратна
|
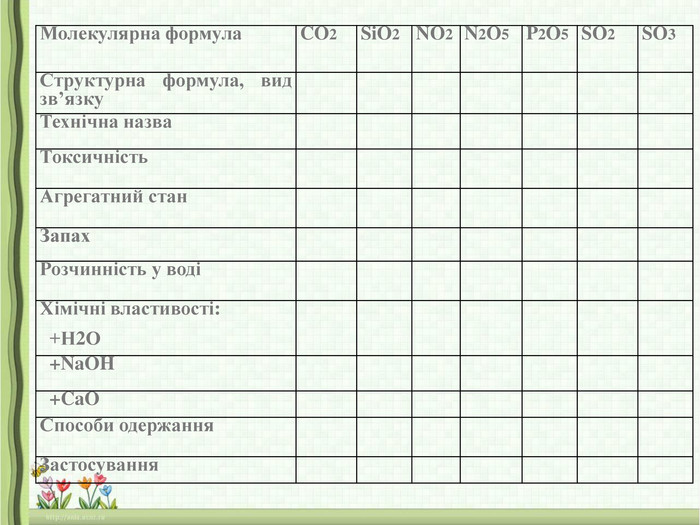
Завдання: Скласти таблицю «Властивості оксидів»
|
Молекулярна формула |
CO2 |
SiO2 |
NO2 |
N2O5 |
P2O5 |
SO2 |
SO3 |
|
Структурна формула, вид зв’язку |
|
|
|
|
|
|
|
|
Технічна назва |
|
|
|
|
|
|
|
|
Фізичні властивості: |
|
|
|
|
|
|
|
|
Агрегатний стан |
|
|
|
|
|
|
|
|
Запах |
|
|
|
|
|
|
|
|
Розчинність у воді |
|
|
|
|
|
|
|
|
Токсичність |
|
|
|
|
|
|
|
|
Хімічні властивості: +Н2О |
|
|
|
|
|
|
|
|
+NaOH |
|
|
|
|
|
|
|
|
+CaO |
|
|
|
|
|
|
|
|
Способи одержання |
|
|
|
|
|
|
|
|
Застосування |
|
|
|
|
|
|
|
Завдання.
Напишіть рівняння реакцій взаємодії фосфор (V) оксиду та сульфур (VІ) оксидів з водою. Дайте назви утвореним речовинам.
Після виконання завдання учні формулюють загальний висновок:
Оксиди та гідрати оксидів неметалів проявляють кислотний характер.
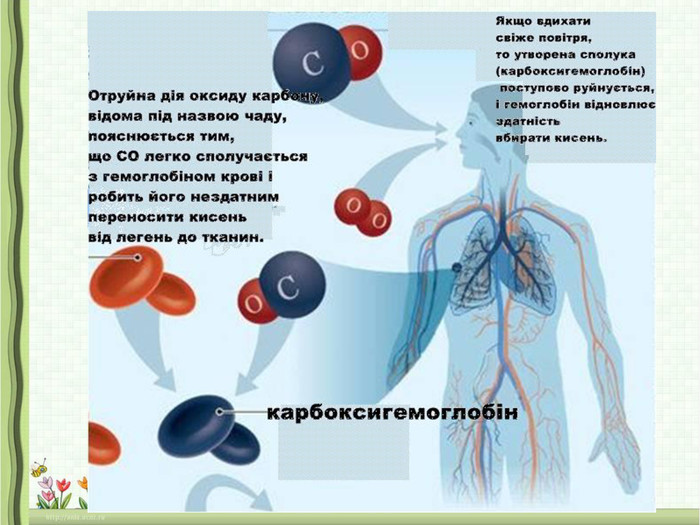
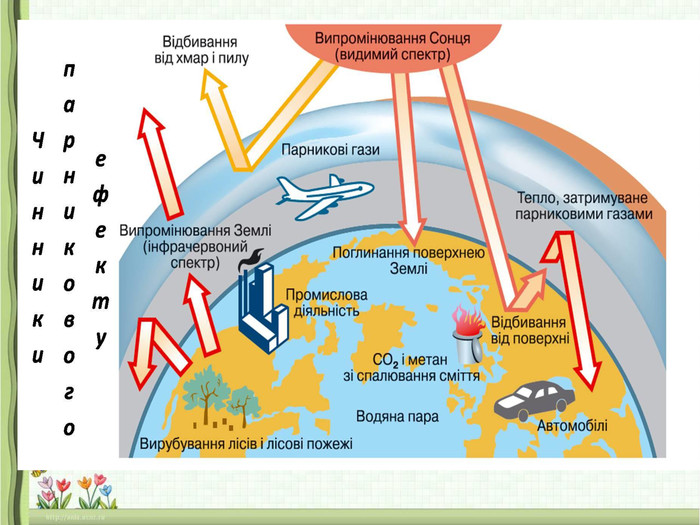
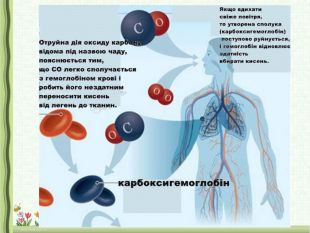
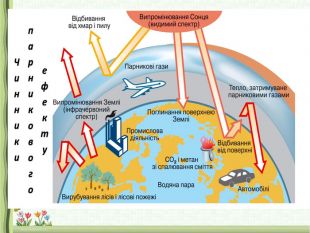
3.Значення оксидів. Поняття про кислотні дощі, парниковий ефект (повідомлення учнів)
ІV. Закріплення нового матеріалу, рефлексія.
Завдання.
З якими із нижче вказаних речовин взаємодіє карбон (ІV) оксид: фосфор (V) оксид, магній, натрій оксид, хлоридна кислота, кальцій оксид, калій гідроксид, розчин натрій карбонату, кальцій гідроксид. Напишіть рівняння реакцій, вкажіть назви продуктів реакцій.
Завдання.
З якими із нижче вказаних речовин взаємодіє сульфатна кислота: натрій оксид, хлороводневі кислота,магній гідроксид, розчин натрій карбонату. Напишіть рівняння реакцій, вкажіть назви продуктів реакцій.
V. Домашнє завдання.
З якими із перерахованих речовин реагуватиме:
А) ортофосфатна кислота; Б) сульфур (VІ) оксид? MgO, KOН, P2O5 , CaO, SO2, Fe(OН)2.
Напишіть рівняння відповідних реакцій, назвіть отримані речовини.


про публікацію авторської розробки
Додати розробку