Збірка завдань по підготовці до ІІ етапу олімпіад з хімії 7 клас
Завдання
ІІ етапу Всеукраїнської учнівської олімпіади з хімії
7 КЛАС
Варіат 1.
У завданнях 1-4 потрібно вибрати одну правильну відповідь.
Правильна відповідь на кожне завдання – 1 бал.
1. Виберіть визначення хімічного елемента:
А електронейтральна частка, яка складається з позитивно зарядженого ядра та електронів
Б найдрібніша хімічно неділима частка речовини
В вид атомів з однаковою масою
Г вид атомів з однаковим зарядом ядра
2. Визначте молекулярну масу гемоглобіну, якщо до складу гемоглобіну входить чотири атоми Fe (ІІ), які становлять 0,33 % маси молекули:
А 65000 г/моль В 70240 г/моль
Б 67878 г/моль Г 72460 г/моль
3. Укажіть хімічне явище:
А подрібнення цукру
Б горіння поліетилену
В плавлення чавуну
Г фільтрування суміші
4. Виберіть найпоширеніші елементи земної кори:
А Si, Ca, Р, О
Б Са, Мg, Fe, Si
В Al, Fe, O, Si
Г O, Si, Ca, Ba
Д Ca, Fe, Na, Cl
Завдання 5-6 мають на меті встановлення правильної відповідності.
Правильна відповідь на кожне завдання – 2 бали.
|
А |
|
|
Б |
|
|
В |
|
|
Г |
|
5. Установіть відповідність між хімічним елементом і його максимальною валентністю:
Елемент Валентність
А Фосфор 1. І
Б Силіцій 2. ІІ
В Оксиген 3. ІІІ
Г Бор 4. ІV
5. V
6. Установіть відповідність між простими й складними речовинами та їх прикладами:
А прості речовини 1. Cu(OH)2
Б складні речовини 2. FeCl3
3. N2
4. O3
5. H2O
|
А |
|
|
Б |
|
6. Cu
7. Al
Завдання 7-8 мають на меті встановлення правильної послідовності.
Правильна відповідь на кожне завдання – 2 бали.
7. Установіть послідовність процесу розділення суміші кухонної солі та глини:
А змішування з водою
|
1 |
|
|
2 |
|
|
3 |
|
|
4 |
|
Б фільтрування
В випарювання і кристалізація
Г відстоювання
|
1 |
|
|
2 |
|
|
3 |
|
|
4 |
|
- Установіть послідовність збільшення загальної кількості атомів у молекулах речовин:
А вода
Б кисень
В залізо
Г сульфур (VІ) оксид
Завдання 9-12 з відкритою відповіддю. Вони передбачають записи розв’язків задач, розрахунків
- Мінерал містить 6% Mg(CrO2)2 і 94% Fe(CrO2)2 . Визначте масову частку Хрому у мінералі. Яка маса Хрому міститься у 1 т мінералу ? 7 балів
- Хімічний аналіз зразка органічної сполуки масою 3,16 г виявив, що до його складу входять 0,92 г Карбону; 0,12 г Гідрогену; 0,8 г Кальція; решта – Оксиген. Складіть формулу сполуки. 5 балів
- Два елементи – елемент І групи та елемент ІV групи утворюють сполуки з Гідрогеном. У кожному з яких масова частка Гідрогену складає 12,5 %. Які це елементи ? 5 балів
- Нітроген як елемент – органоген входить до величезної кількості біологічно важливих сполук. Але й неорганічна хімія Нітрогену – різноманітна і багата. Наприклад: амоніак NH3, гідразин N2H4, гідроксиламін NН2ОH, нітритна кислота НNО2, нітратна кислота НNО3. Наведіть графічні формули молекул цих сполук. 5 балів
Варіант 2
Завдання 1. Тести (10 балів) Завдання з однією правильною відповіддю. Кожна правильна відповідь оцінюється в 0,5 балів. Максимальна кількість балів – 2.
- Як відомо, золото добувають із золотоносного піску, промиваючи його проточною водою в похилому жолобі. Пісок виноситься водою, а важкі часточки золота осідають на дно жолоба. Укажіть спосіб розділення суміші, який використовується при цьому:
А) відстоювання
Б) дистиляція Б
В) випаровування В
Г) кристалізація Г
2. Виберіть перелік елементів, які є найпоширенішими в земній корі:
А) Si, Ca, Р, О
Б) Са, Мg, Fe, Si
В) Al, Fe, O, Si
Г) O, Si, Ca, Ba
3. Оберіть процес, який ілюструє хімічне явище:
А) випаровування води
Б) почорніння мідної пластинки при нагріванні
В) танення льоду
Г) плавлення скла
4. Оберіть правильні характеристики молекул як структурних складових речовини:
А) мають електронний заряд
Б) мають постійний склад
В) визначають властивості речовини мають змінний якісний склад
Г) електронейтральні
Завдання на відповідність. Кожна правильна відповідь оцінюється в 0,5 балів. Максимальна кількість балів – 4.
Установіть відповідність між назвами складових частин спиртівки та цифровими позначеннями на малюнку: Складові частини спиртівки Цифрове позначення
А) скляний резервуар
Б) ковпачок
В) тканинний гніт
Г) металевий диск
6. Установіть відповідність між поняттям у лівій та правій колонках:
А) гума 1 хімічний елемент
Б) залізний цвях 2 складна речовина
В) алюміній 3 проста речовина
Г) Карбон 4 матеріал
5 фізичне тіло
Завдання на встановлення послідовності. Кожна правильна відповідь оцінюється в 0,5 балів. Максимальна кількість балів – 4.
7. Складіть рівняння реакцій за наведеними схемами та розташуйте їх у порядку збільшення суми коефіцієнтів:
А) SO2 + O2 → SO3
Б) C6H12 + O2 → CO2 + H2O
В) B2O3 + Mg → B + MgO
Г) CaO + CO2 → CaCO3
8. Установіть послідовність у порядку збільшення загальної кількості атомів у молекулах речовин:
А) вода (Н2О)
Б) кисень (О2)
В) фосфор(V) оксид (Р2O5)
Г )хлор(VII) оксид (Сl2O7)
Задача (8 балів) Хімічний елемент R у літосфері міститься в самородному вигляді і може утворювати різні руди. Елемент R також відноситься до елементів-органогенів, які входять до складу амінокислот (вивчати їх ви будете в 11 класі), з яких синтезуються білки. У організмі людини він міститься у волоссі, шкірі, нігтях. Добова потреба людини в елементі R становить 1г.
А) Визначте хімічний елемент R, якщо відомо, що він розміщений у VІ групі періодичної системи хімічних елементів Д.І. Менделєєва і його воднева сполука (Н2R) має відносну молекулярну масу 34. Складіть формулу водневої сполуки.
Б) Складіть формули оксидів (бінарні сполуки, які на другому місці завжди мають Оксиген) цього елементу R, назвіть їх.
В) Порівняйте масові частки елементу R у оксидах і зазначте, в якому з них його вміст більше.
Розв’язок А) Мr(Н2R) = 2Ar(Н) + Ar(R) 34 = 2 + R 32 = R, отже R – хімічний елемент з атомною масою 32 – Сульфур (S) Воднева сполука Н2S.
Б) SO3 – сульфур(VІ) оксид SO2 – сульфур(ІV) оксид SO* – сульфур(ІІ) оксид
B) Мr(SO3) = 32 + 16∙3 = 80 w(Ел) = n∙Ar / Мr w(S) = 1∙32 / 80 = 0,4 або 40% Мr(SO2) = 32 + 16∙2 = 64 w(S) = 32 / 64 = 0,5 або 50% *Мr(SO) = 32 + 16 ∙ 1 = 48 w(S) = 32 / 48 = 0,67 або 67% *УВАГА!!! Відповідь можна вважати правильною, якщо наведено формули двох і трьох оксидів Сульфуру, а тому: - масова частка Сульфуру більша у SO2 і становить 50% (якщо наведено два оксиди SO2 і SO3); - масова частка Сульфуру більша у SO і становить 67% (якщо наведено оксиди SO, SO2 SO3).
Інформаційна довідка. У нормальних умовах SO (сульфур(ІІ) оксид) являє собою безбарвний газ з різким, неприємним запахом. Здатний реагувати з водою. У атмосфері Землі зустрічається дуже рідко.
Задача (9 балів) Уважно прочитайте запропоновану умову завдань та дайте письмову відповідь.
- Складіть формули сполук за відомим якісним і кількісним складом та зазначте суму індексів у кожній з них: а) кальцій карбонат утворює такі відомі речовини як крейда, мармур і вапняк, його формула складається з одного атому Кальцію, одного атому Карбону та трьох атомів Оксигену;
Б) Консервантом для збільшення терміну зберігання м’ясних продуктів є натрій нітрат, формула якого складається з одного атому Натрію, одного атому Нітрогену і трьох атомів Оксигену;
В) Типовим дорогоцінним каменем зеленого кольору є смарагд, формула якого складається з трьох атомів Берилію, двох атомів Алюмінію, шести атомів Силіцію та вісімнадцяти атомів Оксигену
Г) Назвіть елемент, якщо відомо, що він має: а) на 3 електрони більше, ніж атом Натрію; (Si) б) на 7 електронів більше, ніж атом Магнію; (K) в) на 2 електрони менше, ніж атом Калію. (Cl)
Д) Укажіть частинки, які мають більше протонів ніж електронів (відповідь підтвердіть записом кількості протонів і електронів кожної частинки): а) атом кальцію, катіон Кальцію (Са2+) чи аніон Сульфуру (S2-)
Задача (11 балів) Уважно прочитайте запропоновану умову завдань та дайте письмову відповідь.
А) Випишіть окремо (у два стовпчики) назви сумішей і чистих речовин: повітря, морська вода, кухонна сіль, сірка, мінеральна вода, спирт, питна сода, дим, цукровий сироп, столовий оцет, бронза, золото 375-ї проби. Укажіть суміші, які є однорідними (гомогенними), а які – неоднорідними (гетерогенними).
Б) Проаналізуйте запропоновані формули речовин: СО (чадний газ), СО2 (вуглекислий газ), N2 (азот), Na2O∙CaO∙6SiO2 (скло), Н2СО3 (карбонатна кислота), NH4ОН (нашатирний спирт), І2 (йод), Сu (мідь), СН3СОСН3 (ацетон), S (сірка), і виконайте наступні завдання: а) випишіть окремо (у два стовпчики) формули простих і складних речовин; б) укажіть відносні молекулярні маси складних речовин та розташуйте їх формули у порідку збільшення масової частки Оксигену; в) визначте валентності хімічних елементів у оксидах (бінарні сполуки, які на другому місці завжди мають Оксиген).
Задача (12 балів) Білки є полімерними молекулами, які виконують найрізноманітніші функції в організмі людини. Вони складаються із залишків амінокислот (вивчати їх ви будите в 11 класі). Відомо, що найпростіша амінокислота складається з 6,67 % елемента А, 32 % елемента B, 18,67 % елемента C та 42,66 % елемента D.
А) Розшифруйте елементи А, B, C та D, якщо відомо, що елемент А утворює найлегшу просту речовину, елемент B утворює прості речовини алмаз і графіт, елемент C утворює просту речовину, яка складає 78,1 % повітря, а елемент D є найбільш поширеним у земній корі.
Б) Установіть формулу найпростішої амінокислоти (за складом).
В) Запишіть формули та назвіть прості речовини, які утворюють елементи А, C, D.
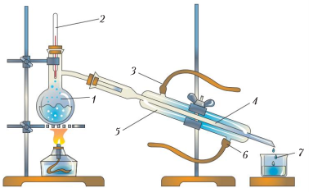
Задача. Уважно розгляньте запропонований рисунок і виконайте наступні завдання:
А) Дайте загальну назву рисунку, виходячи з того, що він ілюструє;
Б) Дайте назву позначеним літерами а), б), в);
В) Дайте назву хімічному обладнанню та хімічному посуду, позначеному цифрами;
Г) Запропонуйте речовину, яка може брати участь у досліді й поясніть, що з нею відбувається;
Д) укажіть, для чого вивчається(розглядається) даний дослід.
Варіант 3
У завданнях 1-4 потрібно вибрати одну правильну відповідь.
Правильна відповідь на кожне завдання – 1 бал.
1. Виберіть визначення хімічного елемента:
А електронейтральна частка, яка складається з позитивно зарядженого ядра та електронів
Б найдрібніша хімічно неділима частка речовини
В вид атомів з однаковою масою
Г вид атомів з однаковим зарядом ядра
2. Визначте молекулярну масу гемоглобіну, якщо до складу гемоглобіну входить чотири атоми Fe (ІІ), які становлять 0,33 % маси молекули:
А 65000 г/моль В 70240 г/моль
Б 67878 г/моль Г 72460 г/моль
3. Укажіть хімічне явище:
А подрібнення цукру
Б горіння поліетилену
В плавлення чавуну
Г фільтрування суміші
4. Виберіть найпоширеніші елементи земної кори:
А Si, Ca, Р, О
Б Са, Мg, Fe, Si
В Al, Fe, O, Si
Г O, Si, Ca, Ba
Д Ca, Fe, Na, Cl
Завдання 5-6 мають на меті встановлення правильної відповідності.
Правильна відповідь на кожне завдання – 2 бали.
|
А |
|
|
Б |
|
|
В |
|
|
Г |
|
5. Установіть відповідність між хімічним елементом і його максимальною валентністю:
Елемент Валентність
А Фосфор 1. І
Б Силіцій 2. ІІ
В Оксиген 3. ІІІ
Г Бор 4. ІV
5. V
6. Установіть відповідність між простими й складними речовинами та їх прикладами:
А прості речовини 1. Cu(OH)2
Б складні речовини 2. FeCl3
3. N2
4. O3
5. H2O
|
А |
|
|
Б |
|
6. Cu
7. Al
Завдання 7-8 мають на меті встановлення правильної послідовності.
Правильна відповідь на кожне завдання – 2 бали.
7. Установіть послідовність процесу розділення суміші
кухонної солі та глини
А змішування з водою
|
1 |
|
|
2 |
|
|
3 |
|
|
4 |
|
Б фільтрування
В випарювання і кристалізація
Г відстоювання
|
1 |
|
|
2 |
|
|
3 |
|
|
4 |
|
8. Установіть послідовність збільшення загальної кількості атомів у молекулах речовин:
А вода
Б кисень
В залізо
Г сульфур (VІ) оксид
Завдання 9-12 з відкритою відповіддю. Вони передбачають записи розв’язків задач, розрахунків
- Мінерал містить 6% Mg(CrO2)2 і 94% Fe(CrO2)2 . Визначте масову частку Хрому у мінералі. Яка маса Хрому міститься у 1 т мінералу ? 7 балів
- Хімічний аналіз зразка органічної сполуки масою 3,16 г виявив, що до його складу входять 0,92 г Карбону; 0,12 г Гідрогену; 0,8 г Кальція; решта – Оксиген. Складіть формулу сполуки. 5 балів
- Два елементи – елемент І групи та елемент ІV групи утворюють сполуки з Гідрогеном. У кожному з яких масова частка Гідрогену складає 12,5 %. Які це елементи ? 5 балів
- Нітроген як елемент – органоген входить до величезної кількості біологічно важливих сполук. Але й неорганічна хімія Нітрогену – різноманітна і багата. Наприклад: амоніак NH3, гідразин N2H4, гідроксиламін NН2ОH, нітритна кислота НNО2, нітратна кислота НNО3. Наведіть гра-
фічні формули цих сполук
5 балів
Варіант 4
Тести 1 (6 балів)
1. Визначте у формулі якої сполуки сума індексів буде найбільшою: (0,5 балів) A. Нітрогену(V) з Оксигеном; Б. Карбону(IV) з Оксигеном; В. Нітрогену(ІІІ) з Гідрогеном; Г. Карбону(IV) з Гідрогеном.
2. Визначте правильне твердження щодо молекули вуглекислого газу: (0,5 балів) A) складається з двох атомів одного хімічного елемента;
Б) складається з двох атомів різних хімічних елементів;
В) складається з атомів трьох елементів;
Г) складається з атомів двох елементів.
3. Суміш піску, цукру та залізних ошурок можна розділити: (0,5 балів)
A) подіяти магнітом, змішати з водою, відстояти, відфільтрувати, випарувати воду;
Б) змішати з водою, відстояти, подіяти магнітом, відфільтрувати, випарувати воду;
В) змішати з водою, відстояти, відфільтрувати, подіяти магнітом, випарувати воду;
Г) неможливо розділити.
4. Визначте сполуку, що містить хімічний елемент з найбільшим значенням валентності: (0,5 балів)
А) NO2; Б) Al2O3; В) FeO; Г) V2O5.
5. Виберіть хімічні явища з нижче поданого переліку: (1 бал)
A) Почорніння срібних виробів;
Б) Зміна забарвлення кисню при зрідженні;
В) Виділення газу при відкриванні пляшки з водою;
Г) Згіркнення масла;
Д) Поява веселки після дощу;
Е) Руйнування озонового шару;
Є) Бродіння виноградного соку.
A) Кам’яне вугілля
Б) Сода
В) Вазелін
Г) Поліетилен
Д) Глина
Е) Графіт
Є) Фруктовий сік
7. Визначте молекулярну масу гемоглобіну, якщо до складу гемоглобіну входить чотири атоми Fe (ІІ), які становлять 0,33 % маси молекули: (2 бали)
А) 65000 г/моль В) 70240 г/моль
Б) 67878 г/моль Г) 72460 г/моль
Завдання 2 (15 балів)
Елемент Х утворює різні оксиди та солі. В оксиді Х2О3 його масова частка становить 68,42%. У солі складу А2Х2О7 його масова частка – 35,37 %. Визначити формулу солі, та масову частку елемента А в сполуці.
Завдання 3 (15 балів)
Елементи А, Б та В належать до одного і того ж періоду періодичної системи. Елементи А і Б – найбільш поширені елементи земної кори. Атом елемента В має на 4 електрони більше, ніж атом елемента А. Елемент А утворює сполуку з елементом В складу АВ3, а елементи А і Б при нагріванні утворюють речовину складу А4Б3. Існує також сполука елементів Б та В складу БВ4. Визначити елементи А, Б та В.
Завдання 4 (20 балів) Білки є полімерними молекулами, які виконують найрізноманітніші функції в організмі людини. Вони складаються із залишків амінокислот. Найпростіша амінокислота складається з 6,67 % елемента А, 32 % елемента B, 18,67 % елемента C та 42,66 % елемента D. 1. Розшифрувати елементи А, B, C та D, якщо елемент А утворює найлегшу просту речовину, елемент B утворює прості речовини алмаз і графіт, елемент C утворює просту речовину, яка складає 78 % повітря, а елемент D є найбільш поширеним у земній корі. 2. Встановити формулу найпростішої амінокислоти. 3. Які прості речовини утворюють елементи А, C та D?
Варіант 5
І. Серед безлічі процесів, що відбуваються у природі, прийнято виділяти хімічні й фізичні явища.
1. Визначте, які з наведених процесів є хімічними, а які – фізичними: а) танення льоду, б) горіння сірника, в) північне сяйво, г) поява білих плям на взутті після його висихання, д) поява дірок на одязі після необережної роботи з кислотою, е) гниття. Для розділу сумішей речовин у хімічній лабораторії використовується низка експериментальних методів, наприклад: центрифугування, магнітна сепарація, відстоювання та декантація, фільтрування, перегонка.
2. Які із зазначених методів можна використовувати для розділення суміші піску й води в лабораторії? (8 балів)
ІІ. Довгий варіант періодичної системи елементів містить 18 груп елементів, при цьому за деякими групами елементів закріплені їхні тривіальні назви.
1. Встановите відповідність між назвами груп і зазначеними елементами:
1 Сульфур А Лужні метали
2 Астат Б Лужноземельні метали
3 Радій В Халькогени
4 Радон Г Рідкоземельні елементи
5 Літій Д Інертні гази
6 Кальцій Е Галогени
Відповідь дайте у вигляді: 1–А, 2–Б тощо.
2. Які з наведених елементів за н. у. утворюють газоподібні прості речовини?
3. Які з наведених елементів у природі існують тільки у вигляді радіоактивних ізотопів? (10 балів)
ІІІ. Є такі речовини: S8, KClO3, P4, NaCl, KMnO4, Ne, H2SO4, Fe2O3, KАl(SO4)2×12H2O.
1. Визначте, які з цих речовин є простими, а які – складними. Відповідь поясніть. 2. Розрахуйте відносну молекулярну масу речовини: KАl(SO4)2×12H2O. (12 балів)
ІV. У сполуці масова частка Оксигену складає 56,8%, масова частка Хлору- 42%. У речовині також є Гідроген. Виведіть найпростішу молекулярну формулу речовини. У формулі визначте валентність хлору та враховуючи валентності елементів складіть графічну формулу даної речовини. (15 балів)
V. (11 балів) Нижче наведений перелік хімічних термінів: проста речовина, складна речовина, суміш, домішка, розчин, дальтонід, бертолід, метал, неметал, індикатор, реторта, атом.
1. Дайте визначення термінів.
2. Які прості речовини утворюються внаслідок життєдіяльності живих організмів, у тому числі мікроорганізмів? Як ці речовини одержують у промисловості та в лабораторії?
VІ. Напишіть формули речовин, до складу молекул яких входять:
а) чотири атоми Фосфору;
б) один атом Сульфуру й три атоми Оксигену;
в) три атоми Гідрогену, один атом Фосфору й чотири атоми Оксигену;
г) два атоми Карбону, шість атомів Гідрогену та один атом Оксигену. (4 бали)
Варіант 6
1. У переддень новорічного свята.
Прочитайте текст, запишіть у дві колонки фізичні та хімічні явища, які згадуються в ньому.
Незабаром новорічне свято. Напередодні випав лапатий, пухнастий сніг, укрив землю білою ковдрою. Річки й ставки лежать під кригою. Під променями зимового сонця тане сніг на темному даху будинку. Вода перетворюється на льодяні бурульки, які виблискують на сонці всіма кольорами райдуги.
Можна дістати з горища санчата. Є там і старі бабусині. Шкода, що вони трохи заржавіли, та їх можна легко почистити. А от мої – новенькі, зроблені зі сплаву, що не ржавіє.
Удома вже прикрасили ялинку. Які чудові кульки висять на ній! Ми привезли їх з екскурсії на фабрику ялинкових прикрас. Виробництво ялинкових іграшок – дуже цікавий процес. Спочатку склодув видуває ялинкові кулі. Потім кулі срібляться зсередини, щоб під час фарбування вони не були напівпрозорими. Невелика кількість спеціального розчину наливається в прозору кулю, потім вона опускається в гарячу воду – і через кілька секунд кулька стає сріблястою. Після цього посріблені кулі проходять етап фарбування: їх занурюють у лак потрібного кольору, на конвеєрі піддають впливу інфрачервоного світла – і через кілька хвилин прикраси готові.
У новорічну ніч ми запалимо свічки. Парафін буде плавитися, утворюючи чарівні фігури. Не можна запалювати свічки та бенгальські вогні біля ялинки, бо вона може спалахнути. Феєрверки потрібно запускати на вулиці, відійшовши від них на безпечну відстань, адже це маленький вибух. Людина, яка добре знає хімію, завжди дотримується правил безпеки.
Бажаємо вам веселих свят!
(12 балів)
2. Собача печера.
Біля Неаполя (Італія) розташована печера, до якої доросла людина може зайти безбоязно, але для собаки така прогулянка закінчиться погано. Живі істоти, зріст яких не перевищує 80 см, гинуть у цій печері від задухи. Відомо, що речовина А, яка становить смертельну загрозу, є бінарною сполукою. Хімічний елемент Х, який входить до складу цієї речовини, є основою всього живого, а інший елемент Y утворює речовину Б, без якої неможливе горіння.
А. Визначте речовини А і Б (запишіть формули і назви). Відповідь перевірте розрахунком, якщо відомо, що 100 г речовини А містить 27,3 г елемента Х та 72,7 г елемента Y;
Б. Елемент Х може сполучатись з елементом Y у різних співвідношеннях. Чи є це порушенням закону кратних співвідношень?
В. Чому в печері гинуть живі істоти, зріст яких не перевищує 80 см?
Г. Розрахуйте масу молекули речовини Б у грамах.
(12 балів)
3. Суміш.
Юний хімік змішав разом п’ять рідин: бензин, воду, ртуть, спирт, олію. Помістивши суміш у ділильну воронку, він побачив, що суміш розділилася на три шари. Опишіть склад кожного шару.
(12 балів)
4.
Напишіть рівняння реакцій за схемами. Розташуйте їх у порядку збільшення суми коефіцієнтів. Визначте елементи Х таY, якщо масові частки Х та Y у сполуці з Фосфором X3PY4 відповідно дорівнюють 3, 06 % та 65,31 %.
1. X2 + Y2 → X2Y
2. Mg + Y2 → MgY
3. P2Y5 + X2Y → X3PY4
4. MgY + X3PY4 → Mg3(PY4)2 + X2Y
5. Палаюча свічка.
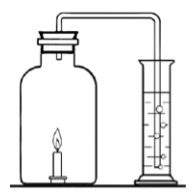
У банку помістили палаючу свічку (див. рис). Банку закрили гумовою пробкою з газовідвідною трубкою, кінець якої опустили в циліндр з водою. Поки свічка горіла, з газовідвідної трубки виділялися бульбашки газу. Через деякий час свічка погасла, після чого вода стала підніматися по трубці й переливатися в банку.
1. Горіння свічки − це фізичний чи хімічний процес? Відповідь обґрунтуйте.
2. Під час горіння свічки внутрішні стінки банки запітніли. Про що свідчить це явище?
3. Чому при горінні свічки з газовідвідної трубки виділялися бульбашки газу?
4. Чому після того, як свічка погасла, вода почала підніматися по газовідвідній трубці й переливатися з циліндра в банку?
5. Чому свічка гасне, не встигнувши догоріти? (12 балів)
Варіант 7
Тести 1-8.(10 балів)
Завдання 1-6 мають по чотири варіанти відповіді, з яких лише одна правильна. Знайдіть та позначте її. Максимальна оцінка за кожне правильно виконане завдання 1 бал.
- Укажіть ваші дії, якщо під час проведення досліду в кабінеті хімії спалахнула речовина.
|
А швидко вибігти з кабінету |
А |
|
|
Б спробувати загасити пожежу |
Б |
|
|
В повідомити вчителя й діяти за його вказівками |
В |
|
|
Г почати виносити легкозаймисті речі |
Г |
|
- Укажіть вислів, де описується кількісний склад глюкози (С6Н12О6).
|
Амолекула глюкози складається з трьох хімічних елементів – Карбону, Гідрогену та Оксигену |
А |
|
|
Б |
|
|
|
Бмолекула глюкози складається із шести атомів Карбону, дванадцяти атомів Гідрогену та шести атомів Оксигену |
В |
|
|
Г |
|
|
|
Вмолекула глюкози складається з двадцяти чотирьох атомів |
|
|
|
Гмолекула глюкози складається з кількох видів хімічних елементів |
|
|
- Укажіть рядок, в якомувсі елементи належать до неметалічних.
|
АCu, Mg,K, C |
А |
|
|
БCl, Se, S, N |
Б |
|
|
ВMg, Na, Cu, Ca |
В |
|
|
ГMn, Mg, H, Al |
Г |
|
- Укажіть рядок, в якому розміщені формулилише складних речовин.
|
АHBr, NH3, B, H2O |
А |
|
|
БH2SO4, Ca3P2, HBr, H2O |
Б |
|
|
ВH2, Ca, Cu, O2 |
В |
|
|
ГCaHPO4, H2, K2O, H3PO4 |
Г |
|
- Укажіть кількістьнейтронів у ядрі атома Кальцію.
|
А20 |
А |
|
|
Б15 |
Б |
|
|
В60 |
В |
|
|
Г40 |
Г |
|
6. Укажіть рядок, в якому формули розташовані за зростанням валентності першого елементу.
|
АCrO, MnO2, K2O |
А |
|
|
БCuO, Al2O3, CaO |
Б |
|
|
ВSiO2, P2O5, SO3 |
В |
|
|
ГFe2O3, NO, Cl2O7 |
Г |
|
Завдання 7-8 передбачають встановлення відповідності між правим і лівим стовпчиками. Максимальна оцінка за кожне правильно виконане завдання
2 бали.
7. Установіть відповідність між висловом та умовним позначенням кількості частинок.
|
Вислів |
Позначення |
|
А |
Б |
В |
Г |
Д |
|
1 чотири молекули водню |
А 4О |
1 |
|
|
|
|
|
|
2 чотири молекули кисню |
Б 4Н |
2 |
|
|
|
|
|
|
3 чотири йони Гідрогену |
В 4О2 |
3 |
|
|
|
|
|
|
4 чотири атоми Гідрогену |
Г 4Н2 |
4 |
|
|
|
|
|
|
|
Д 4Н+ |
|
|
|
|
|
|
8. Складіть рівняння реакцій за наведеними схемами. Установіть відповідність між рівнянням реакції та сумою всіх коефіцієнтів.
|
Схеми рівнянь хімічних реакцій |
Сума всіх коефіцієнтів рівняння |
|
|
|
|
|
|
|
А |
Б |
В |
Г |
Д |
|||
|
1K + H2O → KOH + H2 |
А5 |
1 |
|
|
|
|
|
|
2FeCl2 + Cl2 → FeCl3 |
Б7 |
2 |
|
|
|
|
|
|
3ZnS + O2 → ZnO + SO2 |
В8 |
3 |
|
|
|
|
|
|
4K3N + H2O → KOH + NH3 |
Г9 |
4 |
|
|
|
|
|
|
|
Д10 |
|
|
|
|
|
|
Задача 2. (10 балів)
Уважно прочитайте завдання та дайте письмову відповідь.
АЗ наведеного переліку випишіть у три стовпчика назви речовин, фізичних тіл і матеріалів: крига, глина, алюміній, пластмаса, скло, склянка, гума, ложка, стіл, цегла, чашка, деревина, порцеляна, вода, автомобільне коліща, ручка. Установіть між ними взаємозв’язкиза принципом «речовина – фізичне тіло», «матеріал – фізичне тіло».
Б Зазначте зовнішні зміни, що спостерігаються під час наступних процесів: бродіння яблучного соку, плавлення цукру, іржавіння залізних виробів, підгоряння картоплі під час смаження. Визначте, до яких явищ кожне з них відноситься.
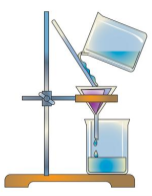
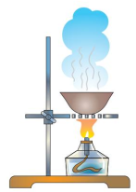
В Розгляньте малюнки. Назвіть методи розділення суміші, які на них зображено. Назвіть хімічний посуд та обладнання позначені цифрами. Наведіть по одному прикладу використання цих методів розділення сумішей.
|
|
|
|
Задача 3. (10 балів)
Уважно прочитайте завдання та дайте письмову відповідь, користуючись періодичною системою хімічних елементів.
АСкладіть хімічні формули бінарних сполук, утворених першими трьома елементами третього періоду періодичної системи хімічних елементів із Сульфуром(ІІ).
БЗнайдіть чотири пари хімічних елементів, у яких відносні атомні маси відрізняються у два рази. Назвіть їх, запишіть символи, укажіть атомні маси.
В Укажіть хімічні елементи, які мають: однакову кількість електронів з йоном Кальцію; однакову кількість електронів з йономНітроген(3–).
Г Визначте невідомий хімічний елемент у формулі вищого оксидуRхOу, якщо відомо, що він розташований у сьомій групі головній підгрупі і відносна молекулярна маса його оксиду становить 183. Складіть формули вищого оксиду та леткої водневої сполуки цього елементу.
Задача 4. (8 балів)
Для надання зеленого та синього забарвлення виробам із склавикористовують купрум(ІІ) оксид. У лабораторії його одержують спаленням металевої міді у надлишку кисню.
АЗапишіть рівняння хімічної реакції зазначеного процесу за схемою:
Сu + O2![]() CuxOy.
CuxOy.
БУкажіть суму коефіцієнтів реагентів реакції.
ВОбчисліть масу Купруму в купрум(ІІ) оксиді масою 240 г.
Задача 5. (10 балів)
До складу силікатного клею входить речовина, яка складається з атомів Натрію, Силіцію та Оксигену. Масова частка Натрію – 37,7%, Силіцію – 23%. Установіть формулу речовини, якщо відносна молекулярна маса дорівнює 122.
Задача 6. (12 балів)
Елементи А, Б та В належать до одного періоду періодичної системи хімічних елементів. Елементи А і Б – найбільш поширені елементи земної кори. Атом елемента В має на 4 електрони більше, ніж атом елемента А. Елемент А утворює сполуку з елементом В складу АВ3, а елементи А і Б при нагріванні утворюють речовину складу А4Б3. Існує також сполука елементів Б та В складу БВ4. Визначте елементи А, Б та В, відповідь обґрунтуйте. Обчисліть відносні молекулярні маси вищезазначених сполук.
Варіант 8
Тести 1-6. (8 балів)
Завдання 1-4 мають по чотири варіанти відповіді, з яких лише одна правильна. Знайдіть та позначте її. Максимальна оцінка за кожне правильно виконане завдання 1 бал.
1. Укажіть явище, що супроводжується перетворенням одних речовин на інші.
|
А танення льоду |
В горіння деревини |
|
Б випаровування бензину |
Г утворення роси |
2. Укажіть однорідну суміш.
|
В ґрунт |
|
|
Б незбиране молоко |
Г граніт |
3. Укажіть фізичну властивість, за якою найпростіше відрізнити алюміній від міді.
|
А теплопровідність |
В електропровідність |
|
Б пластичність |
Г колір |
4. Укажіть пару речовин, що мають однаковий якісний склад.
|
ВNa2S і Na2SO4 |
|
|
БH2SO3і H2SO4 |
ГNa2SO3і H2SO4 |
Завдання 5-6 передбачають встановлення відповідності між правим і лівим стовпчиками. Максимальна оцінка за кожне правильно виконане завдання
2 бали.
5. Установіть відповідність між речовиною та матеріалом.
|
Речовина |
Матеріал |
|
1 поліетилен |
А метал |
|
2 целюлоза |
Б камінь |
|
3 мідь |
В деревина |
|
4 мармур |
Г скло |
|
|
Д пластмаса |
6. Установіть відповідність між методом вивчення природи та прикладом його використання.
|
Методи вивчення природи |
Приклад використання методу |
|
1 моделювання 2 експеримент |
А Іван висловив припущення, що порошок сірки не тоне у воді, бо не змочується нею |
|
3 вимірювання 4 спостереження |
БАндрій, щоб дізнатися масу зразка мармуру, поклав його на платформу електронних ваг |
|
|
В Тамара, щоб дізнатися, чиє в сметані домішки крохмалю, добавила в невелику її порцію кілька крапель спиртової йодної настоянки |
|
|
ГДмитро, щоб дізнатися, чи є граніт індивідуальною речовиною, уважно роздивився кілька його зразків крізь лупу |
|
|
Д Аліна, щоб зацікавити молодшу сестру хімією, сплела їй у подарунок іграшки, що зображували молекули різних речовин |
Задача 1. «Дослідження юного хіміка» (6 балів)
Юний дослідник Василько дуже любив хімічні досліди, проте саму хімію, він знав поки що не дуже добре. Допоможіть хлопчику поглибити предметні знання.
 А Василько вирішив провести хімічний дослід, в якому потрібно нагріти речовину. Він узяв спиртівку, підпалив її сірником, переніс ближче до вікна на інший стіл, нагрів речовину в пробірці та задув спиртівку.
А Василько вирішив провести хімічний дослід, в якому потрібно нагріти речовину. Він узяв спиртівку, підпалив її сірником, переніс ближче до вікна на інший стіл, нагрів речовину в пробірці та задув спиртівку.
Які помилки допустив Василько? Сформулюйте чотири основних правила роботи зі спиртівкою, зображеною на малюнку.
Б Одного разу, повчивши уроки, Василько захотів їсти. Прийшовши на кухню, він закип’ятив воду, заварив чай, добавив у нього цукор. І тут замислився, що кухню можна розглядати як лабораторію, де відбуваються різноманітні явища. Василько схопив олівець і склав наступний список хімічних явищ, що протягом останнього часу він спостерігав на кухні: горіння природнього газу на кухні, гниття харчових продуктів, смаження їжі, танення льоду при розморозці холодильника, плавлення свічки на святковому торті, гашення соди оцтом під час приготування млинців, утворення пари під час кипіння води в чайнику.
Укажіть явища, які Василько помилково відніс до хімічних.
В У підручнику з хімії Василько знайшов завдання, яке передбачало складання плану розділення суміші речовин, до якої входили сажа, залізо, кухонна сіль та мідь. Юний хімік замислився, як це йому зробити, і, який посуд йому потрібно для цього взяти. Допоможіть Васильку виконати це завдання: складіть план розділення суміші; зазначте необхідний хімічний посуд і приладдя.
Задача2. «Лавровий лист» (5 балів)
Лавровий лист – це висушене листя лавра благородного. Аромат лавру обумовлений речовиною, що містить 24 атоми Карбону, 48 атомів Гідрогену та 2 атоми Оксигену.
АЗапишіть молекулярну формулу речовини, що надає аромат лавру.
БОбчисліть масову частку елементу з найбільшим кількісним складом.
ВОхарактеризуйте Карбон за положенням у періодичній системі та будовою атома, зазначивши: символ хімічного елемента, номер періоду, групу, підгрупу, заряд ядра, кількість протонів, нейтронів, електронів, можливі валентності.
Задача 3. «Лікарський засіб» (6 балів)
У широковідомому лікарському препараті аспірині (ацетилсаліцілова кислота) уміст Гідрогену – 4,44%, Оксигену – 35,56%, решта – Карбон. Співвідношення між числом атомів Гідрогену та Оксигену у молекулі
аспирину – 2:1. Установіть молекулярну формулу аспірину.
Задача 4. «Сполуки навколо нас» (6 балів)
Співвідношення двох відносних молекулярних мас сполук, що складаються з елемента Хта Оксигену, і в яких елемент Х виявляє валентність ІІ і IV, становить 7:11.
АЗа допомогою обчислень установіть хімічний елемент.
БСкладіть формули оксидів.
В Дайте тривіальні (побутові) назви оксидам. Укажіть їх вплив на довкілля.
Задача 5. «Небезпечний інсектицид» (9 балів)
Арсенат невідомого металу (Me3(AsO4)n) використовують як інсектицид (хімічні препарати для захисту рослин від шкідливих комах). Визначте формулу невідомого інсектициду, якщо відомо, що його відносна молекулярна маса більша за відносну молекулярну масу нітрату цього елемента (Me(NO3)n)
у 2,447 рази.
Задача 6. «Хімічні реакції» (10 балів)
За валентністю складіть формули реагентів та продуктів реакцій, перетворіть схеми реакцій на хімічні рівняння:
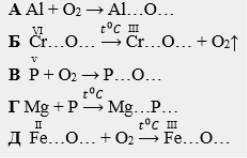
Варіант 9
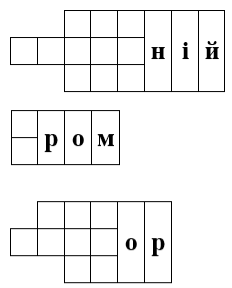
1 Допишіть назви хімічних елементів. Запишіть символи цих хімічних елементів, розташовуючи їх у порядку збільшення атомних мас.
2. Уважно прочитайте завдання та дайте письмову відповідь.
А. Із наведеного переліку випишіть у три стовпчики назви речовин, фізичних тіл і матеріалів: крижина, глина, алюміній, пластмаса, скло, склянка, гума, ложка, стіл, цегла, чашка, деревина, порцеляна, вода, автомобільна шина, ручка. Установіть між ними взаємозв’язки за принципом «речовина – фізичне тіло», «матеріал – фізичне тіло».
Б Зазначте зовнішні зміни, що спостерігаються під час таких процесів: бродіння яблучного соку, плавлення цукру, іржавіння залізних виробів, підгоряння картоплі під час смаження. Визначте, до яких явищ кожен з них відноситься.
В Розгляньте малюнки. Назвіть методи розділення суміші, які на них зображено. Назвіть хімічний посуд і обладнання, позначені цифрами. Наведіть по одному прикладу використання цих методів для розділення сумішей.
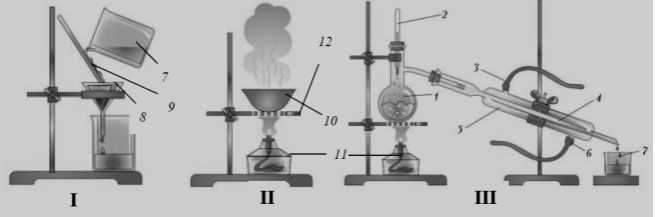
(12 балів)
3. Хімічний елемент R у літосфері міститься в самородному вигляді та входить до складу багатьох руд. В організмі людини він міститься у волоссі, шкірі, нігтях. Добова потреба людини в елементі R становить 1г.
А Визначте хімічний елемент R, коли відомо, що він розміщений у VІ групі періодичної системи хімічних елементів Д.І. Менделєєва і його сполука з Гідрогеном (Н2R) має відносну молекулярну масу 34. Складіть формулу водневої сполуки.
Б Відомо, що при горінні водневої сполуки елемента R утворюється два оксиди RO2 і Н2О. Складіть рівняння реакції горіння Н2R.
В При взаємодії сполуки Н2R із оксидом RO2 утворюється проста речовина елемента R і Н2О. Складіть рівняння вказаної вище реакції. Розрахуйте масу простої речовини R, яка утвориться внаслідок реакції, якщо маси реагентів дорівнювали m(Н2R) = 34 г, m(RО2) = 34 г.
(12 балів)
4. Атомна маса хімічного елемента А в 2,5 раза більша за атомну масу хімічного елемента В. Різниця їхніх відносних атомних мас дорівнює відносній атомній масі елемента, що знаходиться в третьому періоді та другій групі періодичної системи хімічних елементів.
- Визначте елементи А і В.
- Що вам відомо про просту речовину, утворену елементом В.
(12 балів)
5. Речовину Х помістили в колбу. Далі провели дослід, етапи якого зображено на рисунках а, б, в. Уважно розгляньте запропоновані рисунки та виконайте такі завдання.
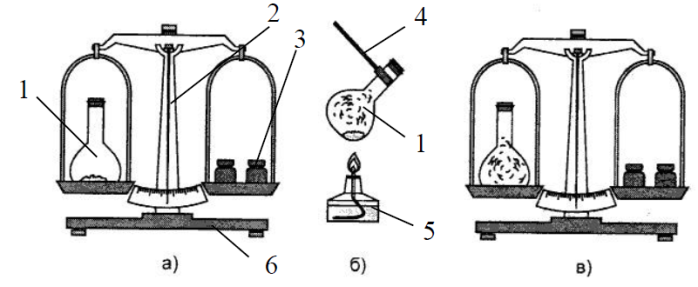
А Шо ілюструє дослід, зображений на рисунках а, б, в?
Б Відомо, що речовину Х було відкрито під час спроб добути філософський камінь. Антуан Лавуазьє довів, що це проста речовина. Назва речовини Х у перекладі з грецької означає «світлоносний». Речовину утворює хімічний елемент, який знаходиться у п’ятій групі періодичної системи. Про яку речовину йде мова?
В Коротко опишіть кожен етап (а, б, в) досліду.
Г Дайте назву хімічному обладнанню та хімічному посуду, позначеному цифрами.
Д Складіть формули оксидів хімічного елемента, з якого утворено речовину Х. Розрахуйте, у якому з оксидів масова частка Оксигену більша.
(12 балів)


про публікацію авторської розробки
Додати розробку