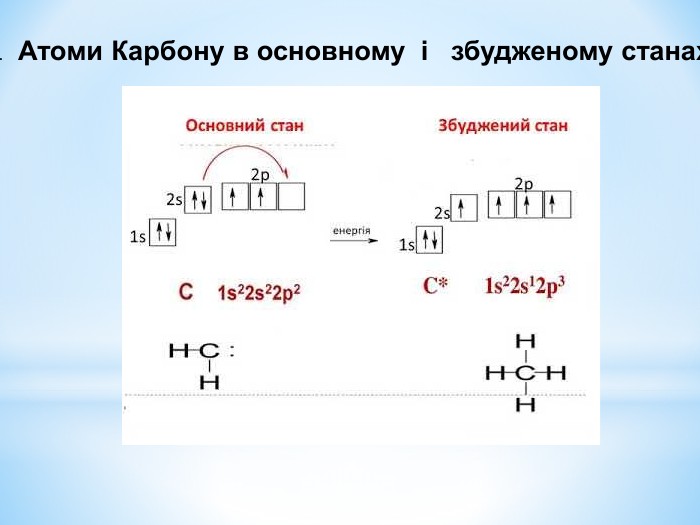
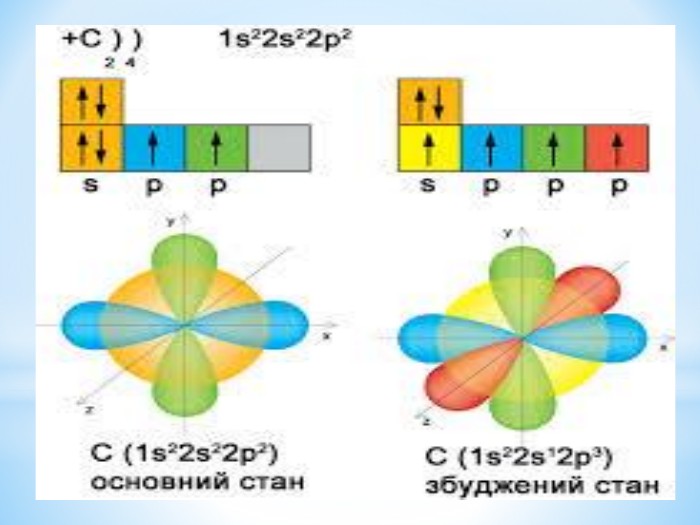
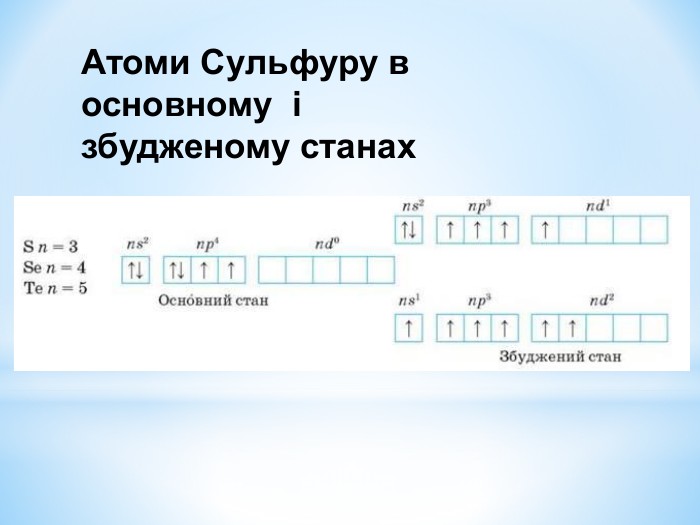
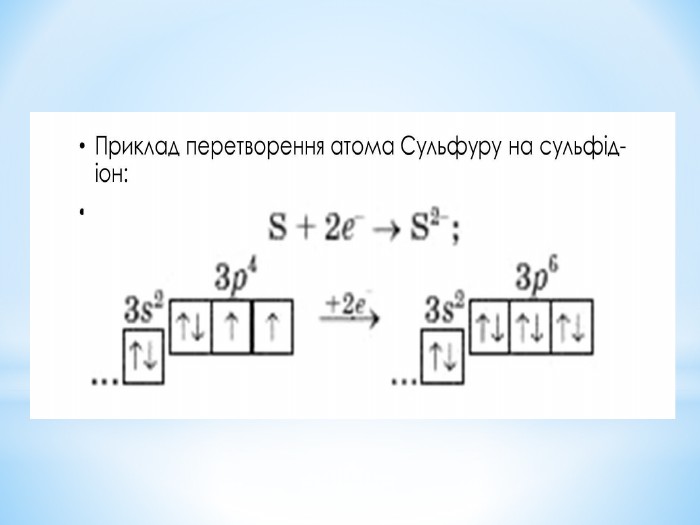
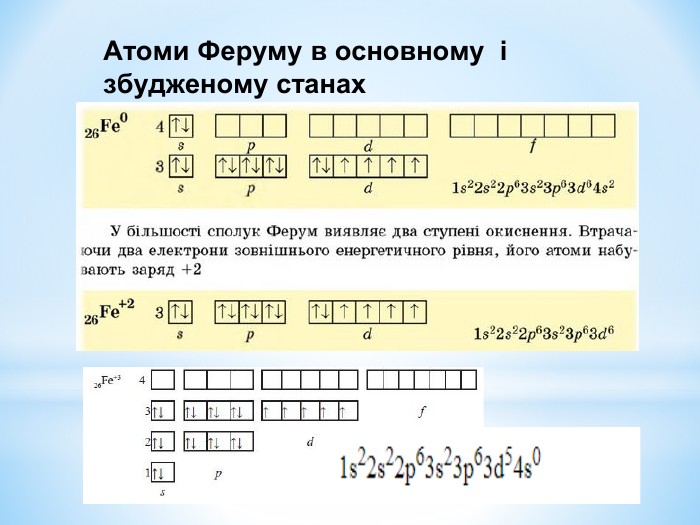
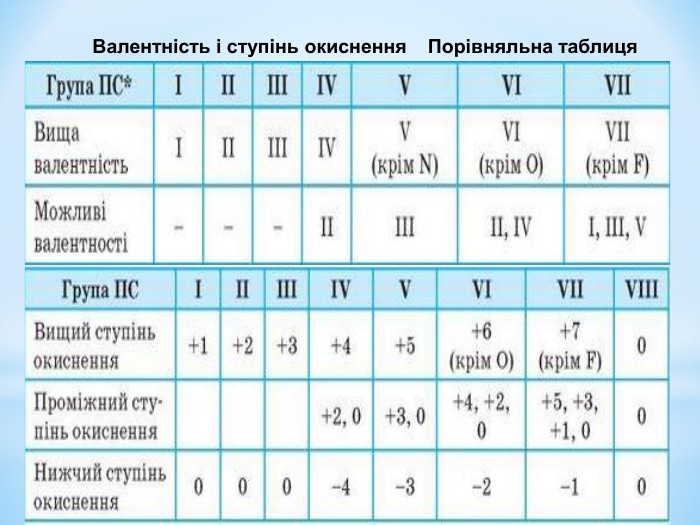
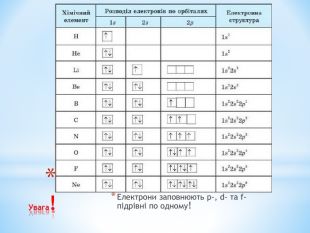
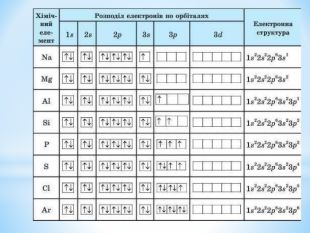
Презентація: " Збуджений стан атома. Валентні стани елементів."
Про матеріал
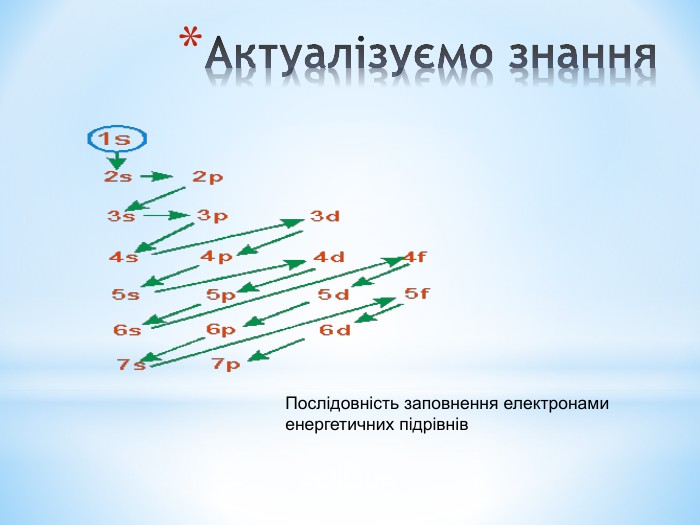
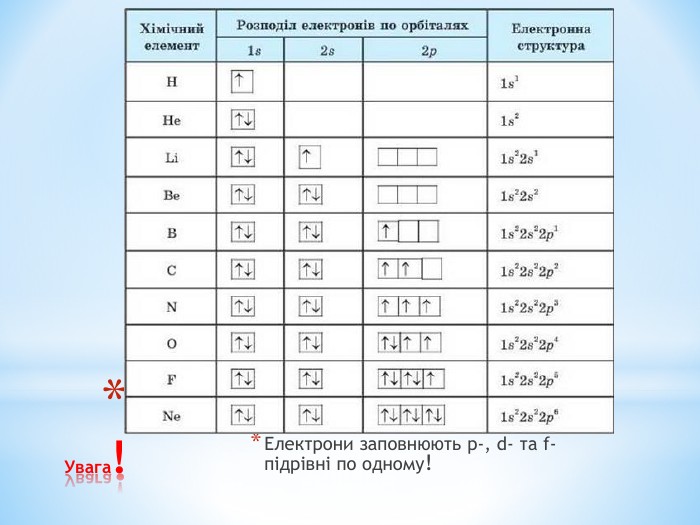
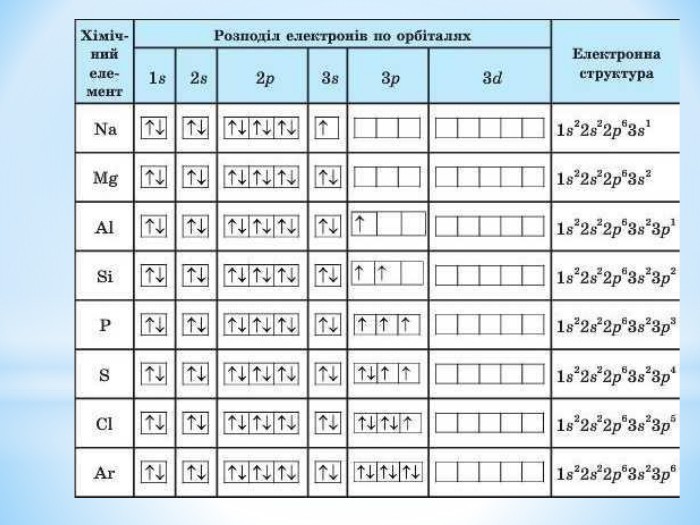
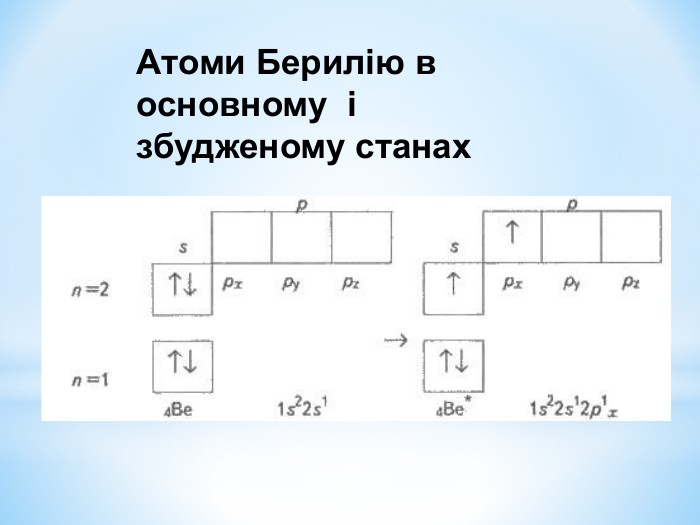
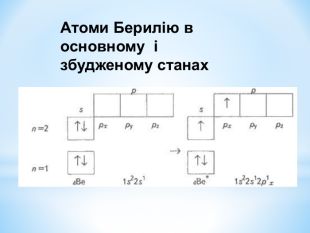
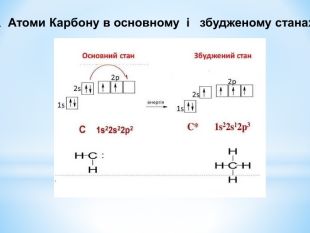
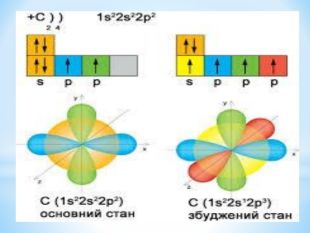
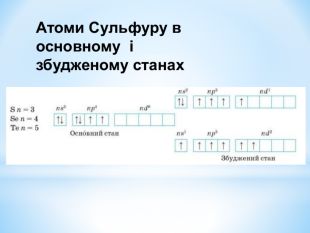
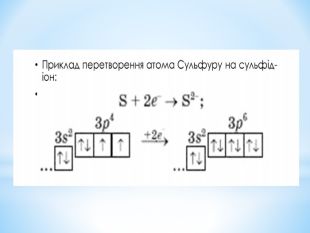
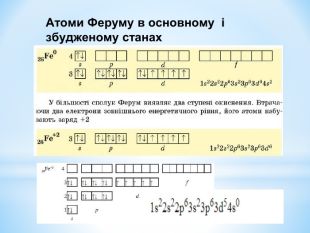
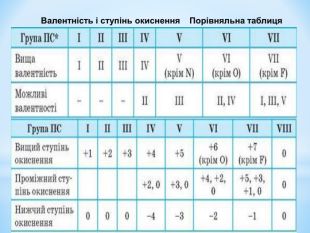
Презентація до уроку "Збуджений стан атомів. Валентні стани елементів" з хімії,11 клас за новою програмою складається з актуалізації, основної частини, закріплення нових знань. Може бути застосована для самостійного опрацювання.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
ppt
Оцінка розробки

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку