Зошит "для практичних робіт з хімії"
Робота містить практичні роботи для 9-го класу з поглибленим вивченням хімії, які були апробовані у 2017-2018 навчальному році. Практичні роботи розроблені відповідно до діючої програми з хімії, затвердженої Міністерством освіти і науки України.
Посібник містить табель і графік успішності виконання практичних робіт, розробки 10 практичних робіт, 4 додатки, які необхідні для планування і аналізу роботи. Кожна практична робота містить детальний протокол проведення роботи, графу спостереження, рівняння реакцій, висновки, а також додаткові теоретичні завдання до роботи.
Посібник призначений для вчителів хімії, учнів 9-го класу з поглибленим вивченням хімії, абітурієнтів та студентів.
Результати виконаних робіт
|
№ роботи |
Назва роботи |
Самооцінка учня |
Оцінка вчителя |
||||
|
Теоретична підготовка до роботи |
Дотримання правил ТБ |
Виконання роботи |
Оформлення роботи |
Загальна оцінка |
|||
|
1 |
Практична робота 1. Приготування розчину солі з певною масовою часткою розчиненої речовини |
|
|
|
|
|
|
|
2 |
Практична робота 2. Приготування розчину солі із заданою молярною концентрацією розчиненої речовини |
|
|
|
|
|
|
|
3 |
Практична робота. 3. Приготування розчину солі з молярною концентрацією еквівалентів розчиненюї речовини |
|
|
|
|
|
|
|
4 |
Практична робота. 4.Реакції йонного обміну між електролітами у водних розчинах |
|
|
|
|
|
|
|
5 |
Практична робота. 5. Розв’язування експериментальних задач на визначення рН розчинів і гідроліз солей |
|
|
|
|
|
|
|
6 |
Практична робота № 6. Розв᾿язування експериентальних задач |
|
|
|
|
|
|
|
7 |
Практична робота 7. Окисно-відновні реакції |
|
|
|
|
|
|
|
8 |
Практична робота 8. Дослідження впливу різних чинників на швидкість хімічної реакції |
|
|
|
|
|
|
|
9 |
Практична робота 9. Оборотні і необоротні реакції |
|
|
|
|
|
|
|
10 |
Практична робота 10. Властивості етанової кислоти |
|
|
|
|
|
|
|
11 |
Практична робота 11. Розв᾿язування експериментальних задач |
|
|
|
|
|
|
|
12 |
Практична робота 12. Виявлення органічних сполук у харчових продуктах |
|
|
|
|
|
|
Графік успішності
|
12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
№1 |
№2 |
№3 |
№4 |
№5 |
№6 |
№7 |
№8 |
№9 |
№10 |
№11 |
№12 |
|
|
Оцінка |
|
Дата _____________
Практична робота №1
Тема роботи: Виготовлення розчину солі з певною масовою часткою розчиненої речовини
Мета роботи: виготовити запропоновані розчини солей, провівши необхіді розрахунки; продовжити формувати вміння працювати з мірним посудом, терезами, реактивами; формувати вміння самостійно виконувати досліди за поясненням у протоколі, виконувати досліди з дотриманням правил техніки безпеки
Обладнання і реактиви: натрій хлорид, барій хлорид, мідний купорос, дистильована вода, циліндри, мірні пробірки, лійки, колби, склянні палички.
![]() З правилами техніки безпеки ознайомлений___, зобов’язуюсь виконувати __________________________
З правилами техніки безпеки ознайомлений___, зобов’язуюсь виконувати __________________________
|
Хід роботи |
Розрахунки |
Результат |
|
Дослід 1 З води і кристалічної речовини виготовити 50г 11% розчину кухонної солі, провести необхідні розрахунки. Порядок виконання: 1.Обчисліть масу солі необхідної для приготування розчину (розрахунки записати у вигляді задачі). 2. Зважте на терезах наважку солі .3. Відміряйте необхідний об’єм води. 4. Помістіть у колбу зважену наважку і додайте виміряний об’єм води, перемішайте її вміст до повного розчинення солі.
|
Розчин №1 Дано: Розв’язок:
|
Для приготування розчину №1 (50г 11% розчину) треба взяти________г натрій хлориду і ______мл води
|
|
Дослід 2 Виготовити 60г 15% розчину купрум(ІІ)сульфату з кристалогідрату і води, провівши необхідні розрахунки. |
Розчин №2 Дано: Розв’язок:
|
Для приготування розчину №2 (60г 15% розчину купрум(ІІ) сульфату) треба взяти________г мідного купоросу і______мл води |
Зробіть висновок про те, чого ви навчилися у ході практичної роботи.
Під час виконання практичної роботи я навчи________________________________________________________________________________
________________________________________________________________________________________________________________________
Висновок:_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________
Додаткове завдання
|
Провести розрахунки для виготовлення 60г 15% розчину барій хлориду з 10% та 30% розчину цієї ж солі |
|
|
Оцінка |
|
Дата _____________
Практична робота № 2
Тема роботи: Приготування розчину солі з заданою молярною концентрацією розчиненої речовини
Мета роботи: виготовити розчин солі із заданою молярною концентрацією, провівши необхідні розрахунки; продовжити формувати вміння працювати з мірним посудом, терезами, реактивами; формувати вміння самостійно виконувати досліди за поясненням у протоколі, виконувати досліди з дотриманням правил техніки безпеки
Обладнання і реактиви: натрій карбонат, дистильована вода, циліндри, мірні пробірки, лійки, колби, скляні палички.
![]()
З правилами техніки безпеки ознайомлен___, зобов’язуюсь виконувати __________________________
|
Хід роботи |
Розрахунки |
Результат |
|
Дослід 1 З води і кристалічної речовини виготовити 50мл децимолярного (0,1 М) розчину натрій карбонату, здійснивши необхідні розрахунки. Порядок виконання: 1.Обчисліть масу солі необхідної для приготування розчину (розрахунки записати у вигляді задачі). 2. Зважте на терезах наважку солі 3. Висипте зважену сіль у мірну колбу відповідного об’єму 4. Добавте в мірну колбу дистильовану воду на 1/2 її об’єму, перемішайте її вміст до повного розчинення солі, додайте води до позначеної риски.
|
Розчин №1 Дано: Розв’язок:
|
Для приготування розчину №1 (50 мл 0,1М розчину натрій карбонату) треба взяти________г натрій карбонату і ______мл води
|
|
Розрахункова задача: Визначте молярну концентрацію солі в розчині, одержаному при розчиненні 50 г калій сульфату у воді об’ємом 250 мл, якщо густина добутого розчину становить 1,1 г/мл .
|
Дано: Розв’язок:
|
Відповідь: |
Зробіть висновок про те, чого ви навчилися у ході практичної роботи.
Під час виконання практичної роботи я навчи________________________________________________________________________________
________________________________________________________________________________________________________________________
Висновок:_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Додаткове завдання
|
Обчисліть молярну концентрацію натрій карбонату у розчині, якщо масова частка солі дорівнює 16%, а густина розчину 1,17г/см3 |
|
|
Оцінка |
|
Дата _____________
Практична робота №3
Тема роботи: Приготування розчину солі з заданою молярною концентрацією еквівалентів розчиненої речовини
Мета роботи: виготовити розчин солі із заданою молярною концентрацієюеквівалентів, провівши необхідні розрахунки; продовжити формувати вміння працювати з мірним посудом, терезами, реактивами; формувати вміння самостійно виконувати досліди за поясненням у протоколі, виконувати досліди з дотриманням правил техніки
Обладнання і реактиви: кобальт(ІІ) сульфат, дистильована вода, циліндри, мірні пробірки, лійки, колби, скляні палички.
![]()
З прав З праилами техніки безпеки ознайомлен___, зобов’язуюсь виконувати __________________________
|
Хід роботи |
Розрахунки |
Результат |
|
Дослід 1 З води і кристалічної речовини виготовити 50мл децинормального (0,1н) розчину кобальт(ІІ)сульфату, здійснивши необхідні розрахунки. Порядок виконання: 1.Обчисліть масу солі необхідної для приготування розчину (розрахунки записати у вигляді задачі). 2. Зважте на терезах наважку солі 3. Висипте зважену сіль у мірну колбу відповідного об’єму 4. Добавте в мірну колбу дистильовану воду на 1/2 її об’єму, перемішайте її вміст до повного розчинення солі, додайте води до позначеної риски.
|
Розчин №1 Дано: Розв’язок:
|
Для приготування розчину №1(50 мл 0,1н розчину кобальт(ІІ)сульфату) треба взяти________г кобальт(ІІ)сульфату і ______мл води
|
|
Розрахункова задача: Визначте молярну концентрацію еквівалента хлороводню в розчині, одержаному при зливанні 300 мл 0,2н. та 600 см3 0,7 н. розчинів хлоридної кислоти.
|
Дано: Розв’язок:
|
Відповідь: |
Зробіть висновок про те, чого ви навчилися у ході практичної роботи.
Під час виконання практичної роботи я навчи________________________________________________________________________________
________________________________________________________________________________________________________________________
Висновок:_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Додаткове завдання:
|
Обчисліть молярну концентрацію еквівалентів натрій карбонату у розчині, якщо масова частка солі дорівнює 16%, а густина розчину 1,17г/см3
|
|
Дата _____________
|
Оцінка |
|
Практична робота № 4
Тема роботи: Реакції йонного обміну між розчинами електролітів
Мета роботи: дослідити умови пербігу реакцій у розчинах електролітів, продовжити формувати вміння працювати з хімічним посудом та реактивами; формувати вміння самостійно виконувати досліди за поясненням у протоколі, виконувати досліди з дотриманням правил техніки
Обладнання: штатив з пробірками або планшетки, скляні палички, піпетки
Реактиви: розчини натрій хлориду, калій броміду і натрій йодиду, арґентум(І)нітрату, натрій гідроксиду, хлоридної кислоти, сульфатної кислоти, фенолфталеїн.
![]() в З правилами техніки безпеки ознайомлений(а),
в З правилами техніки безпеки ознайомлений(а),
зобов’язуюсь виконувати __________________________________________________
Завдання
Виконати досліди, результати записати у таблицю
|
Хід роботи |
Спостереження |
Рівняння реакцій Написати рівняння у молекулярній, повній і скороченій йонних формах |
Висновки |
|
1.Реакції, що відбуваються з утворенням осаду У три пронумеровані пробірки налийте по 1-2мл розчинів солей: І—натрій хлориду, у ІІ— калій броміду, у ІІІ—натрій йодиду. До кожної додати по декілька крапель арґентум(І)нітрату.
|
№1
№2
№3
|
|
|
|
2. Реакції, що відбуваються з виділенням газу У пробірку помістіть трохи крейди, додайте по краплям розчин сульфатної кислоти. |
|
|
|
|
3. Реакції, що відбуваються з утворенням малодисоційованої речовини У пробірку налийте 1-2мл розчину натрій гідроксиду, додайте 1-2краплі фенолфталеїну. Що спостерігаєте? Доливайте краплями хлоридну кислоту до знебарвлення рідини. |
|
|
|
Зробіть висновок про те, чого ви навчилися у ході практичної роботи.
Під час виконання практичної роботи я навчи________________________________________________________________________________
________________________________________________________________________________________________________________________
Загальний висновок.
Реакції між розчинами електролітів відбуваються за таких умов:
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Додаткове завдання:
|
Підберіть два приклади реакцій до запропонованої схеми: Н++ СО32-→Н2О+СО2
|
|
Дата _____________
|
Оцінка |
|
Практична робота № 5
Тема роботи: Розв’язування експериментальних задач на визначення рН розчинів і гідроліз солей
Мета роботи: розвязати запропоновані експериментальні задачі, визначивши рН розчинів, визначити як гідролізують різні солі, продовжити формувати вміння працювати з хімічним посудом та реактивами; формувати вміння самостійно виконувати досліди за поясненням у протоколі, виконувати досліди з дотриманням правил техніки
Обладнання: штатив з пробірками або планшетки, скляні палички
Реактиви: універсальний індикатор,дистильована вода, розчини хлоридної кислоти, натрій гідроксиду, натрій карбонату, барій хлориду, ферум(ІІ) сульфату
![]()
З правилами техніки безпеки ознайомлен___, зобов’язуюсь виконувати ________________________________
|
Хід роботи |
Спостереження |
Рівняння реакцій |
Висновки |
|
Дослід 1. Визначення рН розчинів Нанесіть на універсальний індикатор паличкою або піпеткою 1-2краплі запропонованого розчину. Порівняйте забарвлення вологої плями на папірці з кольоровою шкалою. Зробіть висновок про рН розчину. |
Що спостерігаєте? №1
№2
№3
|
Написати рівняння реакції дисоціації |
рН кислоти
рН лугу
рН води
|
|
Дослід 2 Гідроліз солей В три пронумеровані пробірки налийте по 1мл розчинів: у І-натрій карбонат, у ІІ-ферум(ІІ)сульфат, у ІІІ-барій хлорид. За допомогою смужок універсального індикатора визначте рН кожного розчину.
|
Що спостерігаєте? №1
№2
№3
|
Написати рівняння гідролізу у молекулярній, повній і скороченій йонних формах
|
|
Зробіть висновок про те, чого ви навчилися у ході практичної роботи.
Під час виконання практичної роботи я навчи________________________________________________________________________________
________________________________________________________________________________________________________________________
Висновок.
рН кислоти може бути в межах________________________, рН лугу____________________________, рН води________________________
Гідроліз-це процес________________________________________________________________________________________________________
________________________________________________________________________________________________________________________
Солі, утворені сильною основою і сильною кислотою у водному розчині__________________________________________________________
Солі, утворені сильною основою і слабкою кислотою у водному розчині__________________________________________________________
________________________________________________________________________________________________________________________
Солі утворені слабкою основою і сильною кислотою у водному розчині___________________________________________________________
Додаткове завдання:
|
Визначте за рівняннями гідролізу рН розчину питної соди і кухонної солі. |
|
|
Оцінка |
|
Дата _____________
Практична робота № 6
Тема роботи: Розв’язування експериментальних задач
Мета роботи: розвязати експериментальні задачі, довівши наявність певних катіонів та аніонів, продовжити формувати вміння працювати з хімічним посудом та реактивами; формувати вміння самостійно виконувати досліди за поясненням у протоколі, виконувати досліди з дотриманням правил техніки
Обладнання: штатив з пробірками або планшетки, скляні палички, піпетки
Реактиви: розчини купрум(ІІ)сульфату, барій хлориду, арґентум нітрату, натрій хлориду, сульфатної кислоти, натрій гідроксиду
![]() в
в
З правилами техніки безпеки ознайомлен___, зобов’язуюсь виконувати __________________________________________________
|
Хід роботи |
Спостереження |
Рівняння реакцій (написати в молекулярній, повній і скороченій йонній формі) |
Висновки
|
||||||||
|
Дослід 1. Визначення речовин В чотирьох пронумерованих пробірках містяться розчини купрум (ІІ) сульфату, барій хлориду,арґентум нітрату, ферум(ІІІ)хлориду. Доведіть наявність кожного з них. В першу аліквоту додаю___________ ____________________________ |
|
|
В пробірці №__
|
||||||||
|
В другу аліквоту додаю____________ ____________________________ |
|
|
В пробірці №____
|
||||||||
|
В третю аліквоту додаю__________ ____________________________ |
|
|
В пробірці №____
|
||||||||
|
В четверту аліквоту додаю________ |
|
|
В пробірці №____
|
||||||||
|
Дослід 2. Добування речовин Здійснити наступні перетворення: Купрум(ІІ)сульфат→купрум(ІІ) гідроксид→купрум(ІІ)оксид |
1)До розчину купрум(ІІ) сульфату додаю___________
утворюється______________ 2)При ___________________
утворюється______________
|
|
|
||||||||
|
Розрахункова задача Обчислити кількість речовини йонів Феруму і сульфат-йонів, які містяться в розчині ферум(ІІІ)сульфату масою 200г з масовою часткою солі 20%, якщо ступінь дисоціації електроліту 90%. |
Дано:
Знайти:
|
Розв’язання:
|
Відповідь: в розчині
|
Зробіть висновок про те, чого ви навчилися у ході практичної роботи.
Під час виконання практичної роботи я навчи________________________________________________________________________________
________________________________________________________________________________________________________________________
Загальний висновок
Реактивом на катіон Купрум(2+) є_________________________________________________________________________________________
Реактивом на катіон Барію є_____________________________________________________________________________________________
Реактивом на катіон Аргентум(+) є________________________________________________________________________________________
Реактивом на катіон Ферум(3+) є__________________________________________________________________________________________
Реактивом на Хлорид-аніон є______________________________________________________________________________________________
Реактивом на Сульфат-аніон є____________________________________________________________________________________________
Купрум(ІІ)гідроксид можна добути________________________________________________________________________________________,
а купрум(ІІ) оксид______________________________________________________________________________________________________.
Додаткове завдання:
|
Як в домашніх умовах розрізнити питну соду, кухонну сіль і цукор?Відповідь аргументуйте. |
|
|
Оцінка |
|
Дата_____________
Практична робота № 7
Тема роботи: Окисно-відновні реакції
Мета роботи: Закріпити знання і уявлення щодо визначення реакцій, які відбуваються із зміною ступеня окиснення атомів елементів, закріпити вміння складати окисно-відновний біланс, визначати окисники та відновники, продовжити формувати вміння працювати з хімічним посудом та реактивами; формувати вміння самостійно виконувати досліди за поясненням у протоколі, виконувати досліди з дотриманням правил техніки
Обладнання: хімічний стакан, плоскодонні конічні колби, піпетки, пінцет або нитки, наждак
Реактиви: розчини купрум(ІІ)сульфат, калій перманганат, натрій нітрит, ферум(ІІ) сульфат, сульфатна кислота, залізний цвях, дистильована вода
![]() З правилами техніки безпеки ознайомлен____, зобов’язуюсь виконувати_____________
З правилами техніки безпеки ознайомлен____, зобов’язуюсь виконувати_____________
|
Хід роботи |
Спостереження |
Рівняння реакцій Складіть окисно-відновний баланс |
Висновки |
|
Дослід 1. Взаємодія металів з розчинами солей Візьміть попередньо зачищений наждаком залізний цвях. Опустіть його у стакан з розчином купрум(ІІ) сульфату. Через 3-5хв вийміть цвях з розчину. Що спостерігаєте на його поверхні? Знову опустіть цвях у стакан до зміни кольору розчину солі. Яким став колір розчину?Чому? |
Який колір має розчин купрум(ІІ)сульфату?
________________________
Що спостерігаєте на поверхні залізного цвяха? _______________________ |
|
Окисником є а відновником -
_______________.
відновлюється |
|
Дослід 2. Дослідження окисно-відновних властивостей калій перманганату В конічну плоскодонну колбу за допомогою піпетки помістіть 2мл розчину калій перманганату. Додайте 5 крапель розчину сульфатної кислоти. По краплях додавайте розчин ферум(ІІ)сульфату до зміни забарвлення. Вміст колби перемішуйте після додавання кожної краплі розчину ферум(ІІ)сульфату.
|
Який колір має розчин калій перманганату?
________________________
Які зміни кольору відбулися в результаті експерименту?
|
|
Калій перманганат у кислому середовищі виступає
_______________
ферум(ІІ)сульфат
_______________ |
Зробіть висновок про те, чого ви навчилися у ході практичної роботи.
Під час виконання практичної роботи я навчи________________________________________________________________________________
________________________________________________________________________________________________________________________
Загальний висновок
![]() Окиснення—це процес__________________________________________________________________________________________________
Окиснення—це процес__________________________________________________________________________________________________
![]() Відновлення—це процес_________________________________________________________________________________________________
Відновлення—це процес_________________________________________________________________________________________________
![]() Відновник в результаті реакції ____________________, _________________ електрони.
Відновник в результаті реакції ____________________, _________________ електрони.
![]() Окисник в результаті реакції _____________________, __________________електрони.
Окисник в результаті реакції _____________________, __________________електрони.
Залізо в окисно-відновних реакціях виступає ___________________ і _________________, а катіони Сu2+ виступають ________________ і_________________.
Калій перманганат у кислому середовищі виступає_____________________ і _________________до ___________________,
а ферум(ІІ)сульфат _____________________ і _________________відповідно до
![]() Окисниками в хімічних реакціях виступають елементи з __________________ступенем окиснення, а відновниками елементи з
Окисниками в хімічних реакціях виступають елементи з __________________ступенем окиснення, а відновниками елементи з
________________ступенем окисненням
Додаткове завдання:
|
Написати рівняння розкладу калій перманганату. Урівняти реакцію методом окисно-відновного балансу.
|
|
|
Оцінка |
|
Дата__________
Практична робота № 8
Тема роботи: Дослідження впливу різних чинників на швидкість хімічної реакції
Мета роботи: дослідити, як різні чинники впливають на швидкість хімічної реакції, продовжити формувати вміння працювати з хімічним посудом та реактивами; формувати вміння самостійно виконувати досліди за поясненням у протоколі, виконувати досліди з дотриманням правил техніки
Обладнання та реактиви: зразки металів(магній, цинк, мідь), порошок і гранули цинку, хлорид на кислота(концентрована і розбавлена),розчин пероксиду водню(пергідроль), сульфатна кислота, манган(ІV)оксид, тіосульфат натрію, сульфатна кислота, штатив з пробірками, нагрівальний прилад, шпателі, пінцети, скіпка дерев’яна, водяна баня з льодом, гаряча водяна баня.
![]()
З правилами техніки безпеки ознайомлен____, зобов’язуюсь виконувати_____________
|
Хід роботи |
Спостереження |
Рівняння реакцій |
Висновки |
|
1.Вплив природи реагуючих речовин У три пронумеровані пробірки помістіть метали: магній, цинк і мідь. До кожного додайте 1-2мл розчину хлоридної кислоти
|
Яка інтенсивність виділення газу? |
|
|
|
2.Вплив концентрації реагуючих речовин У першу пробірку налийте 1-2мл розбавленої хлоридної кислоти, у другу—1-2мл концентрованої хлоридної кислоти. До кожної пробірки одночасно додайте по 1 гранулі цинку.
|
Яка інтенсивність виділення газу? |
|
|
|
3.Вплив прощі поверхні реагуючих речовин У дві пронумеровані пробірки налийте по 2мл хлоридної кислоти. Одночасно внесіть у першу пробірку порошок цинку, у другу—гранули цинку. |
Яка інтенсивність виділення газу? |
|
|
|
4.Вплив температури Налийте у три пронумеровані пробірки по 1-2мл розчину натрій тіосільфату, і у інші три—розчин сульфатної кислоти. Сформуйте 3 пари взаємодії. Першу пару речовин помістіть у кристалізатор з льодом, ІІ—залиште за кімнатної температури, ІІІ-на гарячу водяну баню. Зачекайте 10хв. Витягніть розчини і змішайте пари розчинів одночасно. |
|
|
|
|
5. Вплив каталізаторів У пробірку налийте 2мл розчину пероксиду водню, долийте 2мл сульфатної кислоти, додайте кілька кристаликів манган(ІV ) оксиду. Внесіть у пробірку тліючу скіпку.
|
Який газ виділяється? Як це перевірити?
|
|
|
Зробіть висновок про те, чого ви навчилися у ході практичної роботи.
Під час виконання практичної роботи я навчив_______________________________________________________________________________
________________________________________________________________________________________________________________________
Загальний висновок
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Додаткове завдання:
|
Як зміниться швидкість хімічної реакції утворення амоніаку з простих речовин, якщо концентрацію водню збільшити втричі. водн |
|
|
Оцінка |
|
Дата__________
Практична робота № 9
Тема роботи: Оборотні і необоротні реакції
Мета роботи: дослідити умови перебігу оборотних і необоротних реакцій, продовжити формувати вміння працювати з хімічним посудом та реактивами; формувати вміння самостійно виконувати досліди за поясненням у протоколі, виконувати досліди з дотриманням правил техніки
![]() Обладнання та реактиви: розчини:кобальт (ІІ) сульфат, алюміній нітрат, натрій карбонат, хлоридна кислота, натрій гідроксид, калій дихромат; штатив з пробірками, піпетки.
Обладнання та реактиви: розчини:кобальт (ІІ) сульфат, алюміній нітрат, натрій карбонат, хлоридна кислота, натрій гідроксид, калій дихромат; штатив з пробірками, піпетки.
З правилами техніки безпеки ознайомлен____, зобов’язуюсь виконувати_____________
|
Хід роботи |
Спостереження |
Рівняння реакцій |
Висновки |
|
1.Необоротні реакції, які відбуваються з утворенням нерозчинної речовини У дві пронумеровані пробірки налийте 1-2мл розчинів: у І- кобальт (ІІ) сульфат,у ІІ- алюміній нітрат. До кожної долийте 1-2мл розчину натрій гідроксиду. |
№1
№2 |
|
Необоротними є реакції, під час яких
|
|
2. Необоротні реакції, які відбуваються з утворенням газоподібної речовини У пробірку налийте 1-2млрозчину натрій карбонату, по краплям додавайте розчин хлоридної кислоти .
|
|
|
Необоротними є реакції, під час яких
|
|
3. Необоротні реакції, які відбуваються з утворенням слабкого електроліту У пробірку налийте 1-2мл розчину натрій карбонату, додайте кілька крапель фенолфталеїну. По краплям додавайте розчин хлоридної кислоти.
|
|
|
Необоротними є реакції , під час яких
|
|
4.Оборотні реакції Налийте у дві пронумеровані пробірки по 2-3мл розчину калій дихромату. Першу залиште для контролю. У другу додайте кілька крапель розчину лугу до зміни забарвлення. Потім додайте по краплях розчин хлоридної кислоти до зміни забарвлення. Дослід повторіть. |
|
|
Оборотними є реакції, під час яких |
Зробіть висновок про те, чого ви навчилися у ході практичної роботи.
Під час виконання практичної роботи я навчився(лась)_______________________________________________________________________
_______________________________________________________________________________________________________________________
Загальний висновок
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Додаткове завдання:
|
Як вплине на зміщеня хімічної рівноваги реакції 3Н2+N2→2NH3; ΔН= -92кДж. а)підвищення тиску; б)зменшення температури. Відповідь поясніть. |
|
Дата__________
|
Оцінка |
|
Практична робота № 10
Тема: Властивості етанової кислоти
Мета: дослідити властивості етанової кислоти, продовжити формувати вміння працювати з хімічним посудом та реактивами; формувати вміння самостійно виконувати досліди за поясненням у протоколі, виконувати досліди з дотриманням правил техніки
Обладнання: Штатив з пробірками або планшетки, шпатель, піпетки.
Реактиви: індикатор метилоранж, фенолфталеїн, лакмус, порошок магнію, натрій карбонат(порошок) , розчин етанової кислоти(0,1М)
![]()
З правилами техніки безпеки ознайомлен____, зобов’язуюсь виконувати_____________
|
Хід роботи |
Спостереження |
Рівняння реакцій |
Висновки |
|
№ 1. Дія на індикатори У три пронумеповані пробірки чи лунки планшетки налийте розчин етанової кислоти, додайте індикатори: у І-Метилоранж, у ІІ-фенол-фталеїн, у ІІІ- лакмус, у ІV-універсальний.
|
№1
№2
№3
№4
|
|
|
|
№ 2 Взаємодія з металами У дві пронумеровані пробірки налийте по 1 мл розчину етанової кислоти, у І додайте порошок магнію, у ІІ- мідний дріт.
|
№1
№2
|
Складіть окисно-відновний баланс
|
|
|
№3. Взаємодія із сіллю У дві пробірки налийте по 1мл розчину етанової кислоти. В першу додайте порошок натрій карбонату, а в другу—порошок натрій хлориду..
|
№1
№2
|
Складіть молекулярні й йонні реакцій
|
|
Зробіть висновок про те, чого ви навчилися у ході практичної роботи.
Під час виконання практичної роботи я навчи_______________________________________________________________________________
________________________________________________________________________________________________________________________
Загальний висновок:______________________________________________________________________________________________________ _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Додаткове завдання:
|
Здійснити перетворення: C2Н6→ C2Н4 → C2Н5 ОН → CН3СНО→ CН3СООН
|
|
|
Оцінка |
|
Дата__________
Практична робота № 11
Тема: Розв᾿язування експериментальних задач
Мета: ознайомитися з властивостями етанолу, етанової кислоти, гліцеролу, глюкози; продовжити формувати вміння працювати з хімічним посудом та реактивами; формувати вміння самостійно виконувати досліди за поясненням у протоколі, виконувати досліди з дотриманням правил техніки
Обладнання: Штатив з пробірками, піпетки, нагрівальний прилад, водяна баня
![]() Реактиви: розчин етанолу, етанової кислоти, гліцеролц, глюкози, мідна дротинка, ферум(ІІІ)хлорид,купрум(ІІ)сульфат, натрій гідроксид, аміачний розчин срібла, дистильована вода.
Реактиви: розчин етанолу, етанової кислоти, гліцеролц, глюкози, мідна дротинка, ферум(ІІІ)хлорид,купрум(ІІ)сульфат, натрій гідроксид, аміачний розчин срібла, дистильована вода.
З правилами техніки безпеки ознайомлен____, зобов’язуюсь виконувати_____________
|
Хід роботи |
Спостереження |
Рівняння реакцій |
Висновки |
|
№1 Окиснення етанолу У пробірку налийте 2мл концентрованого розчину етанолу. Мідну дротинку прокаліть у полумї пальника до появи чорного забарвлення. Прожарену мідну дротинку опустіть у розвин етанолу до появи запаху.
|
Що відувається із мідною дротинкою при прожарюванні?
Який запах відчувається?
|
|
|
|
№2 Якісна реакція на етанову кислоту У пробірку налийте 3краплі етанової кислоти і з краплі води, розчин нейтралізуйте розчином лугу, перевірте лакмісовим папарцем. Додайте 2-3 краплі ферум(ІІІ) хлориду і нагрійте до кипіння до утворення осаду. |
Якого кольору утворюється осад?
|
|
|
|
№3. Властивості гліцеролу До розчину гліцеролу додайте свіжовиготовлений осад купрум(ІІ)гідроксиду до розчинення осаду.
|
Чому осад розчиняється? |
|
|
|
№4 Окиснення глюкози В пробірну налийте 1-2мл розчину глюкози, додайте 1 мл аміачного розчину срібла, суміш поставте на водяну баню до утворення осаду на стінках пробірки.
|
|
|
|
Зробіть висновок про те, чого ви навчилися у ході практичної роботи.
Під час виконання практичної роботи я навчи_______________________________________________________________________________
________________________________________________________________________________________________________________________
Загальний висновок:_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Додаткове завдання:
|
Обчисліть масу естеру, яку можна добути з атанолу масою 46г і етанової кислоти масою 60г, якщо вихід продукту реакціїт 80%. |
|
Дата__________
|
Оцінка |
|
Практична робота № 12
Тема: Виявлення органічних сполук у харчових продуктах
Мета: виявити органічні продукти в харчових продуктах; продовжити формувати вміння працювати з хімічним посудом та реактивами; формувати вміння самостійно виконувати досліди за поясненням у протоколі, виконувати досліди з дотриманням правил техніки
Обладнання: штатив з пробірками, склянні палички, предметні скельця, шпатель, хімічний стакан, мірні пробірки
Реактиви: зразки харчових продуктів(картопля, білий хліб, сосиски, ковбаса, яблуко, варені макарони, тощо), розчин йоду, молоко, розчин етанолу, концентрована нітратна кислота
![]()
З правилами техніки безпеки ознайомлен____, зобов’язуюсь виконувати_____________
Виконайте завдання, результати роботи оформіть у вигляді таблиці.
|
Хід роботи |
Спостереження |
Рівняння реакцій |
Висновки |
|
1)Виявлення крохмалю у харчових продуктах» Визначте за якісною реакцією на йод чи міститься крохмаль у запропонованих харчових продуктах (картопля, білий хліб, сосиски, ковбаса, яблуко, варені макарони, тощо). Для цього на зразок продукту нанесіль декілька крапель розчину йоду |
|
|
|
|
2) Виявлення білка в молоці У хімічний стакан налийте 5мл молока, додайте 10мл води і 1мл етанолу. Суміш перемішатйе, вайте відстоятися і профільтруйте. Осад на фільтрі промийте, висушіть у сушильній шафі, а потім дадайте по краплям коцентрований розчин нітратної кислоти. |
Якого кольору осад?
Яке забарвлення утворюєтся при додаванні нітратної кислоти?
|
|
|
Зробіть висновок про те, чого ви навчилися у ході практичної роботи.
Під час виконання практичної роботи я навчи_______________________________________________________________________________
________________________________________________________________________________________________________________________
Загальний висновок:__________________________________________________________________________________________________ _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Додаткове завдання:
|
Аміноетанова кислота масою 30г прореагувала з натрій гідроксидом. Яка маса натрій гідрокисду вступила в реакцію? |
|
Список використаних джерел
- О. Березан. Збірник задач з хімії.-Тернопіль:Підручники і посібники,2006.-302с.
- А.М. Бутенко. Хімія для загальноосвітніх навчальних закладів з поглибленим вивченням хімії: підручник для 9-го класу загальноосвітніх навчальних закладів._Х.: Гімназія, 2017.-320с,іл.
- Н.М. Буринська, В.М.Депутат, Г.Ф. Сударева, Н.Н. Чайченко. « Хімія » Профільний рівень.Київ. :« Педагогічна думка ». 2010.
- Державний стандарт базової і повної загальної середньої освіти ( від 14 січня 2004 р. № 24 )
- Правила безпеки під час проведення навчально – виховного процесу в кабінетах фізики та хімії загальноосвітніх навчальних закладів.( наказ МНС від 16.07 2012 № 902 ).
- М.М.Савчин. Збірник задач з неорганічної хімії.Для загальноосвітніх шкіл, ліцеїв і гімназій.8-10класи.-Львів:ВНТЛ-Класика,2004.-160с.
- О.Г.Ярошенко. Збірник задач і вправ з хімії:Навчальний посібник./О.Г.Япрошенко.-К.:Видавничий дім «Освіта»,2015.-272с.
Інтернет-сайти:
- mon.gov.ua;
- http://chemists.at.ua;
- http://school.xvatit.com;
- http://osvita.ua
Додаток№1
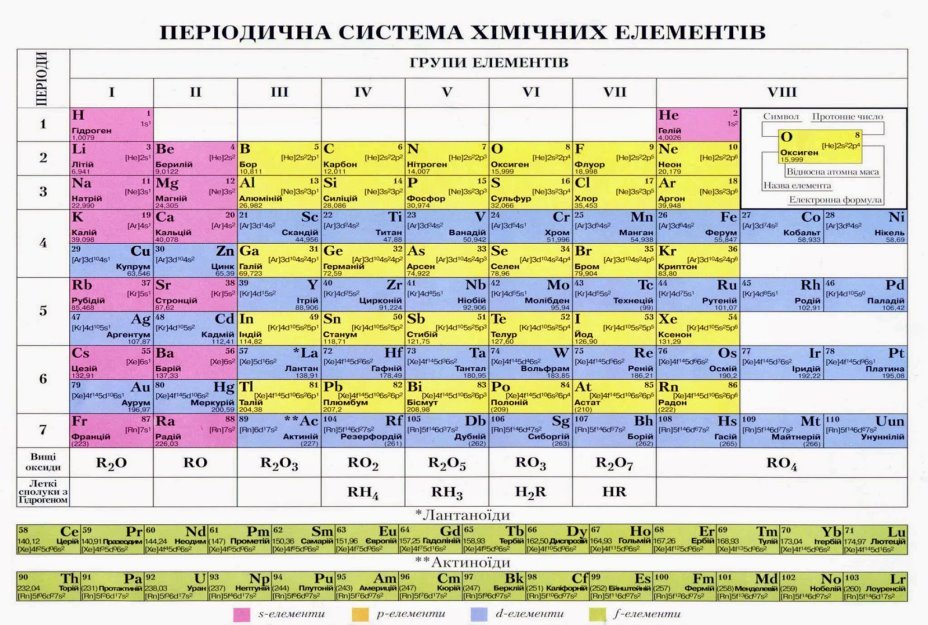
Додаток №2
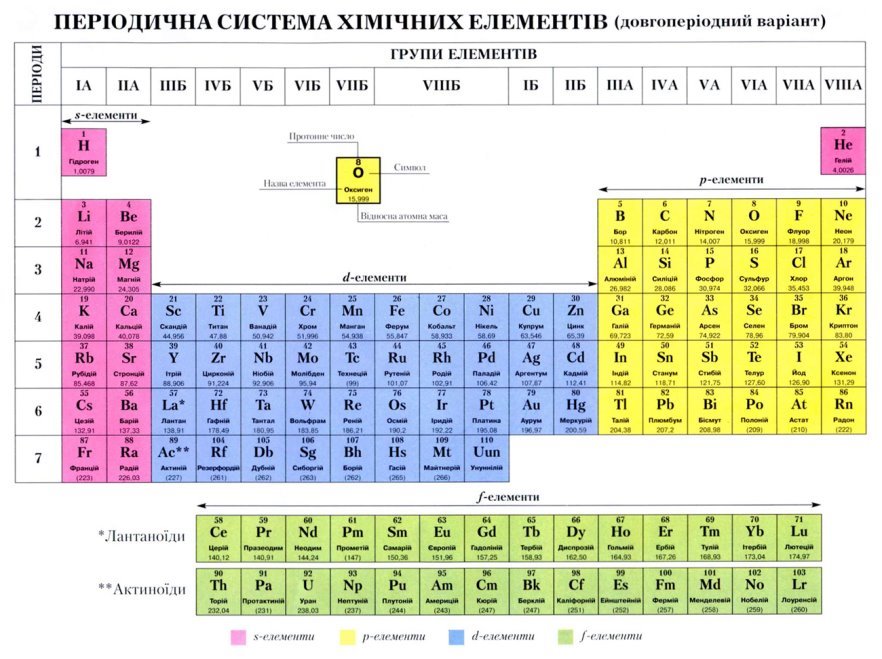
Додаток №3
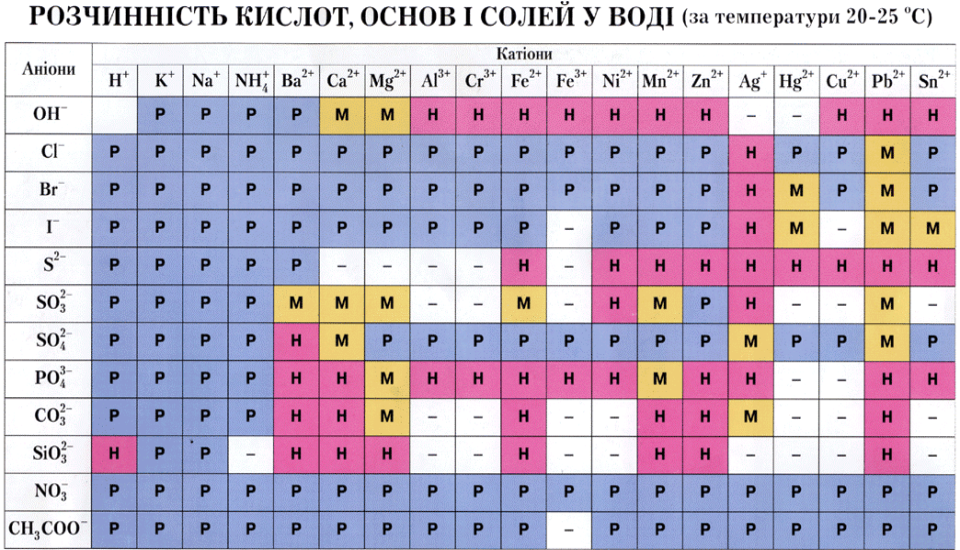
Додаток №4

1


про публікацію авторської розробки
Додати розробку
