Презентація. 11 клас. Практична робота "Дослідження якісного складу солей"
Про матеріал
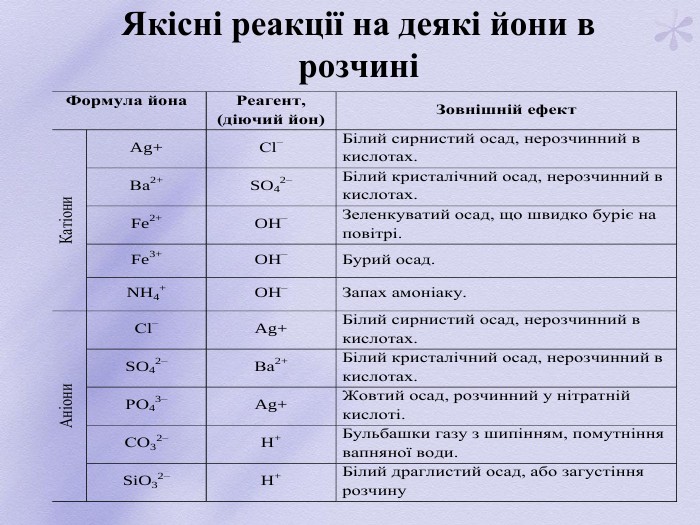
Презентація. 11 клас. Практична робота "Дослідження якісного складу солей". Закріпити вміння та набути навичок самостійно виконувати досліди; використовувати теоретичні знання про якісні реакції для солей; проводити якісні реакції й визначати в розчинах йони; аналізувати результати досліджень; складати рівняння якісних реакцій, характерних для солей; звіт про виконану роботу; робити висновки з проведених досліджень.
Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку