155 років періодичній системі хімічних елементів.

















* Передумови створення періодичного закону 1. До середини XIX століття було 63 елементи. 2. Дано поняття про хімічний елемент. 3. Визначено молярні маси елементів. 4. Введено поняття про валентність. 5. Введено поняття про хімічний зв'язок. 6. Перша спроба класифікації елементів. Доберейнер 1817 р. Закон тріад. 7. Друга спроба класифікації елементів. Дж. Ньюленд «за зростанням атомних мас». Закон октав. 8. Третя спроба класифікації. Генріх «Радикально-кругова таблиця». 9. Четверта спроба класифікації елементів. Шанкартуа «Гвинтові сходи». 10. П'ята спроба класифікації. «Томсон - Бор»
* Антуан Лавуазье Французький хімік, з 1772 р. член Паризької АН. Народився у Парижі. У 1764 р. закінчив юридичний факультет Паризького університету. Слухав курс лекцій з хімії у Ботанічному саду в Парижі у 1764-1766 рр. У 1775-1791 pp. директор Управління порохів та селітр. Один із основоположників класичної хімії. Ввів у хімію суворі кількісні методи дослідження. Своїми експеримен-тальними роботами - спалювання сірки і фосфору, нагріванням олова в герметично запаяній посудині - започаткував спростування теорії флогістону в 1774 р. З метою перевірки дослідів К. В. Шееле та Дж. Дальтона доказав, що процес дихання подібний до горіння і що утворення вуглекислого газу дихання є основним джерелом теплоти в живому організмі.
* Деберейнер Иоганн Вольфганг (1780-1849) Німецький хімік. Народився у Хофі. Навчався самостійно. З 1810 р. професор Йенського університету. Дослідження присвячені проблемам класифікації елементів, вивченню платинових металів, каталізу. Виявив у 1821 та 1822 рр., що дрібно роздроблена платина (платинова чернь) здатна викликати, сама при цьому не змінюючись, хімічні реакції, наприклад окислення винного спирту в оцтову кислоту або сірчистого ангідриду в сірчаний. Ці роботи поряд із дослідженнями Г. Деві заклали основу каталітичної хімії з використанням платини. Помітив у 1817 р., а потім у 1829 р., якщо в тріадах кальцій - стронцій - барій; літій – натрій – калій; сірка - селен - телур і хлор - бром - йод елементи розташовані в порядку зростання їх атомних мас, то атомна маса середнього з них приблизно дорівнює напівсумі атомних мас двох крайніх. Це "правило тріад" було використано у подальших роботах з класифікації хімічних елементів
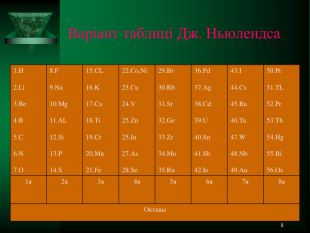
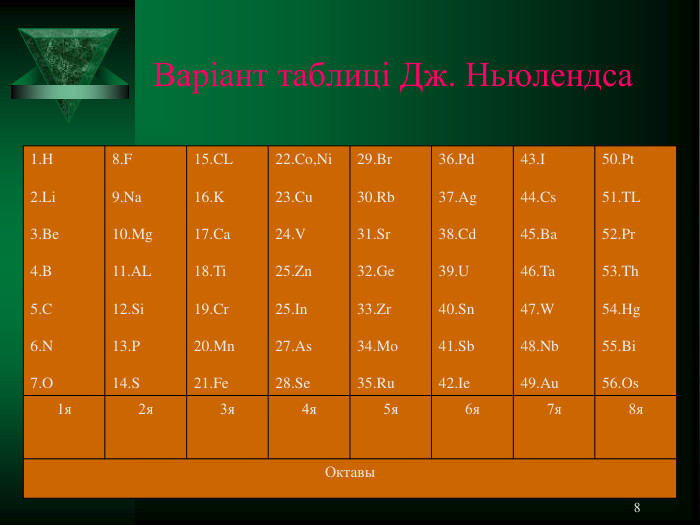
* ДЖОН НЬЮЛЕНДС У статті, датованій 20 серпня 1864 р., він зазначив, що в цьому ряду спостерігається періодична поява хімічно подібних елементів. Пронумерувавши елементи (елементи, що мають однакові ваги, мали і той самий номер) і зіставивши номери з властивостями елементів, Ньюлендс зробив висновок: «Різниця у номерах найменшого члена групи і наступного його дорівнює семи; інакше кажучи, восьмий елемент, починаючи з даного елемента, є свого роду повторенням першого, подібно до восьмої ноти октави в музиці ... ». Тим самим їм вперше було висловлено ідею про періодичність зміни властивостей елементів. Через рік, 18 серпня 1865, Ньюлендс опублікував нову таблицю елементів, назвавши її «законом октав», який формулювався таким чином: «Номери аналогічних елементів, як правило, відрізняються або на ціле число сім, або на кратне семи; іншими словами, члени однієї і тієї ж групи співвідносяться один з одним у тому ж відношенні, як і крайні точки однієї або більше октав у музиці».
* Варіант таблиці Дж. Ньюлендса 1.H 2.Li 3.Be 4.B 5.C 6.N 7.O 8.F 9.Na 10.Mg 11.AL 12.Si 13.P 14.S 15.CL 16.K 17.Ca 18.Ti 19.Cr 20.Mn 21.Fe 22.Co,Ni 23.Cu 24.V 25.Zn 25.In 27.As 28.Se 29.Br 30.Rb 31.Sr 32.Ge 33.Zr 34.Mo 35.Ru 36.Pd 37.Ag 38.Cd 39.U 40.Sn 41.Sb 42.Ie 43.I 44.Cs 45.Ba 46.Ta 47.W 48.Nb 49.Au 50.Pt 51.TL 52.Pr 53.Th 54.Hg 55.Bi 56.Os 1я 2я 3я 4я 5я 6я 7я 8я Октавы
* Мейєр Лотар Німецький хімік, з 1888 р. член – кореспондент Берлінської АН. Народився у Фарелі (Ольденбург). До 1854 р. навчався у Вюрцбурзькому університеті, потім у Гейдельберзькому та Кенігсберзькому та в університеті Бреслау, доктор філософії в 1858 р. З 1859 р. працював в університеті Бреслау, з 1866 р. професор університету в Еберсвальді, з 1858 р. ,З 1876 р. Тюбінгенського університету. Роботи відносяться до неорганічної, органічної та фізичної хімії. Досліджував гази крові 1854 р., фізичні властивості вуглеводнів. Автор книги "Сучасні теорії хімії та їх значення для хімічної статики" у 1864 р., в якій зробив спробу дати систематику хімічних елементів. Після відкриття Д.І. Менделєєвим періодичного закону хімічних елементів опублікував у березні 1870 р. статтю "Природа хімічних елементів як функція їхньої атомної ваги", в якій навів графічну криву залежності атомних обсягів від атомної маси (крива Мейра). Іноземний член -кореспондент Петербурзької АН із 1809 р.
* Варіант Лотара Мейєра 4-атомные 3-атомные 2-атомные 1-атомные 1-атомные 2-атомные Разность масс Li(7) Be(8,3) C(12) N(14) O(16) F(19,9) Na(23) Ma(24 16 Si(28) P(31) S(32) CI(35,5) K(39) Ca(40) 16 - As(75) Se(79) Br(80) Rb(85) Sr(87,6) 45 Sn(117) Sb(120) Te(128) I(126) Cs(133) Ba(137) 45 Pb(207) Di(203) - - Ti(204) -- 90
* Менделєєв Дмитро Іванович (1834-1907) Русский ученый-энциклопедист, с 1876 г. член-корреспондент Петербургской АН. Родился в Тобольске. В 1855 г. окончил Главный педагогический институт в Петербурге. В 1855-1856 гг. учитель гимназии при Ришельевском лицее в Одессе. В 1857-1890 гг. преподавал в Петербургском университете, с 1865 г. профессор, одновременно в 1864-1872 гг. профессор Технологического института в Петербурге. В 1859 - феврале 1861 гг. находился в научной командировке за границей, работал в собственной лаборатории в Гейдельберге. С 1892 г. ученый хранитель Депо образцовых мер и весов, которое по его инициативе в 1893 г. преобразовано в Главную палату мер и весов, с 1893 г. управляющий. Наиболее полную характеристику Д. И. Менделееву дал Л. А. Чугаев: "Гениальный химик, первоклассный физик, плодотворный исследователь в области гидродинамики, метеорологии, геологии, в различных отделах химической технологии (взрывчатые вещества, нефть, учение о топливе) и других сопредельных с химией и физикой дисциплинах, глубокий знаток химической промышленности вообще, особенно русской, оригинальный мыслитель в области учения о народном хозяйстве..." Член и почетный член более 90 академий наук, научных обществ, университетов и институтов разных стран мира. Один из основателей в 1868 г. В честь Д. И. Менделеева названы химический элемент с порядковым номером 101, минерал, кратер на обратной стороне Луны, подводный горный хребет.
* Группы 1 2 3 4 5 6 7 8 H Элементы Li Be B C N O F 1 период 1 ряд Na Mg AI Si P S CI 2 ряд K Ca - Ti V Cr Mn Fe,Co,Ni,Cu 2 период 3 ряд Cu In - - As Se Br 4 ряд Rb Sr Y Zr Nb Mo - Ru,Rh,Pd,Ag 3 период 5 ряд Ar Cd Ih Sh Sb Te I 6 ряд Cs Ba - Ce - - - 4 период 7 ряд - - - - - - - 8 ряд - - - - Ta W - Os,Ir,Pt,Au 5 период 9 ряд Au Hg Ti Db Bi - - 10 ряд - - - Th - Ur - Высшая окись R2 O RO R2 O3 RO2 R2 O5 RO3 R2 O7 RO4 Высшие в.соед. RH4 RH3 RH2 RH Періодична система элементів 1870 г
* Хімічна вікторина 1. Какой химический элемент сначала обнаружили на Солнце потом на Земле 2. Какой элемент может быть легким, как сажа, а твердый как алмаз. 3. Какой цвет имеет иод. 4. Название элемента похоже на планету 5. Назвать химический элемент, состоящий из двух млекопитающих 6. Химический элемент названный в честь нашей страны 7. Химические элементы названные в честь городов 8. Элементы названные в честь стран 9. Самый распространенный элемент на планете 10. Назвать благородные металлы 11. Назвать металл, который обладает наивысшей электропроводностью 12. Назвать самый твердый металл 13. Назвать самый легкий металл 14. Назвать самый тяжелый металл 15. Какой цвет имеет хлор 16. Назвать аллотропную модификацию кислорода 17. Назвать второй по распространенности химический элемент 18. Назвать третий по распространенности химический элемент 19. Назвать газ необходимый для дыхания 20. Назвать самый сильный окислитель 21. Назвать жидкий металл 22. Назвать химический элемент №104 23. Назвать химический элемент №105 24. Назвать химический элемент №106 25. Назвать химический элемент №107 26. Назвать химический элемент №108
* Александр Блок видел в Дмитрии Ивановиче воплощение гения России. Периодическая система элементов знаменовала для поэта торжество космоса над хаосом, научное постижение гармонии и музыки природы Идеи Д.И. Менделеева и А.Н. Бекетова о развитии науки и производительных сил России отозвались в ряде стихотворений Блока.


про публікацію авторської розробки
Додати розробку