Кристалічні гратки. Атомні, молекулярні та йонні кристали.
Кристалічні гратки. Атомні, молекулярні та йонні кристали.
Мета: - Показати взаємоз’язок між будовою речовин та їхніми фізичними властивостями на основі знань про типи хімічних зв’язків у неорганічних речовинах;
- Ознайомити учнів із типами кристалічних граток ( атомними, молекулярними,йонними); сформувати вміння характеризувати фізичні властивості речовин за типом кристалічних граток і видом хімічного зв’язку;
- Формувати навички самостійної роботи, орієнтації в інформаційному просторі.
Тип уроку: Комбінований урок засвоєння нових знань, умінь і навичок, їх творчого застосування на практиці.
Обладнання: моделі кристалічних граток, гірські породи, картки із питаннями.
Для лабораторного досліду: склянка з водою, скляна паличка, спиртівка, тримач для пробірок, зразки речовин із різними типами кристалічних граток ( графіт, парафін, кухонна сіль ).
Міжпредметні зв’язки: хімія, географія, фізика.
Девіз уроку: « Все пізнають у порівнянні. Від аналізу – до структури, а від неї – до властивостей і застосування ».
Хід уроку
І. Організаційний момент.
Підготовка учнів до уроку, організація уваги, налаштування.
ІІ. Актуалізація опорних знань і вмінь учнів.
Усне опитування учнів
Вправа « Хімічний ланцюжок »
Учні впродовж 1-2 хв. готують запитання, які записують на аркуш, кидають у капелюх в якому вже є кілька питань від учителя, теж записані на аркуш паперу. Потім вони відповідають на них, передаючи капелюх по ланцюжку, доки вчитель не зупинить. Учні відповідають на запитання, які тримають у руках.
ІІІ. Мотивація навчальної та пізнавальної діяльності учнів.
Учитель: На кожному уроці ми прагнемо досягти успіху. Сьогоднішній урок не виняток. Тож для початку оберніться один до одного, посміхніться один одному й побажайте успіху один одному. До речі, успіх важливий у житті людини ? Ви хотіли б бути успішними людьми ? А що потрібно, щоб досяхти успіху в житті ?
На дошці – схема ( учитель пише на дошці, а діти називають ).

Учитель: Ось ми і вивели своєрідну формулу успіху. А де це можна здобути і як ? Так правильно – у школі, навчаючись. Отже, кожен день, проведений у школі, кожен, вивчений вами урок наближає вас до великого успіху. І сьогоднішній урок хімії – це ще один крок до нього.
( Звернення до девіза уроку)
Поясніть вислів: « Все пізнають у порівнянні. Від аналізу – до структури, а від неї – до властивостей і застосування ».
ІІІ. Вивчення н ової теми.
Учитель: Вам відомо, що існують різні типи зв’язку. Чи впливає тип хім. зв’язку на будову речовини та її властивості ? Саме цю проблему ми з вами повинні розв’язати на уроці.
- Скажіть, у якому агрегатному стані можуть бути речовини ?
- Які типи хімічних зв’язків вам уже відомі ?
Вам уже відомо, що твердих речовин найбільше. За певних умов будь-яка речовина може стати твердою.
Відомо, що у твердих речовинах частинки, що їх утворюють, розташовані у просторі суворо закономірно для кожної речовини.
Кожна тверда речовина має свою кристалічну гратку.
( Робота з підручником ). Прочитаємо що таке кристалічна гратка.
Кристалічна гратка – це розміщення у просторі йонів, атомув або молекул у систематичному порядку.
Учитель: Одже, які частини можуть перебувати у вузлах кристалічних граток ?
Учні: Атоми, молекули, йони.
Учитель: Залежно від природи частинок, що містяться у вузлах граток, розрізняють йонні, атомні, молекулярні а ще й металічні кристалічні гратки.
Демонстрації : 4. « Кристалічні гратки різних типів ».
5. « Речовини атомної, молекулярної та йонної будови ».
Учитель: Кілька уроків тому я вас розділила на групи і дала підготувати проект на тему « Кристалічні гратки ». Кожна група отримала завдання описати один певний вид гратки. У своїх проектах ви обов’язково мали дати відповіді на 4 запитання:
- Які частинки містяться у вузлах кристалічної гратки ?
- Які сили між ними діють ?
- Які властивості виявляють речовини ?
- Наведіть приклади речовин.
Одже, надаємо слово першій групі.
Група 1 « Йонна кристалічна гратка »
Типовим представником сполук з йонним типом кристалічних ґраток є натрій хлорид NaCl. Його кристалічні ґратки утворені йонами Натрію Na+ та йонами Хлору Сl-, які почергово розміщуються у вузлах ґраток. Иони утримуються один з одним силами притягання, і кристал солі є ніби єдиним цілим.
Оскільки в кристалі сили притягання поширюються однаково в усіх напрямках, йони Натрію і Хлору сполучаються дуже міцно, хоча кожний із них не зафіксований нерухомо. Иони безперервно здійснюють теплові коливання навколо свого положення в ґратках. Міцність йонних кристалів залежить також і від заряду та радіуса йонів. Однак їх поступальний рух уздовж ґраток не відбувається, тому всі речовини з йонним зв'язком за стандартної температури — тверді (кристалічні), з досить високою температурою плавлення і ще вищою — кипіння.
Молекул у йонних кристалах немає, є тільки йони. Лише у газуватому стані (пара) натрій хлорид існує у вигляді молекул NaCl.
Подібно до натрій хлориду майже всі солі, основні оксиди, гідроксиди складаються не з молекул, а з йонів.
Зверни увагу, хімічні формули йонних сполук передають лише співвідношення позитивно і негативно заряджених йонів у кристалічних ґратках. Йонні сполуки в цілому електронейтральні. Наприклад, згідно з формулою йонного кристала CaF2 співвідношення позитивно заряджених йонів Са2+ і негативно заряджених йонів F- у ґратках дорівнює 1:2. Оскільки кожні два позитивні заряди Са2+ нейтралізуються двома негативними зарядами 2F-, то речовина CaF2 — електронейтральна.
Хоча реальних молекул у йонних кристалах не існує, для однаковості з ковалентними речовинами прийнято за допомогою формул NaCl, CaF2тощо передавати найпростіший склад йонної речовини та характеризувати її також певним значенням відносної молекулярної (формульної) маси на підставі її формульного складу. А поняття про валентність як певне число ковалентних зв'язків до йонних сполук застосувати неможливо (тому й будемо говорити про ступінь окиснення елементів).
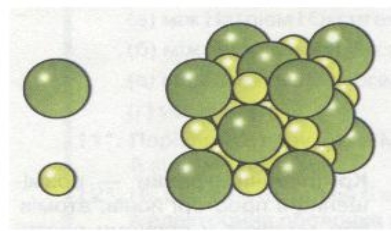
Група 2 « Атомна кристалічна гратка »
У вузлах атомних кристалічних ґраток містяться окремі атоми, сполучені між собою ковалентними зв'язками. Такі кристалічні ґратки має алмаз. У його кристалі кожний атом Карбону сполучений ковалентними зв'язками з чотирма сусідніми атомами Карбону, тобто утворює чотири спільні електронні пари. Ось чому можна говорити, що Карбон — чотиривалентний елемент.
Ступінь окиснення Карбону також -4 або +4, залежно від того, з яким елементом він взаємодіє — СН4, СО2.
Алмаз та інші речовини, які мають атомні кристалічні ґратки, характеризуються великою твердістю, дуже високими температурами плавлення і кипіння, вони практично не розчиняються в жодних розчинниках, не проводять електричний струм, оскільки вільних електронів немає, всі 4 валентні електрони беруть участь в утворенні ковалентних зв'язків. Атомні ґратки мають лише деякі речовини у твердому стані (силіцій Si, бор В, силіцій(IV) оксид SiO2, силіцій(ІV) карбід SiC та ін.).
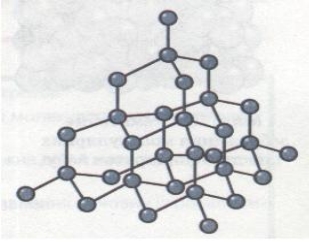
Група 3 «Молекулярна кристалічна гратка »
У вузлах молекулярних кристалічних ґраток містяться молекули як неполярні, так і полярні. Наприклад, у вузлах кристалічних ґраток йоду містяться молекули йоду І2. Сили міжмолекулярної взаємодії, так звані сили Ван-дер-Ваальса, значно слабкіші за сили ковалентного зв'язку. Тому речовини з молекулярними ґратками мають невелику твердість, вони легкоплавкі і леткі. До таких речовин належать, наприклад, йод, нафтален, бром, вода, спирт, хлор, амоніак NH3, метан СН4.
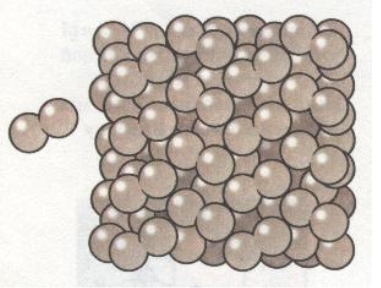
Отже, будова речовини та її властивості пов'язані. Тому якщо відома будова речовини, можна прогнозувати її властивості, і навпаки, якщо відомі властивості речовини, можна робити висновки про її будову.
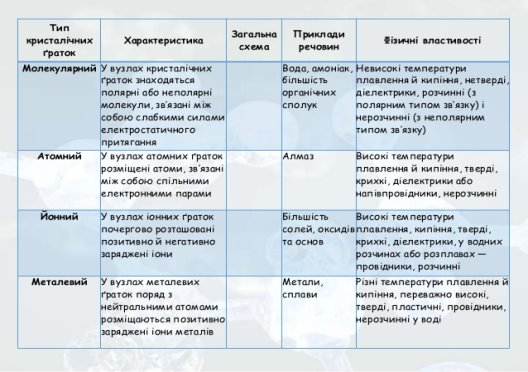
Учитель: Ми заслухали 3 проекти. Об’єднуємо всю цю інформацію в одну таблицю. І перенесемо її у робочий зошит.
Зв'язок будови і властивостей речовин показаний в узагальнюючій табл.
Учитель: Є такий афоризм: « Практика без теорії сліпа, теорія без практики мертва ».
Тож давайте перевіримо теорію практикою. Пригадаймо в тих же групах. Кожна група отримує 1 речовину. Визначте за її властивостями тип кристалічної гратки. Результат оформіть у зошиті і прозвітуйте класові.
І група. Кухонна сіль ( NaCl )
II група. Цукор (C12H22O11 )
ІІІ група. Графіт ( С )
Інструкція до лабораторного досліду
Тема : Ознайомлення з фізичними властивостями речовин атомної, молекулярної та йонної будови .
Мета: Дослідити властивості речовин із різними кристалічними гратками.
Обладнення: Штатив з пробірками, склянка з водою, спиртівка, тримач, зразки речовин ( кухонна сіль – NaCl, цукор – C12H22O11, графіт – С )
Хід уроку
- Поділіть видану вам речовину на 2 пробірки.
- У першу пробірку долийте води. Спостерігайте, чи розчинилася речовина у воді.
- Другу пробірку затисніть тримачем і нагрійте на полум’ї спиртівки, спостерігайте, чи розплавалися речовина.
- На основі спостереженнь зробіть висновок про будову речовини. Назвіть типи кристалічних граток.
Учитель: Ми вдало об’єднали теорію з практикою. Пропоную визначити причинно – наслідкові зв’язки між будовою та властивостями речовин. Перед вами картки з певними термінами. Розташуйте їх у такій послідовності, щоби можна було простежити причинно – наслідковий зв’язок. ( Див. схему )
( Робота учнів з карточками ).

Учитель: Перед вами колекції мінералів і гірських порід запозичених у кабінеті географії. Серед них є і кухонна сіль і графіт. А цукор – це речовина, яку виробляють із цукрового буряка, що виробляють на полях України. Потужні поклади кухонної солі у кам’яному вигляді залягають у Донбасі, Дніпропетровсько – Донецькій западині й Закарпатті, а у вигляді природних підземних росолів – у Перекарпатті, в ропі солоних водойм Азово – Чорноморського узбережжя та Криму. Багатоцільове призначення має і графіт. Його родовища пов’язані з Українським щитом, найбільше з них – Завалівське
( Кропивницька область ).
Основними районами вирощування цукрового буряка є лісостеп ( понад 85% виробництва цукрових буряків ), а також прилеглих до нього райони зони Степу і Полісся. Та з виробництвом цукру в Україні ми ознайомимося в 9 класі більш детально.
ІV. Закріплення й узагальнення матеріалу на уроці.
Учитель: Я ставлю запитання й кидаю одному з вас кубик. Учень, який отримав кубик, дає відповідь. Якщо він не готовий дати відповідь, то передає кубик іншому учневі.
Гра з кубиком
1) Азот переходить у твердий стан за низької температури ( - 210 °C ) який тип гратки має азот ? ( молекулярна )
2) Яка з речовин характеризується більшою твердістю – лід чи пісок ? Як ви це можете пояснити ? ( лід має молекулярну, а пісок – атомну гратку )
3) 1673 року Ньютон сказав: « Чи не можна припустити, що під час утворення твердої речовини ( кристала ) частинки вишикувались в ряди, застигаючи в правельних фігурах ? » Щоб ви йому відповіли ?
4) Елементи С і Si утворюють схожі за складом оксиди CO2 і SiO2 але СО2 плавиться за – 78.5 °C, а SiO2 – за +1700°C Як ви це можете пояснити ?
( Різні кристалічні гратки )
5) Білий фосфор плавиться за +44°C яку кристалічну гратку має білий фосфор ?
( Молекулярну )
6) Червоний фосфор плавиться за + 600°C Яку кристалічну гратку має червоний фосфор ?
( Атомну )
V. Підсумок уроку. Оцінювання.
Учитель: - На початку уроку ви пробували пояснити вислів, який я обрала за девіз до уроку у вас винекли труднощі. Спробуйте, ще рас його пояснити уже після вивченого матеріалу.
( Учні пояснюють своє міркування ).
- Чи досягнули ви того успіху, який прагнули пізнати на початку уроку ?
( Так )
- Одже, ми досягнули того, чого хотіли. І урок у нас вдався.
Аналіз роботи на уроці. Оцінювання.
VІ. Домашнє завдання.
- Опрацювати матеріал підручника ( параграф 47 частина 2.
Ярошенко О. Г. Хімія ).
- Завдання ст. 197 « Сторінка природодослідника ». ( Дослід з вирощування кристалів ).


про публікацію авторської розробки
Додати розробку
