8кл Хімічні властивості лугів: дія на індикатори, взаємодія з кислотами, кислотними оксидами, солями. Заходи безпеки під час роботи з лугами.
8 клас
Тема уроку : Хімічні властивості лугів: дія на індикатори, взаємодія з кислотами, кислотними оксидами, солями. Заходи безпеки під час роботи з лугами.
Опрацювання матеріалу уроку надає можливість:
1. вивчити хімічні властивості лугів
2. навчитись розрізняти реакції заміщення, обміну, нейтралізації;
3. складати хімічні формули лугів та рівняння реакцій, які характеризують хімічні властивості лугів, відпрацювати навички запису хімічних рівнянь
4. навчитись безпечному користуванню лугами.
Ключові поняття і терміни: основи, луги , індикатори (лакмус, метиловий оранжевий, фенолфталеїн, універсальний індикатор); реакція нейтралізації, реакція обміну
Пригадайте :
- Який клас неорганічних сполук називається основами?
- На які дві групи поділяються основи?
- 3 допомогою таблиці розчинності наведіть приклади розчинних і нерозчинних основ.
- Назвіть вибрані основи за сучасною українською номенклатурою.
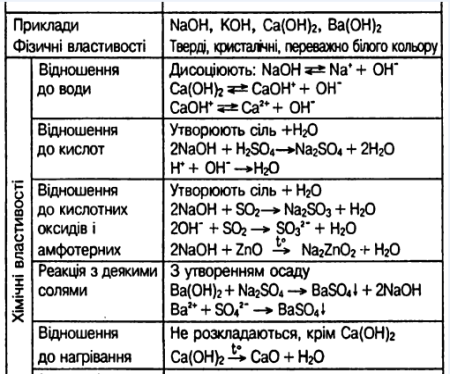
Хімічні властивості лугів :
|
1. Подивись навчальне відео (луги) https://www.youtube.com/watch?v=WA50pOui2eU або навчальну презентацію за темою уроку : https://www.youtube.com/watch?v=aD8SQIRN_u8 |
|
Теоретичний блок : луги
|
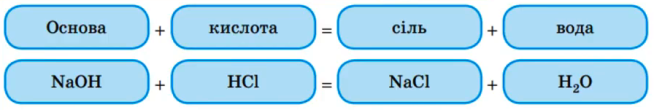
Хімічні властивості основ визначаються їх відношенням до кислот, амфотерних оксидів і солей. Найбільш характерною властивістю основ є їх здатність вступати в хімічні реакції з кислотами. Реакції взаємодії основ з кислотами називають реакціями нейтралізації. |
|
Суть реакцій нейтралізації полягає в тому, що кислотний водень кислоти і гідроксид основи утворюють воду, а катіони металу основи і кислотні залишки утворюють сіль:
|
Заходи безпеки під час роботи з лугами: |
|
|
Луги – їдки речовини які здатні роз’їдати шкіру, слизову оболонку очей. Під час роботи з лугами та їх розчинами треба дотримуватися правил безпеки, зокрема: - тверді луги (гранули) тримати в закритій посудині ; - не брати речовини руками, не розбризкувати ; - поводитися дуже акуратно: стежити, щоб луг не потрапляв на одяг, зошити й книжки , то що; |
Знак «Їдкі речовини»
|
Вивчення хімічних властивостей будь-якого класу речовин дає змогу зрозуміти їх природу, місце серед інших речовин, процеси взаємоперетворення.
Хімічні властивості основ ви побачите наочно ( експериментально) і оформите результати відповідних лабораторних дослідів в опорному конспекті
|
2. Перегляньте відео Демонстраційний дослід №12. Хімічні властивості лугів за посиланням або за QR кодом https://www.youtube.com/watch?v=4mT_n0-7PP8 |
|
Складаємо опорний конспект за результатами спостережень :
1. Вплив розчинів лугів на забарвлення індикаторів :
|
Індикатор |
Універсальний індикатор (папірець) |
Лакмус |
Метилоранж |
Фенолфталеїн |
|
Колір індикатора |
|
|
|
|
Висновок :
- Розчин лугу має __________________ середовище.
- Розчин лугу можливо виявити за допомогою таких індикаторів : _________.
2. Лабораторний дослід № 2 Взаємодія лугів з кислотами в розчині.
|
Переглянути відео за посиланням https://www.youtube.com/watch?v=iyUvBZq-XEg та оформити запис згідно вимог : Мета : ____________________________________ Обладнання та реактиви : ____________________ |
або за QR кодом
|
Хід роботи :
Дослід №1. Взаємодія натрій гідрооксиду з хлоридною і сульфатною кислотами. NaOН + HCl = NaOН + H2S O4 =
Дослід №2. Взаємодія калій гідрооксиду з хлоридною і сульфатною кислотами.
KOH + HCl = KOH + H2SO4 =
Висновки. Дайте відповідь на питання : - Чому розчин знебарвився?
- Які реакції називають реакціями нейтралізації?
- У чому полягає сутність реакції нейтралізації .
3. Реакція лугів з кислотними оксидами :
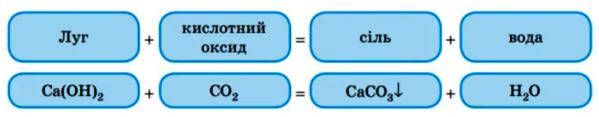
Допишіть рівняння реакції : (підказка : утворюється сіль тієї кислоти , що відповідає даному кислотному оксиду ):
KOH + SO3 = Ca(OH)2 + Р2О5 = NaOН + СO2 = Ba(OH)2 + SO2 =
4. Взаємодія лугів з солями :
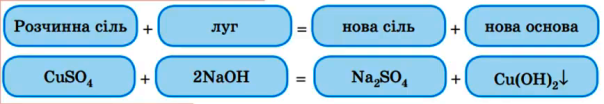
допишіть рівняння реакцій за зразком : реакція обміну відбувається в розчині
6NaOН + Fe 2(SO4)3 = 3Na2SO4 + 2Fe(OH)3
основа + сіль = нова сіль + нова основа ( нерозчинна)
Увага ! Реакція між сіллю і лугом можлива лише за умови , що утворюється осад нерозчинної основи
KOH + CuСО2 = NaOН+ MgSO4 = Ba(OH)2 + AlCl3 =
Тренувальні вправи
Завдання 1. Напишіть можливі рівняння взаємодії натрій гідроксиду з речовинами за схемою.
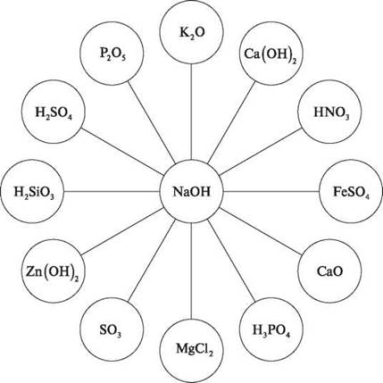
Завдання 2. Здійснити перетворення: BaO→ Ba(OH)2→ BaCO3→ H2CO3→ CO2
Задача 1. Під час пропускання карбон (І V) оксиду крізь розчин кальцій гідроксиду добули сіль масою 80г. Визначте об’єм карбон (І V) оксиду (н. у.), який був пропущений крізь розчин.
Задача 2. Сульфатна кислота масою 16 г прореагувала з натрій гідроксидом. Обчисліть масу утвореної солі.
Домашнє завдання:
- прочитати § 29 ( стор 153-156) ,
- вивчити властивості лугів,
- надіслати фото конспекту і виконаних завдань..
-
Чудовий матеріал для дистанційного уроку!


про публікацію авторської розробки
Додати розробку