8кл. Хімічні властивості нерозчинних основ .
8 клас
Тема уроку : Хімічні властивості нерозчинних основ: взаємодія з кислотами
і розкладання внаслідок нагрівання.
Опрацювання матеріалу уроку надає можливість:
1. вивчити хімічні властивості нерозчинних основ
2. записувати рівняння реакцій, які характеризують хімічні властивості нерозчинних основ.
Ключові поняття і терміни: основи, реакція розкладу, реакція обміну
Пригадайте :
- Що таке Основи? Як вони класифікуються ?
- Яку інформацію ми отримуємо з Таблиці розчинності ?
- Які хімічні властивості у лугів? (https://www.youtube.com/watch?v=WA50pOui2eU )
- Яких правил необхідно дотримуватися в хімічній лабораторії.
Сьогодні розглянемо хімічні властивості нерозчинних основ :
|
Переглянь навчальне відео за темою уроку https://www.youtube.com/watch?v=BgDZ18FGc0E
Хімічні властивості нерозчинних основ : |
|
1. Взаємодія нерозчинних основ з кислотами ( пам’ятаємо , що продуктами реакції є сіль і вода):
Завдання . Допишіть рівняння реакції , назвіть продукти
Cu(OH)2 + НСl= Fe (OH)2 + H3PO4 = Al(OH)3 +HCl =
До якого типу належить реакція між основами та кислотами ?_______________
Сполуки якого класу утворюються ? ____________________________________
2. Розкладання нерозчинних основ при нагріванні :
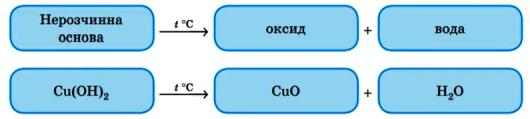
утворюється основний оксид і вода. 2Fe(OH)3 → Fe2O3 + 3H2O;
|
Демонстрація №13. Добування і хімічні властивості нерозчинних основ. https://www.youtube.com/watch?v=u_qSy7jwLms&feature=youtu.be |
|
Висновок : Нерозчинні основи при нагріванні розкладаються на ____ і_______ .
Завдання : Напишіть реакцію розкладу купрум (ІІ) гідрооксиду .
Тренувальні вправи
Завдання 2. Запишіть пропущені в рівняннях формули нерозчинних основ, розташуйте коефіцієнти:
а) H2SO3 + .... = MnSO3 + Н2О. б) ....+ HCl = CuCl2 + Н2О
в) …………. = FeO + Н2О г) ….. = Cr2O3 + Н2О.
Завдання 3.
Укажіть гідроксиди , яким відповідає оксид загальної формули Ме2О3
а) KOH; б) Cr(OH)3; в) Fe (OH)3; г) Cu(OH)2; д) NaOH.
Задача. Яку кількість речовини ферум (ІІІ) оксиду можна добути в результаті термічного розкладу відповідної основи масою 4, 28 г?
Завдання 2. Здійсніть перетворення: Сu(ОН)2 → СuO → СuSO4→ Сu(OH)2.
Домашнє завдання:
- прочитати § 29 ( стор. 155-159) ,
- вивчити властивості нерозчинних основ,
- надіслати фото конспекту з виконаними вправами .

про публікацію авторської розробки
Додати розробку


