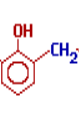
"Альдегіди:склад і будова молекули,фізичні та хімічні властивості."

Це представники карбонільних сполук.
* Карбонільні сполуки (оксосполуки) – це похідні ВВ, що містять в молекулі карбонільну групу >С = О
Оксосполуки
![]()
![]()
Альдегіди Кетони
![]()
![]()
![]()
![]() R – C – H R – C – R
R – C – H R – C – R
О О
![]() О
О
![]() Група - С - альдегідна група
Група - С - альдегідна група
![]() Н
Н
* Альдегіди – це органічні сполуки, молекули яких містять альдегідну групу, зв’язану з вуглеводневим радикалом.
В залежності від характеру радикала, зв’язаного з альдегідною групою, альдегіди розділяються на:
|
Загальна формула |
Клас альдегідів |
Приклади |
|
Н (n ≥ 0) |
Насичені |
Н |
|
CnH2n-1 – C
|
Ненасичені |
СН2 = СН – С пропеналь
|
|
(n ≥ 2) H |
Ненасичені |
СН ≡ С – С пропіналь
|
|
|
Ароматичні
|
|
![]() О
О
![]() Насичені альдегіди CnH2n+1 - C
Насичені альдегіди CnH2n+1 - C
![]() Н , де n ≥ 0
Н , де n ≥ 0
__________________________________________________
Гомологічний ряд
Назва
n Формула альдегіда за міжнародною тривіальна
![]() О
О
![]()
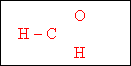
![]() 0. Н – С метаналь мурашиний(формальдегід)
0. Н – С метаналь мурашиний(формальдегід)
Н
![]() О
О
![]() 1. СН3 – С етаналь оцтовий(ацетальдегід)
1. СН3 – С етаналь оцтовий(ацетальдегід)
![]() Н
Н
![]() О
О
![]() 2. С2Н5 – С пропаналь пропіоновий
2. С2Н5 – С пропаналь пропіоновий
![]() Н
Н
![]()
![]() О
О
![]() 3. СН3 – (СН2)2 – С бутаналь масляний альдегід
3. СН3 – (СН2)2 – С бутаналь масляний альдегід
Н
![]()
![]() О
О
![]() 4. СН3(СН2)3 – С пентаналь валеріановий
4. СН3(СН2)3 – С пентаналь валеріановий
Н
![]()
![]() О
О
![]() 5. СН3 – (СН2)4 – С гексаналь капроновий альдегід
5. СН3 – (СН2)4 – С гексаналь капроновий альдегід
Н
------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Номенклатура і ізомерія
Назва альдегіда за міжнародною номенклатурою утворюється від назви відповідного алкана з таким же числом атомів «С» з добавкою закінчення -аль. Нумерацію карбонового ланцюга починають від атома С альдегідної групи!
Назва альдегіда за Назва
міжнародною = + Закінчення - аль
номенклатурою алкана
![]()
![]() 6 5 4 3 2 1 О
6 5 4 3 2 1 О
![]()
![]() СН3 – СН2 – СН2 – СН – СН2 – С
СН3 – СН2 – СН2 – СН – СН2 – С
СН3 Н
3метил гексаналь
В межах класу – можливий лише один вид ізомерії – ізомерія ланцюга.
![]()
![]() Альдегіди ізомерні С3Н6О
Альдегіди ізомерні С3Н6О
![]() кетаноли: О
кетаноли: О
![]() СН3 – СН2 – С СН3 – С – СН3
СН3 – СН2 – С СН3 – С – СН3
![]()
![]()
![]() Н
Н
пропаналь О пропанон
(диметилкетон, ацетон)
![]()
![]()
![]() R σ+ σ-
R σ+ σ-
![]() Електронна будова молекули 1200 С = П σ О
Електронна будова молекули 1200 С = П σ О
Н
Атом С карбонільної групи Ѕр2 гібридизований, тому атоми з’єднані з ним ("О", "Н", "С") знаходяться в одній площині.
Фізичні властивості
![]()
![]()
![]()
![]()
![]()
![]() О О О О
О О О О
![]()
![]() Н – С , СН3 – С … С11Н23 – С , С12Н25 – С …
Н – С , СН3 – С … С11Н23 – С , С12Н25 – С …
![]()
![]()
![]()
![]() Н Н Н Н
Н Н Н Н
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Газ рідини тверді речовини
_____________________________________________________________________________________________→
t0 кипіння збільшується
Нижчі альдегіди мають різкий запах, вищі альдегіди, що містять 8-12 атомів «С», - духмяні речовини. Альдегіди з 1-3 атоми «С» гарно розчиняються у воді.
Розчинність різко зменшується із збільшенням "С". Всі альдегіди розчиняються в органічних розчинниках.
Альдегіди подразнюють слизові оболонки очей, верхніх дихальних шляхів, шкідливо впливають на нервову систему.
Хімічні властивості
Альдегіди – один з найбільш реакційноздатних класів органічних сполук, що пов’язано з наявністю в їх молекулах високополяризованої карбонільної групи
>С = О
Для альдегідів характерні реакції: приєднання, окислення, полімеризації і поліконденсації.
І. Реакції приєднання
![]() σ-
σ-
![]()
![]()
![]()
![]() σ+ О σ- О – Н
σ+ О σ- О – Н
![]()
![]() R – С + - х R – С - Н
R – С + - х R – С - Н
![]()
![]()
![]() Н х
Н х
- Гідрування (відновлення) з утворенням первинних спиртів
![]()
![]() О Ni(Pt)
О Ni(Pt)
![]()
![]() Н – С + Н – Н СН3ОН
Н – С + Н – Н СН3ОН
![]()
![]() Н
Н
![]() Метаналь метанол
Метаналь метанол
ІІ. Реакції окислення
Альдегіди легко окиснюються до карбонових кислот з тим же числом атомів «С» різними окисниками (сильні окисники: О2 – повітря; підкислений розчин KMnO4, або K2CrO7; слабкі окисники: аміачний розчин оксиду срібла (І), лужний розчин сульфату міді (ІІ) та інші).
![]() σ-
σ-
![]()
![]()
![]()
![]() σ+ О О
σ+ О О
![]()
![]()
![]() R–C + [O] R - C
R–C + [O] R - C
![]() Н ОН
Н ОН
Реакції з аміачним розчином оксиду срібла (І) і лужним розчином сульфату міді (І) являються якісними реакціями на альдегіди.
- Взаємодія з аміачним розчином оксиду срібла (І) – «реакція срібного дзеркала».
![]()
![]()
![]()
![]()
![]() О t0, NH4OH O
О t0, NH4OH O
![]()
![]() CH3C + Ag2O CH3 – C + 2Ag
CH3C + Ag2O CH3 – C + 2Ag
![]()
![]() H OH
H OH
Етаналь етанова кислота
Металічне срібло осідає на стінках пробірки у вигляді тонкого шару, утворюючи дзеркальну поверхню.
- Взаємодія з гідроксидом міді (ІІ)
Для реакції використовують свіжеприготовлений Cu(OH)2:
![]() CuSO4 + 2 NaOH = Cu(OH)2 + Na2SO4
CuSO4 + 2 NaOH = Cu(OH)2 + Na2SO4
![]()
![]()
![]()
![]() O +2 t0 O +1
O +2 t0 O +1
![]()
![]()
![]()
![]() CH3 – C + 2Cu(OH)2 CH3 – C + Cu2O + 2H2O
CH3 – C + 2Cu(OH)2 CH3 – C + Cu2O + 2H2O
![]() H OH цегляний
H OH цегляний
Етаналь осад
ІІІ. Реакції полімеризації (характерні для
нижчих альдегідів)
- Лінійна полімеризація.
При довготривалому стоянні або випаровуванні розчину формальдегіду відбувається утворення полімеру з n = 8*100 – параформальдегіда
![]() Н Н2О
Н Н2О
![]() n C = O [CH2O] n
n C = O [CH2O] n
![]() Н (параформ)
Н (параформ)
- Циклічна полімерізація [ тримеризація, тетрамеризація ]
![]()
![]()
![]()
![]() О СН2
О СН2
![]()
![]()
![]()
![]() 3Н – С Н+, t О О
3Н – С Н+, t О О
Н
![]()
![]() Н2С СН2
Н2С СН2
О тріоксан (тріоксіметилен)
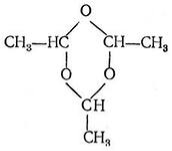
Оцтовий альдегід утворює циклічний тример і тетрамер.
|
Н |
|
Паральдегід або тример етаналя
ІV. Реакції поліконденсації
- Реакції поліконденсації – це процеси утворення високомолекулярних речовин, в ході яких з'єднання вихідних мономерних молекул супроводжується виділенням таких низькомолекулярних продуктів, як Н2О, HCl, NH3 та інших.
В кислому або лужному середовищі формальдегід утворює з фенолом високомолекулярні продукти – фенол формальдегідні смоли різної будови.
Спочатку утворюється фенол спирт:
|
|
Н + |
Н |
|
|
ОН |
О – гідроксіметилфенол
При нагріванні фенол спирти конденсуються з утворенням фенол формальдегідних полімерів.
|
|
|
|
|
|
|
|
+nH2O
n |
Фенолформальдегідні смоли використовують для добування пластичних мас (феноплатов).
Способи добування
І.Загальні методи добування
1) Окиснення первинних спиртів:
а) каталітичне
![]()
![]() Cu O
Cu O
![]()
![]() 2CH3OH + O2 2H – C + 2H2O
2CH3OH + O2 2H – C + 2H2O
t0 H
б) під дією окисників (K2Cr2O7 або KMnO4 в кислому середовищі)
![]()
![]() t0 О
t0 О
![]()
![]() СН3СН2ОН + [ О] СН3 – С + Н2О
СН3СН2ОН + [ О] СН3 – С + Н2О
Із окисника Н
2)Каталітичне дегідрування первинних спиртів:
![]()
![]() Cu, 3000С О
Cu, 3000С О
![]()
![]() С2Н5ОН СН3 – С + Н2
С2Н5ОН СН3 – С + Н2
Н
ІІ. Специфічні способи добування
Формальдегід добувають при каталітичному окисненні метану:
![]()
![]() кат. t0 O
кат. t0 O
![]() СН4 + О2 Н – С + Н2О
СН4 + О2 Н – С + Н2О
![]() Н
Н
Ацетальдегід добувають реакцією Кучерова
![]()
![]() Hg2+ O
Hg2+ O
![]()
![]() HC ≡ CH + HOH CH3 – C ,
HC ≡ CH + HOH CH3 – C ,
Н
або при каталітичному окисненні етилену:
![]()
![]() PolCl2 + CuCl2 O (цей спосіб широко
PolCl2 + CuCl2 O (цей спосіб широко
![]()
![]() 2СН2 = СН2 + О2 2СН3 – С використовують
2СН2 = СН2 + О2 2СН3 – С використовують
Н в промисловості)
Аналогічно добувають і інші альдегіди при окисненні гомологів етилену, наприклад:
![]()
![]() PolCl2 + CuCl2 O
PolCl2 + CuCl2 O
![]()
![]() 2CН3 – СН = СН2 + О2 2СН3 – СН2 – С
2CН3 – СН = СН2 + О2 2СН3 – СН2 – С
пропаналь Н
Застосування найважливіших альдегідів
|
Антисептики |
|
40% розчин (формалін) для зберігання анатомічних препаратів
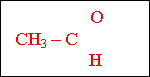
Лікарські препарати |

![]()
![]()
![]()
![]()
![]()
|
|
|
|


про публікацію авторської розробки
Додати розробку