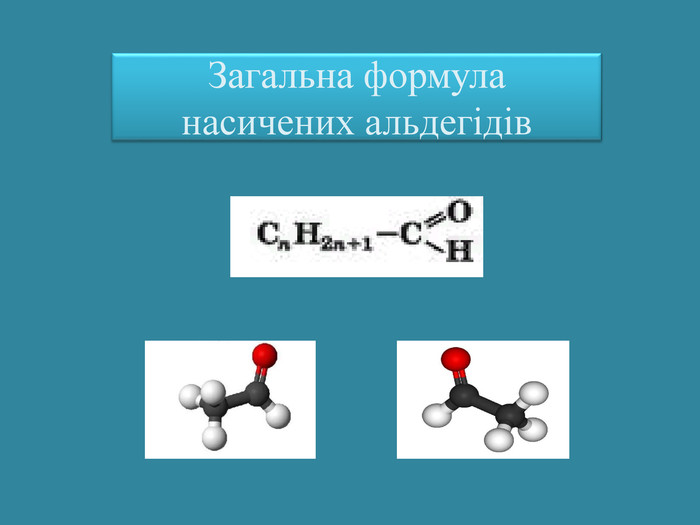
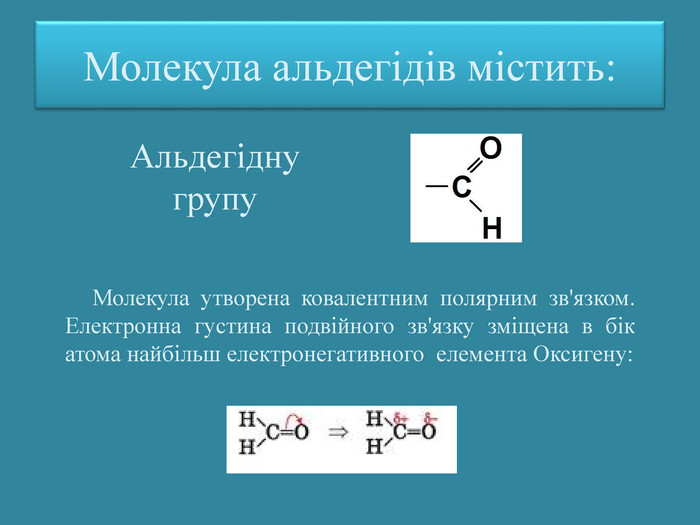
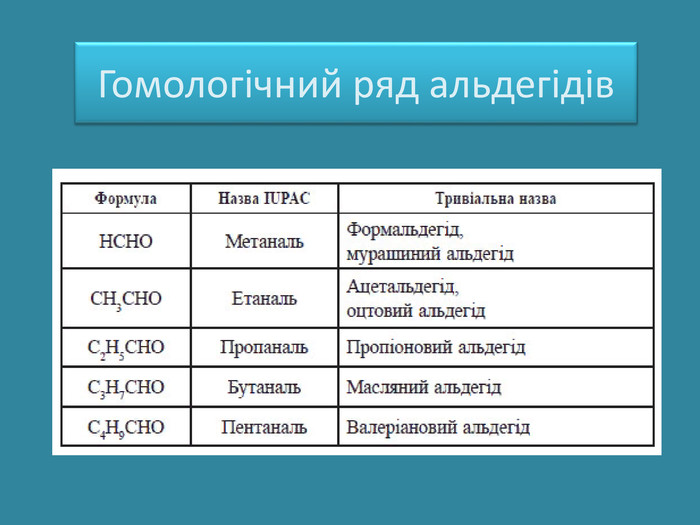
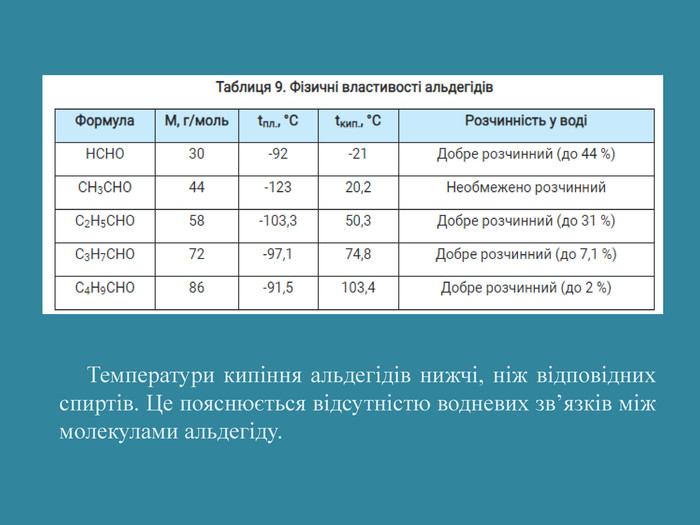
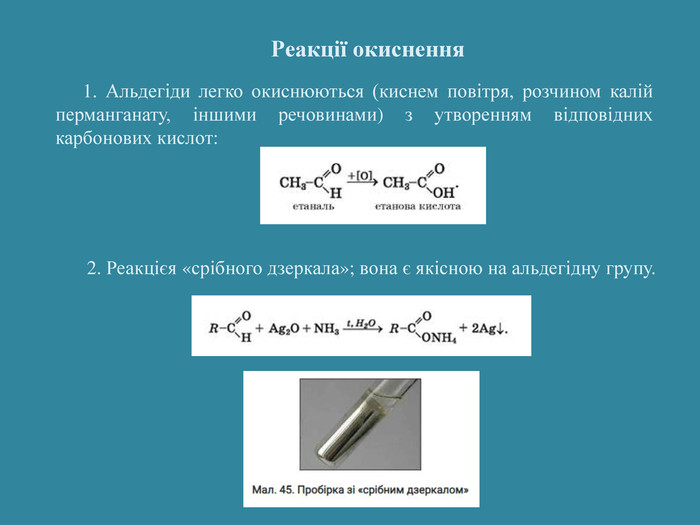
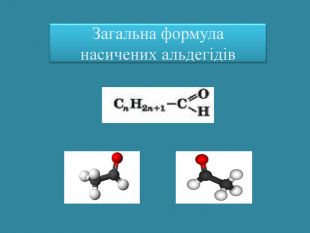
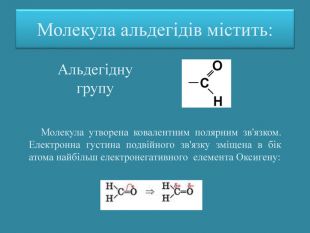
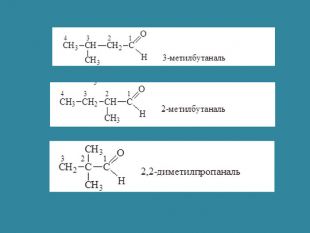
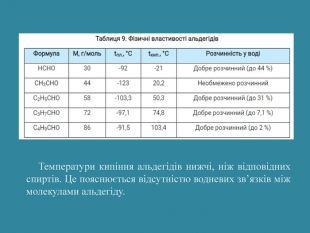
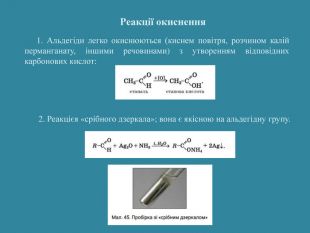
Презентація: "Альдегіди. Склад та будова молекул. Ізомерія альдегідів. Властивості, добування та застосування"
Про матеріал
Презентація уроку з хімії в 10 класі по темі: "Альдегіди. Склад та будова молекул. Ізомерія альдегідів. Властивості, добування та застосування"
Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку