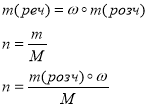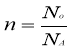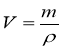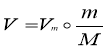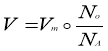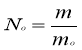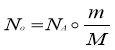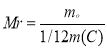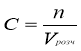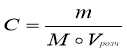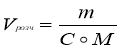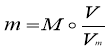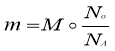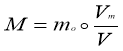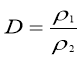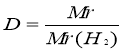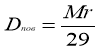Алгоритми та методичні рекомендації по розв’язуванню розрахункових задач з хімії
Посібник містить алгоритми розв'язування основних типів розрахункових задач із хімії, алгоритми виконання вправ, рекомендації, поради, роз'яснення термінів і понять. Крім того, у посібнику вміщено довідникові таблиці та матеріали. Призначений для учнів загальноосвітніх навчальних закладів, учителів хімії та студентів педагогічних вищих навчальних закладів.
|
Алгоритми та методичні рекомендації по розв’язуванню розрахункових задач з хімії
(для учнів загальноосвітніх навчальних закладів)
|
Відділ освіти Кегичівської районної державної адміністрації
Кегичівський ліцей
Кегичівської районної ради
Харківської області

Кегичівка
2013
Рекомендовано методичною радою управління освіти
Кегичівського району
Протокол № _______ від __________ р.
Рецензенти: Яцко І.М., заступник директора з навчально-виховної роботи
Автор-упорядник:
Пухова Ірина Миколаївна, учитель хімії Кегичівського ліцею, учитель вищої категорії, старший вчитель.
Алгоритми та методичні рекомендації по розв’язуванню розрахункових задач з хімії (для учнів загальноосвітніх навчальних закладів). – Кегичівка, 2013. – 40 с.
Зміст анотації
Посібник містить алгоритми розв’язування основних типів розрахункових задач із хімії, алгоритми виконання вправ, рекомендації, поради, роз’яснення термінів і понять. Крім того, у посібнику вміщено довідникові таблиці та матеріали. Призначений для учнів загальноосвітніх навчальних закладів, учителів хімії та студентів педагогічних вищих навчальних закладів.
Від дітей нерідко можна почути, що хімія – складний предмет, який вивчити та зрозуміти дуже важко. Дехто навіть вважає, що ці знання не потрібні. Крім того, в суспільстві існує певна думка, що хімія завдає багато шкоди: забруднення навколишнього середовища різними хімічними виробництвами, негативний вплив добутих речовин на здоров'я людини. Більше того, сучасні навчальні програми та підручники бажають бути кращими.
Кожен педагог має свою методичну скарбничку, матеріал якої використовується на уроках і сприяє ефективності навчання. Однак, незалежно від типу й форми уроку, робота вчителя повинна бути спрямована на стимулювання самостійної діяльності учнів по оволодінню методиками розв’язування розрахункових задач, виконанню основних хімічних завдань, а також уміння використовувати наявні теоретичні й практичні знання в нових умовах. Допомогти у вирішенні цих задач може цей методичний посібник.
Він містить алгоритми розв’язування основних типів розрахункових задач із хімії, алгоритми виконання вправ, рекомендації, поради, роз’яснення термінів і понять. Крім того, у посібнику вміщено довідникові таблиці та матеріали. Сподіваюсь, що цей посібник стане вам у нагоді під час вивчення курсу хімії, при складанні випускних та вступних іспитів, а також на кожному уроці.
Усі матеріали, наведені у посібнику, перевірено автором на практиці.
Бажаю успіхів!
Автор
Зміст
Відносна молекулярна маса………………………………….5
Валентність …………………………………………………...6
Масова частка елемента………………………………….......7
Кількість речовини…………………………………………...9
Молярний об’єм …………………………………………….11
Число структурних частинок ……………………………....12
Об'ємні відношення ………………………………………...13
Відносна густина газів ……………………………… ..…...15
Задачі за термохімічними рівняннями …………………… 16
Масова частка розчиненої речовини ……………………. .18
Молярна концентрація ……………………………………..19
Ступінь окиснення ……………………………………….....21
Окисно-відновні реакції …………………………………....21
Розрахунки за рівняннями хімічних реакцій …………….. 23
Реакції йонного обміну ……………………………………..24
Задачі на надлишок і нестачу….. .………………………… 25
Задачі на домішки …………………………………………..27
Задачі на практичний вихід ……………………………….. 28
Задачі на виведення формули органічної речовини ……...30
Додатки ……………………………………………………...32
Відносна молекулярна маса
Трохи теорії…
Атомна маса – це маса атома, яку виражено в а.о.м. Відносна атомна маса позначається Аr і є безрозмірною величиною.
Молекулярна маса – це маса молекули, яку виражено в а.о.м.
Відносна молекулярна маса – показує, у скільки разів маса молекули даної речовини більша від 1/12 маси атома Карбону 12С. Відносна молекулярна маса позначається Мr і є безрозмірною величиною. Відносна молекулярна маса обчислюється як сума відносних атомних мас атомів, з яких складається молекула. Відносні атомні маси елементів наведені в Періодичній системі хімічних елементів під символами хімічних елементів. Як правило, для розрахунків їх округляють до цілих чисел (Увага! Відносну атомну масу Хлору округляють до десятих і це число становить 35,5).
Алгоритм обчислення відносних молекулярних мас (Мr)
|
Послідовність дій |
Приклади виконаних дій
|
|
1) Прочитайте текст задачі |
Обчисліть відносну молекулярну масу нітроген (V) оксиду. |
|
2) Запишіть скорочено умову задачі |
Дано: N2О5 Знайти: Мr (N2О5) - ?
|
|
3) Запишіть хімічну формулу речовини |
N2О5
|
|
4) Користуючись Періодичною системою випишіть відносні атомні маси елементів, що входять до складу речовини
|
Аr (N) = 14 Аr (О) = 16
|
|
5) Складіть формулу розрахунку відносної молекулярної маси, розглядаючи Мr як суму добутків Аr елементів на число атомів кожного з них |
Мr (N2О5) = 2·Аr (N) + 5·Аr (О) |
|
6) Розрахуйте Мr речовини за складеною формулою |
Мr (N2О5) = 2 ·14 + 5 ·16 = 108 |
|
7) Запишіть відповідь |
Відповідь: Мr (N2О5) = 108 |
Валентність
Трохи теорії…
Валентність – це здатність атома приєднувати або заміщувати певне число інших атомів із утворенням хімічного зв’язку.
Кількісною мірою валентності атома елемента (Е) є число атомів Гідрогену (одновалентний) або атомів Оксигену (двовалентний), які елемент приєднує з утворенням гідриду ЕНх або оксиду ЕmОn. Валентність позначають римськими цифрами над елементом (наприклад: І, ІІ, ІІІ та ін.)..
Алгоритм визначення валентності в бінарних сполуках
|
Порядок дій |
Приклад виконання дій |
|
1) Вказати валентність елемента з відомою валентністю |
ІІ ІІ І Fe2О3 СО2 СН4 |
|
2) Помножити число атомів на його валентність |
3·ІІ = 6 2·ІІ = 4 4·І = 4 |
|
3) Поділити отримане значення на число атомів іншого елемента |
6:2 = ІІІ 4:1 = ІV 4:1 = ІV |
|
4) Записати значення валентності над символом цього елемента |
ІІІ ІІ ІV ІІ ІV І Fe2 О3 С О2 С Н4
|
Алгоритм складання формул бінарних сполук
|
Порядок дій |
Приклад виконання дій |
|
1) Записати символи елементів у необхідному порядку та надписати їхню валентність |
ІІІ ІІ VІ І ІV ІІ Аl О S F С S |
|
2) Знайти найменше спільне кратне (НСК) для значень валентностей цих елементів |
НСК(ІІІ і ІІ) = 6 НСК(VІ і І) = 6 НСК(ІV і ІІ) = 4 |
|
3) Число атомів даного елемента дорівнює відношенню НСК до валентності цього елемента |
6:ІІІ = 2(Аl) 6:ІІ = 3(О) 6:VІ = 1(S) 6:І = 6(F) 4:ІV = 1(С) 4:ІІ = 2(S) |
|
4) Записати індекси після символів елементів |
ІІІ ІІ VІ І ІV ІІ Аl2 О3 S F6 С S2 |
Масова частка елемента у складній речовині
Трохи теорії…
Масова частка елемента ω(Е) показує, яку частину складає маса даного елемента від усієї маси речовини:
![]() ,
,
де n – число атомів, яке показує індекс біля знака хімічного елемента у формулі;
Ar – відносна атомна маса елемента;
Mr – відносна молекулярна маса речовини.
Масову частку виражають у частках від одиниці або у відсотках.
Сума усіх значень масових часток елементів у речовині повинна складати 100% (якщо масові частки виражені у відсотках), або 1 (якщо вони виражені у частках від одиниці).
Алгоритм обчислення масової частки елемента
у складній речовині
|
Порядок дій
|
Приклади виконаних дій |
|
1) Прочитайте текст задачі |
Обчисліть масові частки елементів у складі сульфур (VІ) оксиду. |
|
2) Запишіть скорочено умову задачі |
Дано: SO3 Знайти: ω (S) - ? ω (О) - ? |
|
3) Обчисліть відносну молекулярну масу сполуки |
Мr (SO3) = Аr (S) + 3·Аr (О) = 32 + + 3·16 = 80 |
|
4) Обчисліть масову частку елементів за формулою:
ω =
|
ω (S) =
ω (О) = Увага! Сума масових часток усіх елементів у сполуці дорівнює 100%. Тому останній елемент можна знайти як різницю: ω (О) = 100% - - 40% = 60% |
|
5) Запишіть відповідь |
Відповідь: ω (S) = 40%; ω (О) = 60% |
Знаходження формул речовин за даними про масові частки елементів
|
Порядок дій
|
Приклади виконаних дій |
|
1) Прочитайте текст задачі |
Мінерал пірит є рудою, з якої отримують залізо. Він містить 47% Феруму і 53% Сульфуру. Відносна молярна маса піриту 120. Визначте формулу піриту. |
|
2) Запишіть скорочено умову задачі |
Дано: ω(Fe) = 47% ω(S) = 53% Мr = 120 Знайти: Feх Sу |
|
3) За масовою часткою й відносною молекулярною масою визначте кількість атомів |
звідси |
|
4) Визначте число атомів Феруму |
|
|
5) Визначте число атомів Сульфуру |
|
|
6) Запишіть відповідь |
Відповідь: FeS2 |
Кількість речовини
Трохи теорії…
Кількість речовини означає певне число структурних частинок речовини (молекул, атомів, іонів). Позначається n (ен) або ν (ню). Вимірюється в молях.
1 моль – кількість речовини, що містить стільки ж частинок, скільки міститься атомів в 12г Карбону.
Моль – одна з основних одиниць системи СІ.
Молярна маса – це маса 1 моль речовини. Молярну масу позначають М і традиційно виражають у г/моль, або кг/моль.
Молярна маса – чисельно дорівнює відносній молекулярній масі.
Молярна маса – це відношення маси речовини до відповідної кількості речовини:
![]() ,
,
де m – маса речовини; n – кількість речовини.
Відповідно, із цієї формули кількість речовини визначають як відношення маси речовини до її молярної маси:
![]()
Алгоритм обчислення маси речовини
за відомою кількістю речовини
|
Послідовність дій |
Приклади виконаних дій
|
|
1) Прочитайте текст задачі |
Обчисліть масу води кількістю речовини 1,5 моль. |
|
2) Запишіть скорочено умову задачі |
Дано: n(Н2О) = 1,5 моль Знайти: m(Н2О) - ? |
|
3) Напишіть формулу зв’язку між кількістю речовини, молярною масою і масою речовини: n = |
n (Н2О) = |
|
4) Виведіть математичний вираз для маси |
m(Н2О) = n(Н2О) · M(Н2О) |
|
5) Обчисліть за формулою масу, враховуючи, що М = =Мr |
М(Н2О) = 1·2 + 16 = 18 г/моль m(Н2О) = 1,5 моль · 18 г/моль = = 27 г |
|
6) Запишіть відповідь |
Відповідь: m(Н2О) = 27 г |
Молярний об’єм газу
Трохи теорії…
Молярний об’єм газу – це об’єм 1 моль газу. Ця величина залежить від температури й тиску. Її традиційно виражають у л/моль, або м3/моль.
За нормальних умов (н.у. - 0°С, 101,3 кПа) молярний об’єм ідеального газу становить 22,4 л/моль (число Авогадро). Цю константу позначають Vm і називають молярним об’ємом газу.
Молярний об’єм газу – це відношення об’єму газу до відповідної кількості речовини:
![]() ,
,
де V – об’єм газу; n – кількість речовини газу.
З цієї формули можна вивести формулу для визначення кількості речовини: ![]()
Алгоритм обчислення об’єму газу
за відомою кількістю речовини
|
Послідовність дій |
Приклади виконаних дій
|
|
1) Прочитайте текст задачі |
Обчисліть об’єм кисню кількістю речовини 3 моль. |
|
2) Запишіть скорочено умову задачі |
Дано: n(О2) = 3 моль Знайти: V(О2) - ? |
|
3) Напишіть формулу зв’язку між кількістю речовини, молярним об’ємом і об’ємом газу:
n = |
n(О2) = |
|
4) Знайдіть математичний вираз для об’єму |
V(O2) = n(O2) · Vm |
|
5) Обчисліть за формулою об’єм, враховуючи, що Vm для всіх газів за н.у. складає 22,4 л/моль |
V(O2) = 3 моль · 22,4 л/моль = = 67,2 л |
|
6) Запишіть відповідь |
Відповідь: V(O2) = 67,2 л |
Число структурних частинок
Трохи теорії…
Стала Авогадро (NА) – кількість частинок в 1 моль будь-якої речовини. Це число стала величина і дорівнює 6,02·1023. Стала Авогадро має розмірність моль-1.
Число структурних частинок речовини – це добуток сталої Авогадро на кількість речовини:
![]()
Кількість речовини визначається як відношення числа структурних частинок до сталої Авогадро: ![]()
Алгоритм обчислення числа структурних частинок речовини за відомою масою
|
Послідовність дій
|
Приклади виконаних дій
|
|
1) Прочитайте текст задачі |
Скільки молекул міститься в 6,4г сірки? |
|
2) Запишіть скорочено умову задачі
|
Дано: m(S) = 6,4г Знайти: N0(S) - ? |
|
3) Напишіть формулу зв’язку між кількістю речовини, числом структурних частинок та сталою Авогадро та формулу зв’язку між кількістю речовини, масою та молярною масою. |
|
|
4) Прирівняйте ліву та праву частини формул та виведіть число структурних частинок із знайденого співвідношення. |
|
|
5) Обчисліть за формулою число структурних частинок, пам’ятаючи, що стала Авогадро становить 6,02·1023моль-1. |
N(молекул) = = |
|
6) Запишіть відповідь |
Відповідь: N(молекул) = 1,2·1023.
|
Об'ємні відношення газів
Трохи теорії…
Закон об'ємних відношень (Ж. Гей-Люссак, 1802)
Об’єми газоподібних речовин, що вступають у реакцію, відносяться між собою та до об’ємів газоподібних продуктів реакції як невеликі цілі числа.
Приклад:
Реакція горіння пропану: С3Н8 + 5О2 = 3СО2 + 4Н2О(газ)
V(С3Н8): V(О2): V(СО2): V(Н2О)=1:5:3:4.
Алгоритм обчислення об´ємних відношень газів
за рівнянням хімічної реакції
|
Послідовність дій |
Приклади виконаних дій
|
|
1) Прочитайте текст задачі |
Обчисліть об’єм (н.у.) кисню, необхідний для реакції з карбон (ІІ) оксидом об’ємом 20 л. |
|
2) Запишіть скорочено умову задачі |
Дано: V(СО2) = 20л Знайти: V(О2) - ? |
|
3) Складіть рівняння реакції |
2СО + О2 = 2СО2
|
|
4) Підкресліть формули речовин, про які йдеться в умові задачі |
2СО + О2 = 2СО2
|
|
5) Надпишіть над підкресленими формулами числові значення відомого об’єму, під формулами – числові значення об’ємів, які випливають з даного рівняння реакції та відповідають коефіцієнтам |
20л хл 2СО + О2 = 2СО2 2 1 |
|
6) Складіть відношення та обчисліть об’єм газу в літрах |
|
|
6) Запишіть відповідь |
Відповідь: V(О2) = 10л |
Відносна густина газів
Трохи теорії…
Густина газу А за газом В дорівнює відношенню молярної маси газу А до молярної маси газу В. Її позначають DВ(А). ця величина дорівнює відношенню виміряних в однакових умовах густин газів:
DВ(А)=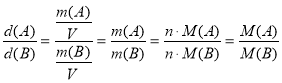
Як правило, густини різних газів визначають відносно:
водню – М(Н2) = 2 г/моль,
кисню – М(О2) = 32 г/моль,
повітря – М(пов.) = 29 г/моль.
Алгоритм обчислення відносної густини газу
|
Послідовність дій |
Приклади виконаних дій
|
|
1) Прочитайте текст задачі |
Обчисліть відносну густину сульфур (ІV) оксиду за воднем. |
|
2) Запишіть скорочено умову задачі |
Дано: SO2 Знайти: DН2 - ? |
|
3) Запишіть розрахункову формулу відносної густини за воднем
|
DН2 = М (Н2) = 2 г/моль
DН2 = |
|
4) Обчисліть відносну молекулярну масу сульфур (ІV) оксиду за хімічною формулою |
Мr(SO2) = 32 + 16·2 = 64 М (SO2) = 64 г/моль
|
|
5) Підставте у формулу (дія 3) значення М і отримайте відповідь |
DН2 = |
|
6) Запишіть відповідь |
Відповідь: DН2 = 32 |
Задачі за термохімічними рівняннями
Трохи теорії…
Тепловий ефект реакції – це теплота, яка виділяється або поглинається при протіканні хімічної реакції.
Тепловий ефект реакції Q від'ємний, якщо теплота поглинається, і додатній, якщо теплота виділяється.
Термохімічне рівняння – це хімічне рівняння, у якому вказано тепловий ефект реакції.
Енергетика хімічних реакцій
![]()
![]()
![]() Реакції
Реакції


екзотермічні ендотермічні (теплота виділяється) (теплота поглинається)
2Н2 + О2= 2Н2О + Q 2КМnО4 = К2МnО4 + МnО2 +О2↑-Q
Алгоритм обчислення кількості теплоти
за термохімічним рівнянням реакції
|
Послідовність дій |
Приклади виконаних дій
|
|
1) Прочитайте текст задачі |
Обчисліть кількість теплоти, що виділиться внаслідок спалювання фосфору масою 6,2 г. Термохімічне рівняння реакції горіння фосфору: 4Р + 5О2 = 2Р2О5 + 3010 кДж |
|
2) Запишіть скорочено умову задачі |
Дано: m(Р) = 6,2 г Q1 = 3010 кДж Знайти: Q2 - ? |
|
3) Запишіть термохімічне рівняння |
4Р + 5О2 = 2Р2О5 + 3010 кДж
|
|
4) Підкресліть формулу речовини з відомими вихідними даними і числове значення теплового ефекту |
4Р + 5О2 = 2Р2О5 + 3010 кДж |
|
5) Над підкресленою формулою речовини вкажіть вихідні дані, під формулою – числові дані, закономірні для цього рівняння, над числовим значенням теплового ефекту – умовне позначення Q |
6,2 г Q 4Р + 5О2 = 2Р2О5 +3010 кДж n = 4 моль М = 31 г/моль m = 124 г |
|
6) Обчисліть шукану кількість теплоти в кДж |
Х =
|
|
7) Запишіть відповідь |
Відповідь: Q2 = 150,5 кДж |
Масова частка розчиненої речовини у розчині
Трохи теорії…
Масова частка розчиненої речовини – це безрозмірна величина, що дорівнює відношенню маси розчиненої речовини до загальної маси розчину:
![]()
де ![]() масова частка розчиненої речовини; m – маси речовини або розчину.
масова частка розчиненої речовини; m – маси речовини або розчину.
m(розчину) = m(речовини) + m(води),
тобто масову частку можна виразити як
![]() .
.
Масову частку розчиненої речовини ω звичайно виражають у частках від одиниці або у відсотках. Наприклад, масова частка розчиненої речовини – СаСl2 у розчині дорівнює 0,06, або 6%. Це означає, що в розчині Кальцій хлориду масою 100 г міститься хлорид кальцію масою 6 г і вода масою 94 г.
Алгоритм обчислення маси розчиненої речовини,
якщо відома масова частка розчиненої речовини й маса розчину
|
Послідовність дій |
Приклади виконаних дій
|
|
1) Прочитайте текст задачі |
Обчисліть масу натрій хлориду, необхідну для приготування розчину масою 200 г з масовою часткою солі 0,05. |
|
2) Запишіть скорочено умову задачі |
Дано: m(розч.) = 200 г ω(NaCl) = 0,05 Знайти: m(NaCl) - ? |
|
3) Запишіть формулу для обчислення маси розчиненої речовини, виходячи із формули: ω(NaCl) = |
m(NaCl) = ω(NaCl) · m(розч.) |
|
4) Підставте в отриманий вираз чисельні дані з умови задачі та здійсніть розрахунки |
m(NaCl) = 0,05 · 200 = 10(г) |
|
7) Запишіть відповідь |
Відповідь: m(NaCl) = 10г |
Молярна концентрація
Трохи теорії…
Молярна концентрація – відношення кількості розчиненої речовини до об’єму розчину.
![]()
[C] = моль/л
Алгоритм обчислення молярної концентрації розчину
|
Послідовність дій |
Приклади виконаних дій
|
|
1) Прочитайте текст задачі |
Обчисліть молярну концентрацію розчину сульфатної кислоти масою 225г (ρ = 1,5 г/мл) з масовою часткою кислоти 52%. |
|
2) Запишіть скорочено умову задачі |
Дано: m(розч.) = 225 г ω(NaCl) = 0,05 ρ(розч) = 1,5 г/мл Знайти: СМ - ? |
|
3) Запишіть формулу для обчислення об’єму розчину за густиною |
|
|
4) Підставте в отриманий вираз чисельні дані з умови задачі та здійсніть розрахунки |
|
|
5) Запишіть формули для обчислення маси речовини та кількості речовини |
|
|
6) Підставте в отриманий вираз чисельні дані з умови задачі та здійсніть розрахунки |
|
|
7) Запишіть формулу для визначення молярної концентрації розчину |
|
|
8) Підставте в отриманий вираз чисельні дані з пунктів 4 та 6 |
|
|
9) Запишіть відповідь |
Відповідь: СМ= 8моль/л |
Ступінь окиснення
Трохи теорії…
Ступінь окиснення елемента у сполуці – це умовний заряд його атомів, обчислений у припущенні, що всі зв'язки у сполуці мають йонний характер.
Принцип електронейтральності: алгебраїчна сума ступенів окиснення всіх атомів у молекулі дорівнює нулю.
Елементи зі сталим ступенем окиснення у сполуках
|
Ступінь окиснення |
Елементи |
|
0 |
Усі прості речовини – метали й неметали |
|
-1 |
F |
|
+1 |
Li, Na, K, Rb, Cs |
|
+2 |
Be, Mg, Ca, Sr, Ba, Ra, Zn |
|
+3 |
Al |
Гідроген виявляє у сполуках ступінь окиснення +1, рідко -1( у сполуках з металами).
Оксиген виявляє у сполуках ступінь окиснення -2, рідко -1 (у пероксидах) та +2 у сполуці з Флором (F2О).
Окисно-відновні реакції
Трохи теорії…
Реакції, у процесі яких змінюються ступені окиснення елементів, що входять до складу реагуючих речовин, називаються окисно-відновними.
Перебіг окисно-відновних реакцій і, отже, зміна ступеня окиснення атомів, зумовлені переходом електронів від одних атомів до інших.
![]()
![]()
![]()
![]() пр-с відновлення
пр-с відновлення
![]()
![]()
![]()
![]()
![]()
![]() пр-с окиснення
пр-с окиснення
![]()
|
Окиснення – процес віддавання електронів.
|
Відновлення – процес приймання електронів.
|
|
Атоми, йони або молекули, що віддають електрони, називають відновниками. Найсильніші відновники: Н2, СО, Н2S, NН3, С (вуглець), метали. |
Атоми, йони або молекули, що приймають електрони, називають окисниками. Найсильніші окисники: О2, О3, галогени, НNО3, Н2SО4, КМnО4. |
Схема взаємозв’язку зміни ступенів окиснення з процесами окиснення та відновлення
|
Відновлення – ступінь окиснення зменшується (+ е ) |
||||||||||||
|
|
-3 |
-2 |
-1 |
0 |
+1 |
+2 |
+3 |
+4 |
+5 |
+6 |
+7 |
+8 |
|
|
||||||||||||
Число електронів, які віддає відновник, завжди дорівнює числу електронів, які приєднує окисник, тобто дотримується електронний баланс.
Розрахунки за рівняннями хімічних реакцій
Трохи теорії…
Пам'ятка: розв’язування розрахункових задач за рівнянням реакції
- Складаємо рівняння хімічної реакції.
- Над формулами речовин записуємо значення відомих і невідомих речовин з відповідними одиницями вимірювання (тільки для чистих речовин).
- Під формулами відомих і невідомих речовин записуємо відповідні значення величин, знайдені за рівнянням реакції.
- Складаємо та розв’язуємо пропорцію.
- Записуємо відповідь.
Алгоритм обчислення маси продукту реакції
за відомою кількістю речовини
|
Послідовність дій |
Приклади виконаних дій
|
|
1) Прочитайте текст задачі |
Обчисліть масу води, яка утворюється при взаємодії алюміній оксиду кількістю речовини 0,5 моль із сульфатною кислотою. |
|
2) Запишіть скорочено умову задачі |
Дано: n(Аl2О3) = 0,5 моль Знайти: m(Н2О) - ? |
|
3) Складіть рівняння реакції |
Аl2О3 + 3Н2SО4=Аl2 (SО4)3 +3Н2О
|
|
4) Підкресліть формули речовин, про які йдеться в умові задачі |
Аl2О3 +3Н2SО4 =Аl2 (SО4)3 +3Н2О
|
|
5) Надпишіть над підкресленими формулами вихідні дані, під формулами – дані, що закономірно витікають з рівняння реакції |
0,5 моль x моль Аl2О3 + 3Н2SО4=Аl2 (SО4)3 +3Н2О 1 моль 3 моль |
|
6) Обчисліть кількість речовин |
|
|
7) Обчисліть М шуканої речовини |
М(Н2О) = 1·2 + 16 = 18 г/моль
|
|
8) Використовуючи формулу розрахунку кількості речовини m = М·n |
m(Н2О) = М(Н2О) · n(Н2О) = = 18 г/моль · 1,5 моль = 27 г |
|
9) Запишіть відповідь |
Відповідь: m(Н2О) = 27 г |
Реакції йонного обміну
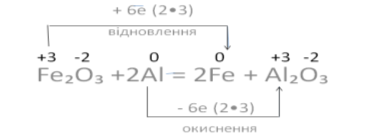
Трохи теорії…
Реакції між йонами, що відбуваються в розчинах називають реакціями йонного обміну, а рівняння таких реакцій – йонними рівняннями.
Алгоритм складання йонних рівнянь
- Скласти молекулярне рівняння реакції та урівняти його:
CuSO4 + 2 NaOH = Cu(OH)2 + Na2SO4
- Визначити, користуючись таблицею розчинності, яка з речовин залишає область реакції (є осадом, газом або слабким електролітом): CuSO4 + 2 NaOH = Cu(OH)2↓ + Na2SO4
- Користуючись таблицею розчинності записуємо дисоціацію усіх речовин з урахуванням математичних знаків хімічного рівняння, крім осаду (газу або слабкого електроліту). Таку форму запису називають повним йонним рівняння: Cu2++ SO42- + 2 Nа++2OH- = Cu(OH)2↓ + 2Na++ SO42-
- Підкреслюємо однакові йони лівої та правої частин: Cu2++ SO42- + 2 Nа++2OH- = Cu(OH)2↓ + 2Na++ SO42-
- Записуємо скорочене йонне рівняння без підкреслених йонів: Cu2++ 2OH- = Cu(OH)2↓
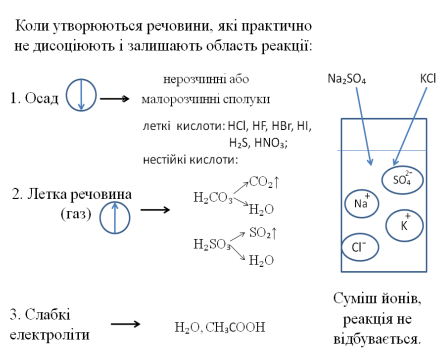
Умови перебігу реакцій йонного обміну до кінця
Задачі на надлишок і нестачу
Трохи теорії…
Реагенти вступають у реакцію в чітко визначених масових співвідношеннях. Досить часто в практичній роботі зустрічаються ситуації, коли один з реагентів залишається в надлишку або, навпаки одного з реагентів не вистачає для одержання визначеної кількості продукту реакції. При розв’язуванні задач цього типу слід пам’ятати, що із двох вихідних речовин розрахунок проводиться лише за тією речовиною, яка знаходиться в нестачі. Тобто ця речовина під час реакції витрачається повністю. Визначити, яка з речовин перебуває в нестачі, можна склавши відношення маси або об’єму вихідної речовини, що дано за умовою задачі, до відповідної маси або об’єму, визначеного за рівнянням реакції.
Алгоритм обчислення за рівнянням хімічної реакції,
якщо одна з вихідних речовин узята в надлишку
|
Порядок дій |
Приклади виконаних дій
|
|
1) Прочитайте текст задачі |
Обчисліть масу осаду, який утвориться внаслідок взаємодії розчинів, які містять купрум (ІІ) сульфат масою 8г та натрій гідроксид масою 10г. |
|
2) Запишіть скорочено умову задачі |
Дано: m(CuSO4) = 8г m(NaOH) = 10г Знайти: m(Cu(OH)2) - ? |
|
3) Запишіть рівняння реакції |
CuSO4+2 NaOH = Cu(OH)2 + Na2SO4
|
|
4) Підкресліть формули речовин, про які йдеться в умові задачі |
CuSO4 + 2 NaOH = Cu(OH)2 + Na2SO4
|
|
5) Надпишіть над підкресленими формулами вихідні дані, під формулами – дані, що закономірно витікають з рівняння реакції |
8г 10г хг CuSO4 + 2 NaOH = Cu(OH)2↓+ Na2SO4 n=1моль n=2моль n=1моль M=160г/моль M=40г/моль M=98г/моль m = 160 г m = 80 г m = 98 г
|
|
6) Знайдіть, яка із двох даних речовин взята в нестачі |
В нестачі CuSO4, тому розрахунок проводимо саме за цією речовиною. |
|
7) Розрахунок здійснюємо за речовиною, яка повністю використовується, тобто за тією, яка в нестачі |
|
|
8) Запишіть відповідь |
Відповідь: m(Cu(OH)2) = 4,9 г
|
Задачі на домішки
Трохи теорії…
У природі чистих речовин не буває. Кожна з природних речовин є сумішшю кількох різних речовин. Речовини, крім основної, які в даному випадку не є цінними та не використовуються на виробництві, називають домішками. Участь в хімічній реакції приймає лише чиста речовина, домішки участі в реакції не приймають, тому їх масу слід віднімати від загальної маси речовини.
Для технічних речовин (речовини з домішками) можна виразити масову частку домішок, або масову частку чистої речовини у частках від одиниці, або у відсотках.
![]() або
або ![]()
Алгоритм обчислення маси продукту реакції
за відомою масою вихідної речовини, яка містить домішки
|
Послідовність дій |
Приклади виконаних дій
|
|
1) Прочитайте текст задачі |
Яку масу кальцій оксиду можна отримати з вапняку масою 400 кг з масовою часткою домішок 0,2? |
|
2) Запишіть скорочено умову задачі |
Дано: m(вапняку) = 400 кг ω(домішок) = 0,2 Знайти: m(CaO) - ? |
|
3) Обчисліть масу речовини за формулами |
ω(чист.реч) = 1 - ω(домішок) ω(СаСО3) = 1 – 0,2 = 0,8 m(ч.реч)= ω(чист.реч) · m(вапняку) m(СаСО3) = 0,8 · 400 = 320 (кг) |
|
4) Складіть рівняння реакції |
СаСО3 → CaO + CO2
|
|
5) Підкресліть формули речовин, про які йдеться в умові задачі
|
СаСО3 → CaO + CO2
|
|
6) Надпишіть над підкресленими формулами вихідні дані задачі, під формулами – дані, які закономірні для рівняння реакції |
320 кг х кг СаСО3 → CaO + CO2 n = 1 моль n = 1 моль М = 100 кг/моль М = 56 кг/моль m = 100 кг m = 56 кг
|
|
7) Складіть пропорцію та обчисліть масу продукту реакції |
|
|
8) Запишіть відповідь |
Відповідь: m(CaO) = 179,2 кг |
Задачі на практичний вихід
Трохи теорії…
Практично при проведенні будь-якого хімічного процесу відбувається втрата деякої кількості реагуючих речовин. Тому для одержання бажаної маси (чи об’єму)продукту реакції необхідно враховувати виробничі втрати, тобто розраховувати практичний вихід реакції і, навпаки, за практичним виходом розраховувати маси (об’єми, кількість речовини) реагентів. Маси (об’єми) продуктів реакції, розраховані за рівнянням реакції, називаються теоретичним виходом. Теоретичний вихід приймають за 100%, тому що одержати продуктів реакції більше, ніж ця розрахункова величина неможливо. Маси (об’єми) продуктів реакції, обчислені з урахуванням втрат, називаються практичним виходом. Практичний вихід завжди менший за теоретичний. Вихід продукту розраховують за формулою:
![]() або
або ![]()
Алгоритм обчислення виходу продукту реакції
порівняно з теоретично можливим
|
Порядок дій
|
Приклади виконаних дій |
|
1) Прочитайте текст задачі |
Із негашеного вапна масою 112 г одержали гашене вапно масою 120 г. Обчисліть вихід продукту від теоретично можливого. |
|
2) Запишіть скорочено умову задачі |
Дано: m(СаО) = 112г mпрак(Са(ОН)2) = 120г Знайти: η - ? |
|
3) Запишіть рівняння реакції |
СаО + Н2О = Са(ОН)2 |
|
4) Підкресліть формули речовин, про які йдеться в умові задачі |
СаО + Н2О = Са(ОН)2 |
|
5) Укажіть над підкресленими формулами вихідні кількості речовин, під формулами – дані, закономірні для рівняння реакції. Увага! По рівнянню реакції знаходять масу теоретичну! |
112г х г СаО + Н2О = Са(ОН)2 n = 1 моль n = 1 моль М = 56 г/моль М = 74 г/моль m = 56 г m = 74 г |
|
6) Обчисліть теоретичну масу гашеного вапна |
|
|
7) Обчисліть вихід продукту від теоретично можливого за формулою:
η = |
η = |
|
8) Запишіть відповідь |
Відповідь: η(Са(ОН)2) = 81% |
Задачі на виведення формули органічної речовини
Алгоритм обчислення молекулярної формули речовини
за її відносною густиною і масою продуктів горіння
|
Послідовність дій |
Приклади виконаних дій
|
|
1) Прочитайте текст задачі |
Під час спалювання речовини масою 4,6 г утворився карбон (ІV) оксид масою 8,8 г і вода масою 5,4 г. Густина парів цієї речовини за повітрям становить 1,59. Виведіть молекулярну формулу речовини. |
|
2) Запишіть скорочено умову задачі |
Дано: m(реч) = 4,6г m(СО2) = 8,8г m(Н2О) = 5,4г Dпов = 1,59 Знайти: Формула - ? |
|
3) Обчисліть молярну масу речовини за формулою: Dх = |
Dпов = М(реч) = М(пов) · Dпов = 29 · 1,59 = = 46 г/моль
|
|
4) Знайдіть масу Карбону в невідомій речовині |
СО2 С М(СО2) = 44г/моль 44г містить 12г 8,8г -------- Хг
х = |
|
5) Знайдіть масу Гідрогену в невідомій речовині |
Н2О Н М(Н2О) = 18 г/моль
18г містить 2г х = 5,4г ------- Хг |
|
6) Визначте, чи входить до складу речовини Оксиген |
m(О) = m(реч) – m(С) – m(Н) m(О) = 4,6 – 2,4 – 0,6 = 1,6 (г)
|
|
7) Знайдіть індекси для Карбону, Гідрогену та Оксигену |
С : Н : О = =
|
|
8) Запишіть найпростішу та істинну формули |
Найпростіша формула: С2Н6О Перевіримо, чи є вона істинною. Для цього визначимо М знайденої речовини. М(С2Н6О) = 12·2 + 1·6 + 16 = 46 г/моль n = 46/46 = 1 (перевірка з числом у 1 дії) |
|
9) Запишіть відповідь |
Відповідь: С2Н6О
|
Додатки
- Валентності деяких хімічних елементів
|
Елементи зі сталою валентністю |
|
Одновалентні: Н, К, Na, Аg, F |
|
Двовалентні: О, Ва, Са, Мg, Zn |
|
Тривалентні: Аl, В |
|
Елементи зі змінною валентністю |
|
Fe – ІІ, ІІІ |
|
Сu – І, ІІ |
|
Аs, Р – ІІІ, V |
|
Рb, Sn, С – ІІ, ІV |
|
S – ІІ, ІV, VІ |
|
Сl, Вr, І – І, ІІІ, V, VІІ |
- Деякі позначення
+δ, -δ – заряд на атомі (в молекулі, сполуці); записують над символом елемента.
н.у. – нормальні умови: тиск 101,3 кПа, або 760 мм рт. ст., температура 0°С, або 273К.
е- - електрон.
р+ - протон.
n0 - нейтрон.
![]() t (у рівнянні реакції) – реакція відбувається при нагріванні.
t (у рівнянні реакції) – реакція відбувається при нагріванні.
![]() Р (у рівнянні реакції) – реакція відбувається за підвищеного тиску.
Р (у рівнянні реакції) – реакція відбувається за підвищеного тиску.
![]() k (у рівнянні реакції) – реакція відбувається за участі кіталізатора.
k (у рівнянні реакції) – реакція відбувається за участі кіталізатора.
↑ (у рівнянні реакції після формули речовини) – виділення газу (речовини в газуватому стані).
↓ (у рівнянні реакції після формули речовини) – утворення осаду речовини в розчині.
![]() Е – узагальнений символ елемента:
Е – узагальнений символ елемента:
a – порядковий номер (протонне число) елемента;
b – нуклонне число;
c – індекс (кількість атомів елемента);
d – заряд простого йона (спочатку записують значення, потім знак);
f – ступінь окиснення елемента (спочатку записують знак, потім значення.
Е* - атом елемента Е у збудженому стані.
- Характеристика частинок, що входять до складу атома
|
Назва частинки |
Позна-чення |
Маса |
Електричний заряд (в одиницях елементарного заряду) |
|
|
у грамах |
в а.о.м. |
|||
|
Протон |
р+ |
1,673·10-24 |
1,0073 |
+1 |
|
Нейтрон |
n0 |
1,675·10-24 |
1,0087 |
0 |
|
Електрон |
е- |
9,109·10-28 |
0,000549 |
-1 |
- Ряд енергетичних підрівнів атома
![]() 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 5d 6p…
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 5d 6p…
енергія електронів зростає
- Пам'ятка: правила розстановки коефіцієнтів в хімічних рівняннях
- Коефіцієнт показує число молекул або окремих атомів у рівняння реакції;
- Коефіцієнт ставиться тільки перед хімічною формулою;
- Коефіцієнт стосується всіх атомів, із яких складається молекула, перед якою він стоїть;
- Індекс показує число атомів елемента ( або груп атомів) у складі молекули;
- Коефіцієнт 1, як і індекс 1, не записується.
- Співвідношення деяких одиниць фізико-хімічних величин
|
Одиниця вимірювання |
Маса (m) |
Кількість речовини (n) |
Молярна маса (М) |
Об’єм (V) |
Молярний об’єм (Vm) |
Число частинок (N) |
|
Найчастіше використовується при вивченні хімії
|
г |
моль |
г/моль |
л |
л/моль |
6,02·1023(число Авогадро – NА) |
|
У 1000 разів більша
|
кг |
кмоль |
кг/кмоль |
м3 |
м3/кмоль |
6,02·1026 |
- Позначення та розмірність деяких фізичних величин
|
Позначення фізичної величини |
Фізична величина |
Розмірність |
|
Аr |
Відносна атомна маса |
а.о.м. |
|
Мr |
Відносна молекулярна маса |
а.о.м. |
|
W |
Масова частка |
% |
|
m |
Маса |
г, кг, т |
|
n або ν |
Кількість речовини |
моль |
|
V |
Об’єм |
мл, л, м3 |
|
Vm |
Молярний об’єм (число Авогадро) |
22,4 л/моль; м3/моль |
|
М |
Молярна маса |
г/моль, кг/моль |
|
N |
Число структурних частинок |
атоми, молекули, йони |
|
NА |
Стала Авогадро |
6,02·1023 моль-1 |
|
ρ |
Густина |
г/мл, г/см3, кг/м3 |
|
DН2 |
Відносна густина за воднем |
|
|
Dпов |
Відносна густина за повітрям |
|
|
С |
Молярна концентрація |
моль/л або М |
|
Р |
Тиск |
Па, кПа, атм |
|
Vх.р. |
Швидкість хімічної реакції |
|
|
T або t |
Температура |
°C або К |
|
∆Н |
Тепловий ефект реакції |
кДж/моль |
|
η або φ |
Вихід реакції |
% |
- Основні формули, що використовуються при розв’язуванні задач
|
Фізична величина
|
Формули |
|
Кількість речовини |
|
|
Об’єм |
|
|
Число структурних частинок |
|
|
Молярний об’єм |
|
|
Відносна молекулярна маса |
|
|
Молярна концентрація |
|
|
Маса |
|
|
Молярна маса |
|
|
Відносна густина |
|
|
Масова частка елемента |
|
|
Масова частка розчиненої речовини |
|
- Ряд активності металів
Li K Ba Sr Ca Na Mg Be Al Mn Cr Zn Fe Cd Ni Sn Pb (H2) Bi Cu Ag Hg Pt Au
![]() хімічна активність металів зростає
хімічна активність металів зростає
1
-
-
Автор розглянула основні типи задач курсу хімії 7-11 класів. Але кожий тип задач має пряму задачу та похідні з неї. Також немає хоч по декілька задач до кожного типу для тренування. Побажання автору - додати похідні задачі з кожного типу та до них хоч по 5 задач для засвоєння навичок їх розв'язання.


про публікацію авторської розробки
Додати розробку