Алкани. Загальна формула алканів, структурна ізомерія, систематична номенклатура
Розробка уроку для 10 класу , за новою програмою. Тема №2 Вуглеводні Урок 7 Алкани. Загальна формула алканів, структурна ізомерія, систематична номенклатура
Дата__________________10 клас
ТЕМА 2. ВУГЛЕВОДНІ
Урок №7
Тема: Алкани. Загальна формула алканів, структурна ізомерія, систематична номенклатура
Мета:
- формувати в учнів знання про алкани, гомологію, гомологічні ряди на прикладі алканів; з’ясувати причину різноманітності органічних речовин, суть поняття «ізомерія», ознайомити учнів із систематичною номенклатурою , навчитися давати назви речовинам відповідно до їхніх структурних формул;
- розвивати основні життєві компетентності – соціальну, комунікативну, інформаційну, креативну;
- виховувати творчу, допитливу особистість.
Тип уроку: засвоєння нових знань
Форми і методи роботи: розповідь, бесіда, демонстрація, робота в парах - прийом «Мозковий штурм», інтерактивні: вправа « Закінчи речення», кросворд «Ізомерія» вправа «Роблю висновок», частково-пошукові, словесні методи
Обладнання: моделі молекул вуглеводнів.
Хід уроку
І. Організаційний момент
День, прожитий без збагачення знаннями, - даремно прожитий день. Отже, ми продовжуємо з вами працювати над насиченими вуглеводнями, поглиблюючи та вдосконалюючи знання з цієї теми.
ІІ. Актуалізація опорних знань
Вправа « Закінчи речення»
- Органічні сполуки складаються з елементів: ….
- Карбон в органічних сполуках завжди має валентність….
- Атом Карбону в органічних сполуках знаходиться в …стані.
- Атоми Карбону в органічних сполуках зв’язані один з одним … зв’язком.
- Кристалічні гратки органічних сполук ….
- Органічні сполуки реагують між собою дуже….
- Емпіричні формули несуть інформацію про ….
- Структурні формули несуть інформацію про….
- Теорію хімічної будови органічних речовин створив вчений … в … році.
ІІІ. Мотивація навчальної діяльності
У 9 класі ми вивчили метан, який є першим представником класу насичених вуглеводнів (алканів). Але насичених вуглеводнів багато, і ми повинні знати ці речовини, тому, що людина використовує їх у своїй практичній діяльності. Для зручності вивчення вуглеводнів їх об’єднують у гомологічні ряди, які ви повинні знати. Існують правила складання формул органічних речовин та утворення їх назв, які повинні бути зрозумілими будь-якій людини, що володіє елементарними знаннями про органічні речовини, яких є понад мільйон.
ІV. Вивчення нового матеріалу
- Алкани
Розповідь з елементами бесіди
Алканами (насиченими) називають такі вуглеводні, атоми Карбону в молекулах яких сполучені між собою простими (одинарними) σ-зв'язками. Всі інші одиниці валентності атомів Карбону у цих сполуках зайняті (насичені) атомами Гідрогену. Атоми Карбону в молекулах насичених вуглеводнів перебувають у стані, sp3-гібридизації. Насичені вуглеводні називають ще парафінами. Парафінами органічні сполуки називають тому, що довгий час їх вважали мало реакційноздатними. Стара назва насичених вуглеводнів — аліфатичні, або жирні, вуглеводні.
Насичені вуглеводні утворюють ряд сполук з загальною формулою СnН2n+2 (n - 1, 2, 3, 4, ...). Найпростішою сполукою цього ряду є метан СН4. Тому ряд цих сполук називають ще рядом метанових вуглеводнів. Сполуки ряду метану мають подібні будову і властивості. Такий ряд сполук, представники якого мають близькі хімічні властивості і характеризуються закономірною зміною фізичних властивостей, мають однотипну структуру і відрізняються один від одного на одну або кілька — СН2-груп, називають гомологічним рядом (від грецьк. «гомос» —послідовний, подібність). Як видно з таблиці 1, кожний наступний вуглеводень даного ряду відрізняється від попереднього на групу - СН2. Ця група називається гомологічною різницею, а окремі члени цього ряду — гомологами.
|
Назва вуглеводню |
Структурна формула |
Молекулярна формула |
|
Метан |
CH4 |
CH4 |
|
Етан |
H3C-CH3 |
C2H6 |
|
Пропан |
H3C- CH2-CH3 |
C3H8 |
|
Бутан |
H3C- CH2- CH2- CH3 |
C4H10 |
|
Пентан |
H3C- (CH2)3-CH3 |
C5H12 |
|
Гексан |
H3C- (CH2)4-CH3 |
C6H14 |
|
Гептан |
H3C-(CH2)5-CH3 |
C7H16 |
|
Октан |
H3C- (CH2)6-CH3 |
C8H18 |
|
Нонан |
H3C- (CH2)7-CH3 |
C9H20 |
|
Декан |
H3C-( CH2)8-CH3 |
C10H22 |
Наведені в таблиці алкани мають нерозгалужені карбон-карбонові ланцюги. Такі вуглеводні називають нормальними. Існують вуглеводні і з розгалуженим карбоновим ланцюгом , їх називають ізосполуками. Наприклад, ізобутан має таку будову:
Н3С - СН- СН3.
│
СН3
Атоми Карбону в молекулах органічних сполук поділяють на первинні, вторинні, третинні і четвертинні. Атом Карбону, який безпосередньо сполучений тільки з одним сусіднім карбоновим атомом, називають первинним, атом Карбону, сполучений з двома сусідніми атомами Карбону, — вторинним. Якщо атом Карбону безпосередньо сполучений з трьома або чотирма С-атомами, то такі карбонові атоми називають відповідно третинними або четвертинними.
Первинні атоми вуглецю в даній сполуці обведені колом, вторинний — квадратом, третинний — трикутником, четвертинний — колом, зображеним штриховою лінією.
Завдання : Для вуглеводню складу C5H12 складіть формули двох найближчих гомологів і назвіть їх (виконуємо завдання у зошитах і на дошці).
- Ізомерія
Для алканів характерна структурна ізомерія, пов'язана з розгалуженням їх карбонового ланцюга. Структурні ізомери відрізняються між собою тільки порядком розміщення атомів Карбону в молекулі.
Структурна ізомерія насичених вуглеводнів починається з бутану. Бутан існує у вигляді двох, пентан — у вигляді трьох ізомерів:
Н3С - СН- СН3.
│ H3C- CH2- CH2- CH3
СН3
ізобутан (Ткип = - 11,70С) нормальний бутан (Ткип = - 0,50С)
|
Склад |
Відносна молекулярна маса |
Будова |
Т кип.0С |
|
С5Н12 |
72 |
СН3 – СН2 –СН2– СН2 –СН3 |
+36,07 |
|
С5Н12 |
72 |
СН3 – СН –СН2– СН3 │ СН3 |
+27,9 |
|
С5Н12 |
72 |
СН3 │ СН3 – С –СН3 │ СН3 |
+9,5 |
Гексан має п'ять структурних ізомерів, гептан — дев'ять, октан — 18, нонан — 35, декан —75. Чим більше в молекулі насиченого вуглеводню атомів Карбону, тим більше ізомерів він має. Для вуглеводню С13Н28можливі 802 ізомери, для С14Н30 — уже 1858 ізомерів, дляС15Н32 — 4347, для С20Н42 можливі 366 319 ізомерів.
Для насичених вуглеводнів крім структурної ізомерії властива ще і поворотна ізомерія.
Простий σ-зв'язок не створює перешкод для обертання атомних угруповань, які оточують його. Тому, наприклад, в молекулі етану внутрішнє обертання однієї групи — СН3 відносно другої не повинно викликати деформації σ-зв'язку С—С і може бути вільним. Досліди показують, що при кімнатній температурі цей обертовий рух гальмується. Причиною гальмування є взаємодія не сполучених між собою атомів Гідрогену у двох СН3- групах, що приводить до відштовхування між цими атомами.
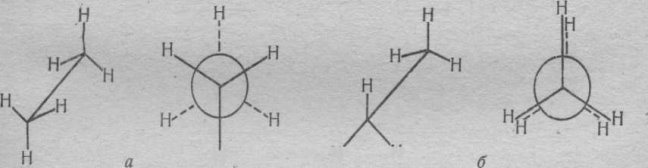 Поворотні ізомери етану:
Поворотні ізомери етану:
а — загальмований; б — заслонений
Такий загальмований обертовий рух в молекулах етану та інших вуглеводнів і їх заміщених приводить до появи поворотних ізомерів.
При обертанні однієї метильної групи в молекулі етану відносно другої навколо в С-С зв'язку атоми цих груп можуть займати в просторі багато різних взаємних положень. Це легко простежити на моделі молекули етану. Такі структури молекули речовини з різним взаємним розміщенням атомів у просторі, які виникають при обертанні навколо простого С-С зв'язку, відносно якого визначається положення атомів у просторі, називають конформаціями або поворотними ізомерами (конформерами).
Якщо ізомерів багато, то не можна називати їх «ізопентан», «ізобутан». Тому виникає проблема, як назвати ці речовини.
Завдання Написати формули ізомерів для гексану.
- Номенклатура алканів
Для побудови назв алканів за систематичною номенклатурою використовують такий алгоритм:
1. У структурній формулі алкану розгалуженої будови вибирають найдовший ланцюг атомів Карбону і нумерують атоми Карбону арабськими цифрами з того кінця, до якого ближче стоїть замісник (радикал). Якщо різні замісники перебувають на однаковій відстані від обох кінців ланцюга, то нумерацію здійснюють з того кінця, біля якого перебуває замісник, який називають першим за алфавітом. Якщо однакові замісники перебувають на однаковій відстані від обох кінців ланцюга, то нумерацію здійснюють з того кінця, де більше відгалужень.![]()
2. Визначають назву кожного замісника. Назви замісників розміщують за алфавітом. Перед назвою кожного замісника через дефіс указують номер атома Карбону з яким сполучений замісник і його назву: 3-етил-5-метил…
Якщо біля одного і того самого атома Карбону є два однакових замісники, то номер атома Карбону повторюють двічі: 2,2-…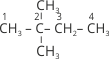
За наявності кількох однакових замісників зазначають їх кількість, додаючи до назви замісника префікс ((2) ди- або ді-, (3) три-, (4) тетра-, (5) пента-, тощо), а перед ним указують номери відповідних атомів Карбону, розподілені комою, а від словесних частин назви відокремлюються дефісом: 3-етил-2,3-диметил…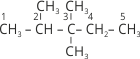
3. В кінці називають алкан за кількістю атомів Карбону в пронумерованому карбоновому ланцюгу: 3-етил-2,3-диметилпентан.
Важливо навчитися зіставляти між собою структури і бачити серед них принципово різні і тотожні.
У молекулі навколо простих карбон-карбонових зв’язків за нормальних умов можливе вільне обертання. Внаслідок цього молекула може набувати різних форм:
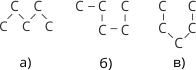
Рис. 4. Різні просторові форми карбонових ланцюгів н-пентану
Слід пам’ятати, якої б форми не набув карбоновий ланцюг, послідовність сполучення атомів в усіх випадках залишається тією самою, що й виражається структурною формулою.
Часто доводиться проводити зворотну процедуру – за назвою алкану написати його структурну формулу. Наприклад, нам необхідно написати структурну формулу 3-етил-2,4,4-триметилгексану.
1. Записуємо ланцюг із шести атомів Карбону і нумеруємо їх: ![]() .
.
2. До третього атома Карбону приєднуємо радикал етил, до другого один, а до четвертого два радикали метилу: 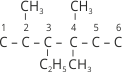 .
.
3. Дописуємо до атомів Карбону головного ланцюга необхідну кількість атомів Гідрогену й отримуємо формулу алкану: 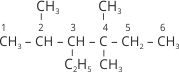 .
.
V. Закріплення вивченого матеріалу
1. Робота в парах - прийом «Мозковий штурм»
Записати структурні формули речовин:
а) 2,5-диметилгексану;
б) 4-етил-2-метилгептану;
в) 2,2-диметилоктану;
г) 3,4-диетил-2,5-диметилгексану;
д) 2,3,3-триметилгептану;
е) 3-етил-3-метилепентану;
є) 3,3,4,4-тетраметигептану;
ж) 2,2,3-триметилпентану;
з) 3-метилпентану;
и) 4-етил-2,5,6-триметилоктану.
2. Кросворд «Ізомерія»
1. Речовина з якої виготовляють свічки
2. Реакції, характерні для насичених вуглеводнів
3. Речовини, які за складом відрізняються на групу СН2
4. Газ, який утворюється внаслідок розкладу решток рослин і тварин без доступу кисню.
5. С5Н12
6. С3Н8
7. Зміна форми та енергії різних орбіта лей одного атома, яка призводить до утворення однакових орбіта лей.
8. Гомологічний…. Метану.
|
1. |
|
|
|
|
|
І |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2. |
З |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3. |
|
О |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4. |
М |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5. |
|
Е |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6. |
|
Р |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7. |
|
І |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8. |
|
Я |
|
|
|
|
|
|
|
|
|
|
VІ. Підсумки уроку
Вправа «Роблю висновок»
Учні по черзі відповідають:
- Що з’ясували?
- Чого навчилися?
VІІ. Домашнє завдання
Опрацювати відповідний параграф
Роздаються картки з випереджальними завданнями: «Методи одержання алканів»
1


про публікацію авторської розробки
Додати розробку

-

Pysarevsky Maksym
06.05.2023 в 21:49
"Первинні атоми вуглецю в даній сполуці обведені колом, вторин¬ний — квадратом, третинний — трикутником, четвертинний — ко¬лом, зображеним штриховою лінією." - це в прикладі не зроблено, тому трохи незрозуміло
Загальна:
4.3
Структурованість
5.0
Оригінальність викладу
3.0
Відповідність темі
5.0
-

Цілінська Олена Григорівна
22.01.2020 в 18:28
Хороший урок. Спасибі.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Супрун Ольга Петрівна
31.10.2018 в 18:48
Дякую.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Шевякова Юлія Миколаївна
21.10.2018 в 19:40
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Лебедь Наталя Анатоліївна
19.10.2018 в 22:47
гарний урок
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Коркішко Анастасія
03.10.2018 в 22:01
хороший конспект
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 3 відгука