Алюміній як хімічний елемент і проста речовина. Фізичні та хімічні властивості алюмінію.








![Мінерали, що містять алюміній PbAl2[(OH)2|CO3]2 · H2O — рідкісна форма свинцево-алюмінієвого гідроксилкарбонатного мінералу Дундазіт Танзаніт Різновидність цоізіту, Ca2 Al3(SiO4)3(OH) Танзаніт Мінерали, що містять алюміній PbAl2[(OH)2|CO3]2 · H2O — рідкісна форма свинцево-алюмінієвого гідроксилкарбонатного мінералу Дундазіт Танзаніт Різновидність цоізіту, Ca2 Al3(SiO4)3(OH) Танзаніт](/uploads/files/1884373/295515/322910_images/16.jpg)
![Мінерали, що містять алюміній Топаз Різновидність силікатів Al2 SiO4 (F,OH)2 Різновидність боросилікатів Na(Li, Al)3 Al6 [(OH)4/(BO3) Si6O18] Турмалін Мінерали, що містять алюміній Топаз Різновидність силікатів Al2 SiO4 (F,OH)2 Різновидність боросилікатів Na(Li, Al)3 Al6 [(OH)4/(BO3) Si6O18] Турмалін](/uploads/files/1884373/295515/322910_images/17.jpg)























Виберіть правильні твердження Всі метали тверді. Метали нерозчинні у воді. Метали знаходяться в головних і побічних підгрупах. На зовнішньому енергетичному рівні металічні елементи містять 1 або 2 електрони. За густиною всі метали важкі. За кольором чорні та кольорові. Більшість металів отруйні.
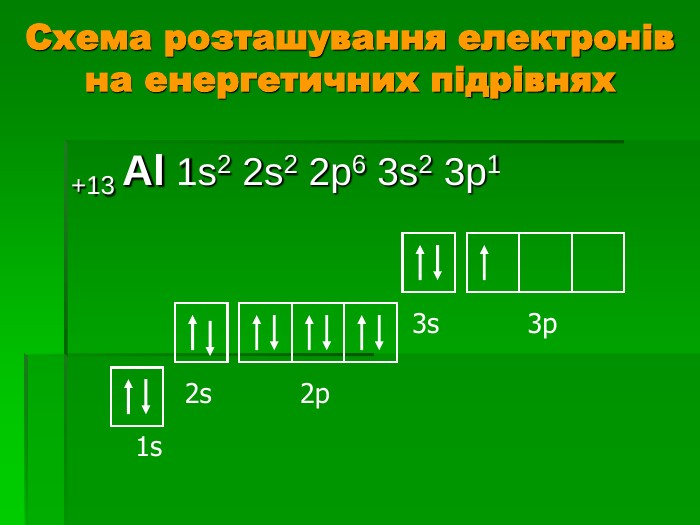
Мета уроку: Дати характеристику елемента за місцем положення в періодичній системі хімічних елементів Вивчити властивості Алюмінію – представника головної підгрупи ІІІ групи На основі будови атому розглянути його фізичні та хімічні властивості, вказати застосування металу в побуті людини Дати відповідь на питання: « Чому алюміній називають металом майбутнього?»
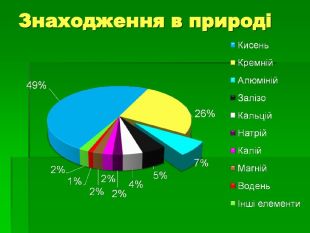
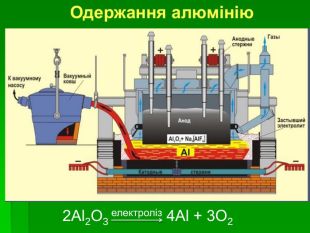
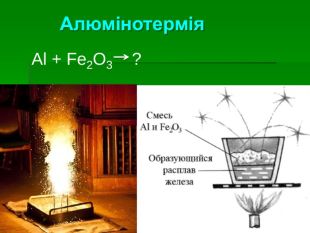
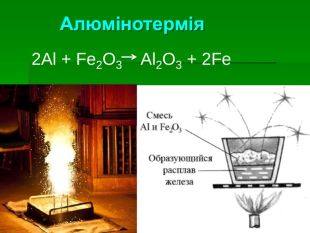
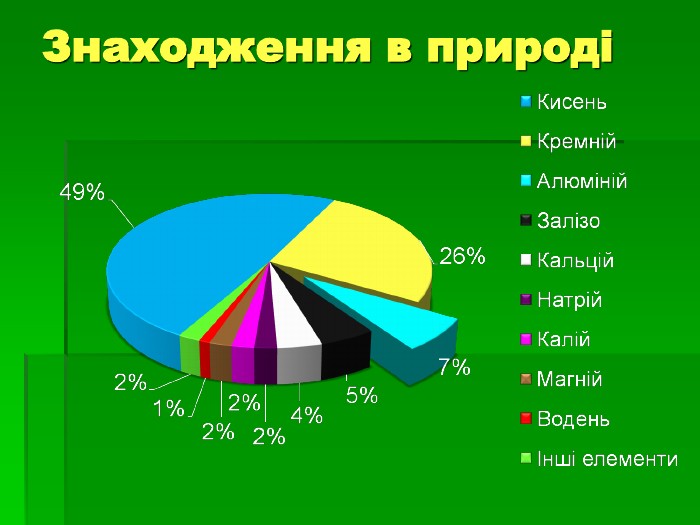
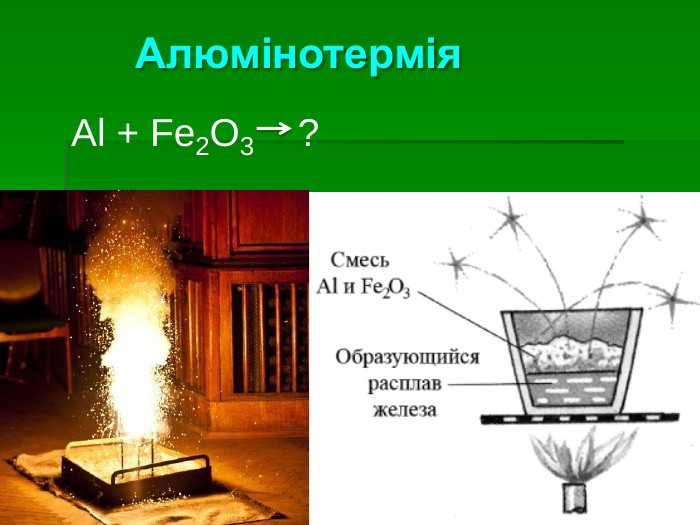
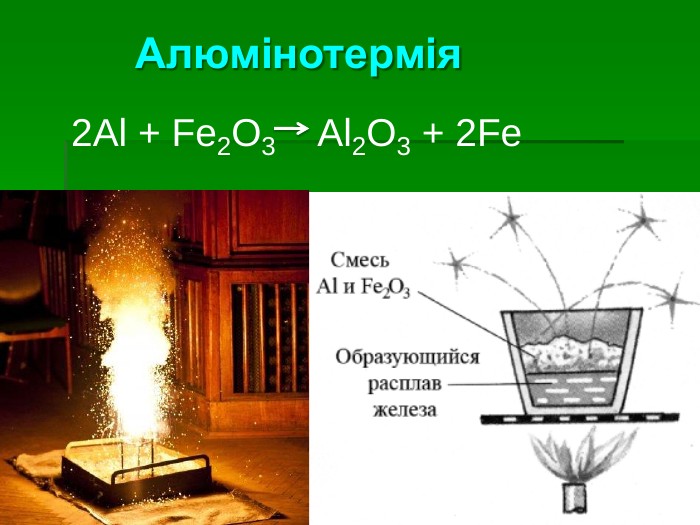
Застосування алюмінію: Самий поширений метал у земній корі. Його ресурси практично невичерпні Має високу корозостійкість Хімічно активний і використовується як відновник (алюмінотермія) Мала густина в поєднанні з високою міцністю та пластичністю – робить його сплави незамінними в різних галузях промисловості й будівництві Відносна висока електропровідність дозволяє заміняти ним більш дорогу мідь в електротехніці
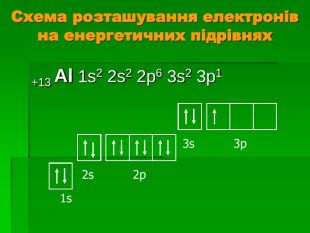
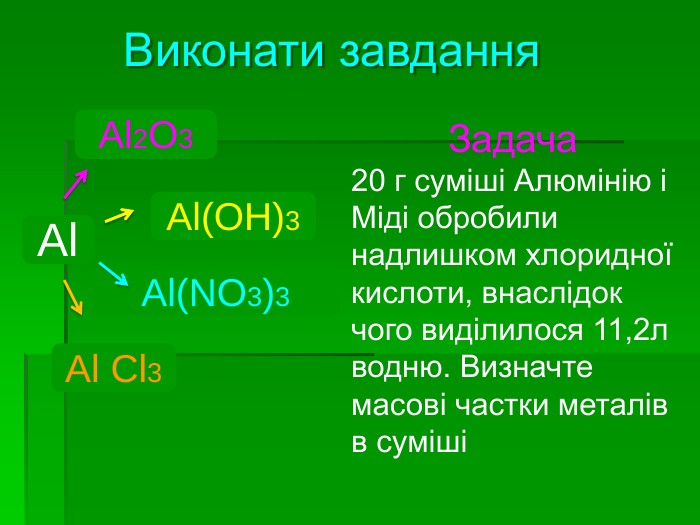
Дати відповідь на запитання Скільки природних ізотопів Алюмінію? Яка валентність та ступінь окиснення Алюмінію? Чому хімічноактивний алюміній важко вступає в хімічні реакції? Чому не можна тримати луги в алюмінієвому посуді ? Які кислоти не взаємодіють із Алюмінієм при кімнатній температурі?
Метал майбутнього, нанотехнології Подрібнивши алюміній і перемішавши його з 1% фулеренів в аргоновій атмосфері вчені німецького концерну Siemens одержали новий матеріал, який після пресування набуває твердості ніж у сталі й при цьому не втрачаючи свої властивості Фулерени – недавно відкрита нова форма вуглецю
Із історії відкриття У період відкриття алюмінію - метал був дорожче золота. Англійці вирішили нагородити великого російського хіміка Д.І. Менделєєва і подарували йому хімічні терези. В яких одна чаша була виготовлена із золота, а інша – з алюмінію (чаша з алюмінію коштувала дорожче золота). Одержання “срібла із глини” зацікавило не лише вчених та промисловців, а навіть імператора Франції Д.І. Менделєєв


про публікацію авторської розробки
Додати розробку