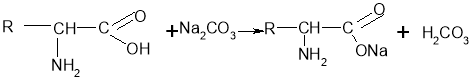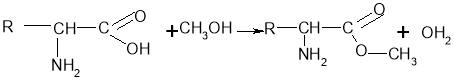Амінокислоти, склад, властивості та застосування. Білки фізичні та хімічні властивості.
Тема. Амінокислоти. Класифікація, назви, ізомерія.
Мета: вивчити склад та будову амінокислот, звернути увагу на їх класифікацію та номенклатуру, вивчити типи ізомерії амінокислот.
Очікуваний результат:
Учень:
- знає, які речовини відносяться до амінокислот,
- пояснює будову молекул амінокислот та їх класифікацію,
- порівнює їхні назви,
- розуміє значення ізомерії,
- аналізує типи ізомерії.
Тип уроку: засвоєння нових знань.
Форми проведення уроку: фронтальна бесіда, хімічний словничок, робота з підручником, таблицею, схемою, «мікрофон».
Прилади і реактиви: схеми, кулестержневі моделі.
І. Організаційний момент.
ІІ. Актуалізація життєвого досвіду.
Фронтальна бесіда:
- Як ви думаєте, з яких частин повинні складатися такі речовини, як амінокислоти?
- Назвіть аміногрупу.
- Назвіть кислотну групу.
Перевірка домашнього завдання.
ІІІ. Мотивація навчальної діяльності. Білки, з яких складається наше тіло, побудовані із різної комбінації 20-и амінокислот. Приблизно половину з них організм може синтезувати сам. Але 8 амінокислот він обов’язково повинен одержувати з їжею – ці кислоти незамінні. Деякі амінокислоти містять Сульфур, крім того, всі його 150 г, які є у дорослому організмі, входять до складу білків нігтів, волосся та шкіри. Фрагменти їхніх молекул входять не лише до складу білків, а й ферментів та гормонів. І сьогодні ми говоритимемо про ці речовини.
ІV. Вивчення нового матеріалу.
Хімічний словничок:
Амінокислоти – похідні вуглеводнів, у молекулах яких містяться аміно- і карбоксильні групи.
Загальна формула амінокислот:
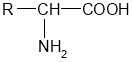
У залежності від того, біля якого атома Карбону стоїть аміногрупа, розрізняють α, β, γ-амінокислоти: α-амінокислота – це така амінокислота, в якій аміногрупа стоїть біля атома Карбону, сполученого з карбоксильної групою, у β-амінокислоті аміногрупа стоїть біля другого атома Карбону після того атома, що сполучений з карбоксильної групою і т. д. В живому організмі білки складаються з α-амінокислот.
Робота з підручником: скласти схему різних типів класифікації амінокислот (стор. 245).
Орієнтовна схема:

Робота з таблицею на стор. 246 «Формули і назви амінокислот».
Найпростішою кислотою є аміноетанова (амінооцтова) кислота. Припускають, що амінометанової кислоти не існує, бо в момент утворення вона розкладається на амоніак і вуглекислий газ.
Завдання для класу:
- Пояснити, як назвати амінокислоти за систематичною номенклатурою.
- Скласти формули 2-амінобутанової, 3-амінобутанової та 2-амінометилпропанової кислот і на їх основі пояснити структурну ізомерію карбонового ланцюга.

V. Закріплення вивченого матеріалу.
1. «Мікрофон»:
- За якими ознаками ми відносимо речовини до класу амінокислот?
2. Самостійно: № 301, 302, 303.
VІ. Домашнє завдання: вивчити відповідний § в підручнику
Тема. Амінокислоти. Особливості хімічних властивостей амінокислот, зумовлені поєднанням аміно- і карбоксильної груп. Пептидний зв'язок.
Мета: вивчити властивості амінокислот, звернути увагу на поєднання аміно- та карбоксильної груп, вивчити новий тип зв’язку.
Очікуваний результат:
Учень:
- знає, які речовини відносяться до амінокислот,
- пояснює властивості амінокислот,
- порівнює їхні властивості з одноосновними карбоновими кислотами,
- розуміє особливості хімічних властивостей амінокислот, зумовлені поєднанням аміно- і карбоксильної груп,
- аналізує типи хімічних реакцій.
Тип уроку: комбінований урок.
Форми проведення уроку: самостійна робота, робота з підручником, схемою, робота в групах.
Прилади і реактиви: схеми, кулестержневі моделі.
І. Організаційний момент.
ІІ. Актуалізація опорних знань.
- Самостійна робота по варіантах (кожне завдання оцінюється у 2 бали).
І варіант
- Чому анілін з бромом реагує легше, ніж бензен?
- Що таке біполярний йон і які речовини його утворюють?
- Обчисліть масові частки Карбону та Гідрогену в амінооцтовій кислоті.
- Прокласифікуйте амінокислоти.
- Допишіть рівняння реакції: а) С6Н5NН2 + О2 → б) С6Н5NН2 + НСІ →
- Складіть ланцюг перетворень, використовуючи анілін.
ІІ варіант
- Чому основні властивості в аніліну виражені меншою мірою, ніж в метиламіну?
- Що таке амінокислоти та назвіть типи їхньої ізомерії.
- Назвіть фізичні властивості амінокислот.
- Обчисліть масові частки Нітрогену та Оксигену в амінооцтовій кислоті.
- Допишіть рівняння реакції: а) С6Н5NН2 + Br2 → б) С6Н5NО2 + 6Н →
- Складіть ланцюг перетворень, використовуючи відомі вам речовини.
- Перевірка домашнього завдання.
ІІІ. Мотивація навчальної діяльності.
Амінокислоти цікаві тим, що з них у нашому організмі утворюються білки. А за рахунок білків, ми знаємо з біології, ми з вами ростемо, та будуємо свій організм. Крім таких реакцій, ми сьогодні будемо звертати увагу і на інші властивості амінокислот.
ІV. Вивчення нового матеріалу.
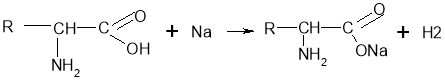
Хімічні властивості амінокислот подібні до інших карбонових кислот: вони реагують з активними металами, спиртами, деякими солями (карбонатами), амоніаком.
Властивості відмінні від інших карбонових кислот:
-
Взаємодіють у розчині із купрум(ІІ) гідроксидом. При цьому утворюються сполуки синього кольору. Це якісна реакція на альфа-амінокислоти.
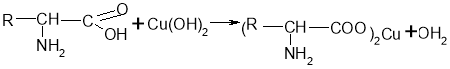
- Реакції між амінокислотами з утворенням пептидного зв’язку:
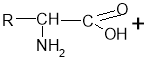
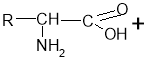
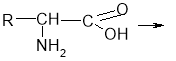 БІЛОК
БІЛОК
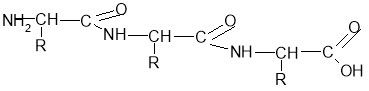
Зв'язок між атомами Карбону та Нітрогену називається пептидним:
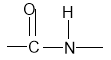 Якщо однакові групи утворюють молекулу білка, то це поліпептид.
Якщо однакові групи утворюють молекулу білка, то це поліпептид.
Робота в групах:
Група 1. Намалювати схему добування амінокислот.
Група 2. Намалювати схему застосування амінокислот.
V. Закріплення вивченого матеріалу.
1. Робота над висновками: підручник, стор. 250.
2. Вправи з підручника на стор. 250 – 251: № 306 – 308.
VІ. Домашнє завдання: вивчити відповідний § в підручнику
Тема. Білки: склад, будова і властивості. Класифікація та біологічна роль білків.
Мета: вивчити склад і будову білків, формувати практичні вміння і навички роботи з реактивами при вивченні властивостей білків, удосконалювати вміння виконувати хімічний експеримент, повторити правила техніки безпеки під час роботи з реактивами.
Очікуваний результат
Учень:
- знає склад та будову білків;
- виконує практичний експеримент;
- повторює правила техніки безпеки;
- аналізує значення білків у клітині та в організмі в цілому.
Тип уроку: засвоєння вмінь, знань та навичок.
Форми проведення: метод критичного мислення «Що знаємо? Що хочемо дізнатися? Що дізналися?», робота з термінами, лабораторний дослід, робота з підручником – критичне читання, практичний експеримент, есе, фронтальна бесіда.
Обладнання та реактиви: таблиці «Амінокислоти», «Структура білка», кулестержневі моделі структур білкової молекули, склянки, пробірки, штатив, спиртівка, сірники, розчин білка, купрум(ІІ) сульфат, концентрована нітратна кислота, розчин лугу.
І. Організаційний момент
ІІ. Мотивація навчальної діяльності.
Вчитель біології. З якими матеріальними об’єктами пов’язана таємниця життя? Це одне з головних запитань, на яке намагалася дати відповідь наука на протязі своєї історії. І вже досить давно вчені зрозуміли, що найголовнішу роль в усіх життєвих процесах відіграють білки.
Символом початку життя завжди було яйце. Ось чому білок пташиних яєць дав назву всьому класові білків. Коли в ХІХ столітті відкрили, що білки – головні компоненти клітин, всі прояви життя почали пов’язувати тільки з ними.
Навіть структура білків була оповита ледь не містичною таємницею. Вперше зважився підняти над нею завісу італієць Б.Пеккарі: він вилучив з пшениці клейковину, змусив її продукти вступити в різні реакції і виявив, що вони – лужні. Наприкінці ХІХ ст. німецький вчений Е. Геккель сказав: «Якщо ви, хіміки, створите справжній білок, то він заворушиться!» Чи варто дивуватися, що в той час газети і журнали розважали своїх читачів карикатурами: вчені синтезують ковбасу! Таким був «дим» від вогню, який розпалив «німецький біохімік Е. Фішер, творець цілої школи, що взялася шукати відповідь на запитання, що таке – білок.
Отож, ми маємо нагоду придивитися сьогодні до цієї речовини, з якої Фішер терпляче і послідовно зривав містичні домисли, оголюючи хай не простий, але цілком зрозумілий за своєю будовою скелет.
Вчитель хімії. Темою нашого уроку сьогодні будуть білки, їхній склад, будова і властивості. А також звернемо увагу на роль білків у живих організмах. Для цього згадаємо те, що вже знаємо про білки та заповнимо таблицю:
|
Що знаємо? |
Що хочемо дізнатися? |
Що дізналися? |
|
Білки беруть участь в обміні речовин. Білки є будівельним матеріалом організму. Ферменти мають білкову природу. Білки утворюються з амінокислот. |
Склад та будова молекул білків. Властивості білків. Хімічні реакції, в які вступають білки. |
|
ІІІ. Вивчення нового матеріалу.
Вчитель біології. Отже, білки є будівельним матеріалом для живих організмів. Вони регулюють обмін речовин, забезпечують рухову діяльність організму, захищають його від чужорідних тіл, каналізують хімічні реакції в клітинах, переносять поживні речовини до органів і тканин. Білки – джерело енергії для організму. При розщепленні 1 г білка виділяється 17,7 кДж теплоти.
В організмах тварин і людини міститься більше білків, ніж у рослинах. Вони є складовими м’язової, сполучної, покривної тканин, шкіри, нігтів, волосся.
Велика кількість їх міститься навіть у молоці. Білки представлені у молоці кількома видами. Найголовніші з них казеїн – 2,7 %, альбумін – 0,5 % та глобулін – 0,1 % по відношенню до загальної кількості сухих речовин. У склад білків входять незамінні амінокислоти, без яких організм не може нормально розвиватися:
- лізин,
- метіонін,
- триптофан,
- фенілаланін,
- валін,
- треонін,
- лейцин,
- ізолейцин.
Казеїн – основний білок молока – відноситься до групи фосфоро-протеїдів (містять фосфор) і є нерозчинними у воді, входить до складу сирів та сирних виробів. Із загальної кількості білків в молоці на долю казеїну припадає 82 %. Саме казеїн надає молоку білий непрозорий колір.
Відомі три його форми: α, β, і γ, які відрізняються між собою вмістом фосфору, кальцію, а також швидкістю звертання від сичужного ферменту. Фракція α – казеїну добре звертається під впливом сичужного ферменту, β – дещо гірше, а γ – не звертається зовсім.
Виділений з молока кислотою і оброблений спиртом, казеїн являє собою білий порошок без запаху і смаку з густиною 1,26.
Казеїн має ряд особливостей, що обумовлюють його практичне застосування. При кип’ятінні молока він не випадає в осад, звертається під дією сичужного ферменту, утворюючи густий, солодкий на смак згусток і солодку сироватку. Ця особливість застосовується при переробці молока в сир, а також для одержання казеїну. Він звертається також при дії на нього слабких розчинів кислот. При скисанні молока казеїн утворює під дією молочної кислоти густий згусток, який називається кислим молоком (молочна кислота збирається у молоці в результаті бродіння молочного цукру з участю молочнокислих бактерій). У сильних кислотах та лугах казеїн розчиняється. Ця властивість використовується при визначенні жиру в молоці. Казеїн проявляє амфотерні властивості, при додаванні невеликої кількості слабкої кислоти або лугу нейтралізує їх, не міняючи реакції.
Альбумін і глобулін. Після видалення фільтруванням згорнутого казеїну залишається прозорий фільтрат, який містить альбумін, глобулін, молочний цукор, вітаміни, ферменти, мінеральні речовини.
Альбумін і глобулін, на відміну від казеїну, розчинні у воді, не містять фосфору та кальцію, випадають в осад лише при нагріванні вище 700 С. Відомі такі основні фракції сироваткових білків:
- сироватковий альбумін,
- β – лактоглобулін,
- α – лактоальбумін,
- імунні глобуліни.
Якщо загальну кількість білків молока прийняти за 100 %, то на долю альбуміну припаде 12 %, а глобуліну – 6 %. Крім фізіологічного значення для організму, ці білки використовуються для приготування білкових лікувальних та дієтичних препаратів, для встановлення ступеня пастеризації молока.
У природі білки виконують дуже багато функцій:
Учні називають функції які виконують білки.
Вчитель хімії. Білки побудовані з п'яти основних елементів: Карбон (50 – 55%), Оксиген (21,5 – 23,5%), Нітроген (15 – 17%), Гідроген (6,5 – 7,3%) і Сульфур (0,3 – 2,5%). Крім них, у деяких білках є невелика кількість Фосфору, Йоду, Феруму, інших елементів. Значення молекулярних мас білків досить великі.
Робота з термінами:
- Білки – це поліпептиди, які складаються з фрагментів молекул α-амінокислот і виконують специфічні функції в живих організмах.
-
 Протеїни – прості білки.
Протеїни – прості білки.
Такою є класифікація білків.
- Протеїди – складні білки.
- Амінокислоти – мономери білків.
Лабораторний дослід: З кулестержневих моделей складіть 2 моделі амінокислоти. З'єднайте їх докупи пептидним ( - С – N - ) зв’язком, відщепивши молекулу води.
Одержуємо білковий ланцюг:
![]()
![]()
![]()
![]()
![]()
![]()
![]() H2N – CH – C – N – CH – C – OH
H2N – CH – C – N – CH – C – OH
R1 O H R2 O
Цей ланцюг складається лише з двох молекул амінокислот, а їх може бути дуже велика кількість.
Робота з підручником: стор. 253 – 254, пункт «Структура білка» (5 – 6 хвилин для критичного читання).
Метод спрямованого (критичного) читання:
-З Яке запитання автор ставить? (орієнтовна структура білка)
-В Яка відповідь пропонується? (первинна, вторинна, третинна, четвертинна)
-П Які причини наводяться? (просторова будова білка, утворення глобул)
-Д Які докази наведено? (виникнення хімічних зв’язків)
-Ф Яким фактам ми маємо повірити? (зображеним фрагментам)
-Б Якої інформації бракує? (прикладів молекул білків)
-С Які вагомі слова використані? (глобула, спіраль, водневий зв'язок)
Вчитель хімії. Отже, залишилося ще дослідити властивості білків. Однією із важливих властивостей є розчинення деяких білків у воді з утворенням колоїдних розчинів. Проведіть домашній експеримент: білок яйця попробуйте вдома розчинити у воді. Спостереження опишіть. Інша властивість білків, неменш важлива – це денатурація білків. Денатурація – це осадження білка, під час якого руйнуються вторинна, третинна і четвертинна структура білка. Денатурація відбувається як під впливом хімічних речовин, так і при нагріванні.
Вчитель біології. Однак харчові продукти після денатурації білків легше засвоюються організмом – яєчня або зварене яйце порівняно із сирим, кисле молоко порівняно із свіжим.
Практичний експеримент (проводить вчитель хімії або його асистент, обраний ним з учнів класу, решта учнів у класі описують спостереження і роблять висновки):
- Повторення правил техніки безпеки при роботі з кислотами та лугами.
- Біуретова реакція – єдина реакція, яку дають усі білкові сполуки. У пробірку наливаємо по 1 мл розчинів білка курячого яйця і лугу, потім – кілька крапель розчину купрум(ІІ) сульфату. Перемішайте вміст пробірки. Що спостерігаєте? Білок + луг + купрум(ІІ) сульфат → синьо-фіолетове (фіалкове) забарвлення. Ця реакція є якісною на пептидні групи.
- Ксантопротеїнова реакція – реакції білків з утворенням жовтого забарвлення, її дають білки з фрагментами молекул ароматичних амінокислот. У пробірку налийте 1 мл розчину білка курячого яйця і додайте 0,5 мл 20 %-ого розчину нітратної кислоти. Який колір осаду, що утворився? Нагрійте вміст пробірки. Чи змінюється колір осаду? Після охолодження добавте до осаду трохи розчину лугу. Що спостерігаєте? Білок + НNО3 → жовте забарвлення. В разі добавляння лугу забарвлення посилюється, стає оранжевим.
ІV. Закріплення вивченого матеріалу.
- Заповнення третьої колонки таблиці:
|
Що знаємо? |
Що хочемо дізнатися? |
Що дізналися? |
|
Білки беруть участь в обміні речовин. Білки є будівельним матеріалом організму. Ферменти мають білкову природу. Білки утворюються з амінокислот. |
Склад та будова молекул білків. Властивості білків. Хімічні реакції, в які вступають білки. |
Значення білків для організму. Склад білкових молекул та їхню структуру. Класифікацію білків. Властивості білків. |
Білки – це природні високомолекулярні сполуки, значення молекулярних мас може коливатися від 10 000 до кількох мільйонів. Білки, фрагментами яких є виключно α – амінокислоти, називаються простими білками. За своєю розчинністю у воді їх поділяють на глобулярні і фібрилярні. Глобулярні білки – це прості білки, що розчиняються у воді або утворюють з нею колоїдні розчини. Всі вони розчиняються в водних розчинах кислот, основ і солей. Наприклад: білок курячого яйця, інсулін, білки крові. Фібрилярні білки - це прості білки, нерозчинні у воді. Такі білки містяться у шкірі, волоссі, тканинах м'язів – їх називають структурними білками. Наприклад: кератини – містяться в шерсті, волоссі, нігтях; колагени – знаходяться в шкірі та сполучних тканинах; фіброїн – входить до складу шовку; еластин – містяться в легенях, артеріях, деяких сухожиллях.
- Фронтальна бесіда:
- Що таке білки?
- Які склад молекул та структуру мають білки?
- Як класифікують білки?
- Чому реакції за участю білків називають кольоровими?
- Написати невеличке есе на тему «Біологічна роль білків»
V. Домашнє завдання: вивчити відповідний §
1


про публікацію авторської розробки
Додати розробку