Презентація до уроку хімії "Білки"
Про матеріал
Презентація до уроку хімії 10 клас з теми "Білки" за підручником П.П.Попель, Л.С.Криля Хімія,10 рівень стандарту. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку










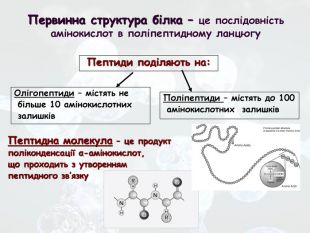




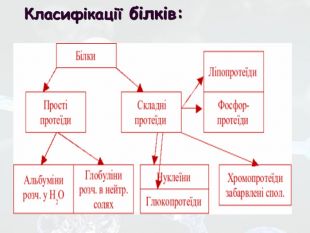
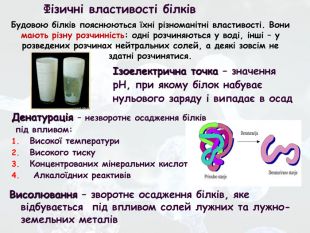


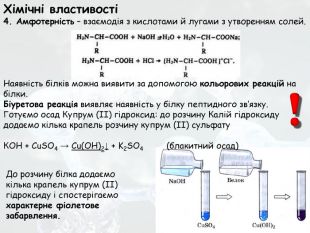
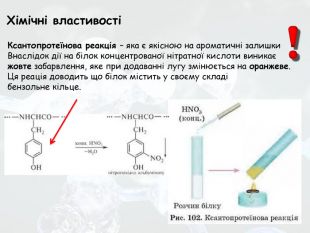


-

Пархомук Наташа
21.04.2024 в 18:14
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Урбанська Галина Владиславівна
21.09.2023 в 15:56
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Висоцька Ольга
25.04.2023 в 09:24
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Земелько Катерина Олександрівна
05.10.2022 в 20:26
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Гурєєва Ольга В'ячеславівна
29.03.2021 в 22:40
Дуже змістовно! Дякую!
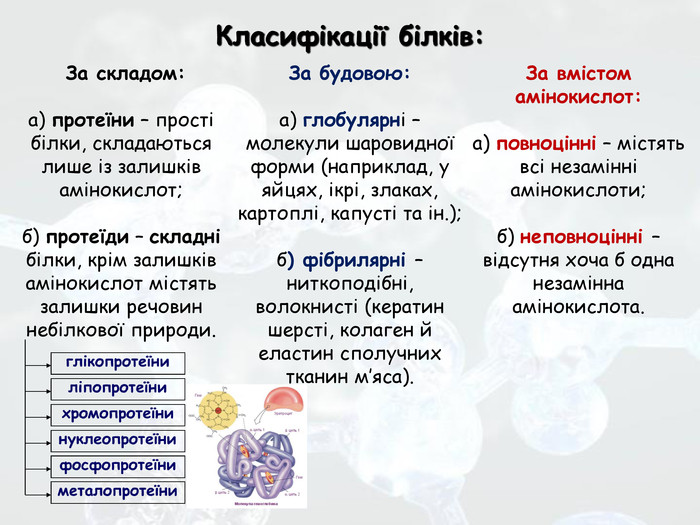
На 8 слайді прості білки названі протеїди, а треба протеїни. Звісно, що це опечатка.
А взагалі чудова презентація.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Балімова Оксана Олександрівна
06.05.2020 в 22:58
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 3 відгука