"Ароматичні вуглеводні"
![]() ( Ароматичні ВВ)
( Ароматичні ВВ)
Арени - це ВВ, молекули яких містять одно або декілька бензольних кілець
Наприклад:
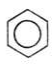
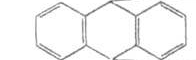
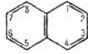
Бензол Антрацен Нафталін
АРЕНИ РЯДУ БЕНЗОЛУ (моноциклічні арени)
СnH2n-6, n ≥ 6
Найпростіший представник бензол С6Н6.
Це ненасичені ВВ. В 1865 р. німецький хімік Кекуле А.Ф. запропонував циклічну формулу бензолу
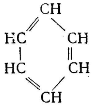 Циклогексатрієн 1,3,5
Циклогексатрієн 1,3,5
Така структура молекули бензолу не пояснювала багато властивостей бензолу:
1).Для бензолу характерні реакції заміщення, а не реакції приєднання, властиві ненасиченим ВВ. Реакції приєднання можливі, але проходять важче, чим для алкенів.
2).Бензол не вступає в реакції, що являються якісними на ненасичені ВВ (з Br2(H2O) і розчином КМnО4).
Сучасна теорія для пояснення будови молекули С6Н6 використовує уяву про гібридизацію орбіталей атома карбону.
Атоми С в бензолі знаходяться в стані SP2-гібридизації. Кожний атом «С» утворює три![]() зв’язки (два з атомами карбону і один з атомом Н). Всі
зв’язки (два з атомами карбону і один з атомом Н). Всі ![]() зв’язки знаходяться в одній площині:
зв’язки знаходяться в одній площині:
Кожний атом С має один Р-електрон, котрий не бере участі в гібридизації. Негібридизовані Р орбіта лі атомів С знаходяться в площині перпендикулярній площині ![]() зв’язків. Кожна Р орбіталь перекривається з сусідніми утворюючи єдину спряжену
зв’язків. Кожна Р орбіталь перекривається з сусідніми утворюючи єдину спряжену ![]() -систему.
-систему.
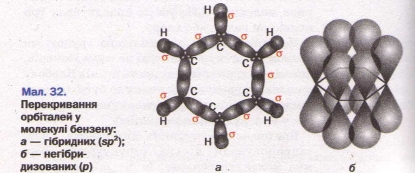
Поєднання шести ![]() зв'язків з єдиною
зв'язків з єдиною ![]() -системою – ароматичний зв'язок .
-системою – ароматичний зв'язок .
Цикл із 6 атомів С, зв'язаних ароматичним зв’язком , називається бензольним кільцем, або бензольним ядром.
Фізичні властивості бензолу – рідина б/б, tº пл. 5,5ºС, tº кип. 80 ºС, специфічний запах , не змішується з Н2О, гарний розчинник, токсичний .
Хімічні властивості бензолу
Ароматичний зв'язок визначає хімічні властивості бензолу і інших ароматичних ВВ.
6![]() - електронна система являється більш стійкою, чим звичайні двохелектронні
- електронна система являється більш стійкою, чим звичайні двохелектронні ![]() -зв'язки. Тому реакції приєднання менш характерні для ароматичних ВВ, чим для ненасичених ВВ. Найбільш характерні реакції заміщення:
-зв'язки. Тому реакції приєднання менш характерні для ароматичних ВВ, чим для ненасичених ВВ. Найбільш характерні реакції заміщення:
І. Реакції заміщення
1. Реакції галогенування
![]()
![]() [H Br
[H Br
![]()
![]() + Вr 2 FeBr3
+ Вr 2 FeBr3 ![]() + HBr
+ HBr
бромбензол
2. Нітрування (сумішшу конц.НNO3 i H2SO4) – нітруюча суміш
![]()
![]() [Н NO2
[Н NO2
![]()
![]() + HO]-NO2 H2SO4(конц.)
+ HO]-NO2 H2SO4(конц.) ![]() +H2O
+H2O
нітробензол
3.Сульфурування
![]()
![]() [Н SO3H
[Н SO3H
![]()
![]() + HO]SO3H tº
+ HO]SO3H tº ![]() + H2O
+ H2O
сульфобензол
4.Алкірування /заміщення «Н» на алкільну групу/
![]()
![]() Н С2Н5
Н С2Н5
![]()
![]() + С2Н5 [-Cl AlCl3
+ С2Н5 [-Cl AlCl3 ![]() +HCl
+HCl
етилбензол
ІІ. Реакції приєднання
1.Гідрування
![]()
![]() +3Н2 Ni
+3Н2 Ni ![]() циклогексан
циклогексан
С6Н6 150º-160 ºC С6Н12
2. Приєднання хлору
![]()
![]() + 3Cl2 hυ
+ 3Cl2 hυ 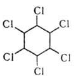 гексахлорциклогексан /С6Н6Сl6/
гексахлорциклогексан /С6Н6Сl6/
ІІІ. Реакції окислення
- Горіння 2С6Н6 + 15О2 = 12СО2 + 6Н2О
- Неповне окиснення (КМnО4 або K2Cr2O7 в кислому середов.)
Бензольне кільце стійке до дії окисників. Реакція не проходить.
Добування бензолу:
- В промисловості:
- переробка нафти і вугілля;
- дегідрування циклогексана /Н.Д.Зелінський/
Pt, Pol
![]()
![]() 3000
3000 ![]() + 3Н2
+ 3Н2
Циклогексан
- дегідроциклізація (ароматизація) гексана /Н.Д.Зелінський…/
![]() СН3 – СН2 – СН2 – СН2 – СН2 – СН3 300ºС
СН3 – СН2 – СН2 – СН2 – СН2 – СН3 300ºС ![]() +4Н2
+4Н2
Рt
- тримерізація ацетилена
![]() 3НС ≡ СН ≈500 ºС
3НС ≡ СН ≈500 ºС ![]()
С
- В лабораторії:
![]()
![]()
![]() Сплавлення солей бензойної кислоти з лугами:
Сплавлення солей бензойної кислоти з лугами:
![]()
![]() О
О
![]()
![]()
![]()
![]()
![]() С-ОNa
С-ОNa
![]()
![]()
![]()
![]()
![]()
![]() +NaOH tº
+NaOH tº ![]() +Na2CO3
+Na2CO3
![]() твердий
твердий
Бензонат
Натрія/твердий/
Застосування бензола:
 Ліки Барвники
Ліки Барвники
![]()
![]()
Полімери Розчинники
Отрутохімікати
Ізомерія і номенклатура гомологів бензола
Любий гомолог має вічний ланцюг, тобто алкільний R зв’язаний з бензольним кільцем /ядром/.
Перший гомолог – бензольне ядро + метальний R:
СН3
![]()
![]() - метилбензол, толуол, фенілметан /так як С6Н5 – феніл.
- метилбензол, толуол, фенілметан /так як С6Н5 – феніл.
Правила складання назв:
- Перерахувати замісники в алфавітному порядку.
- Позначити № атома «С» де міститься замісник.
- Можна позначати орто- (0) – 1,2 ; пара- (n) – 1,4
(в разі двох замісників) мета- (м) – 1,3 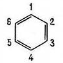
![]() Наприклад: СН3-СН3
Наприклад: СН3-СН3
![]()
![]() СН3-СН3 МЕТАІЗОПРОПІЛЕТИЛБЕНЗОЛ
СН3-СН3 МЕТАІЗОПРОПІЛЕТИЛБЕНЗОЛ
![]()
![]()
СН3


про публікацію авторської розробки
Додати розробку
