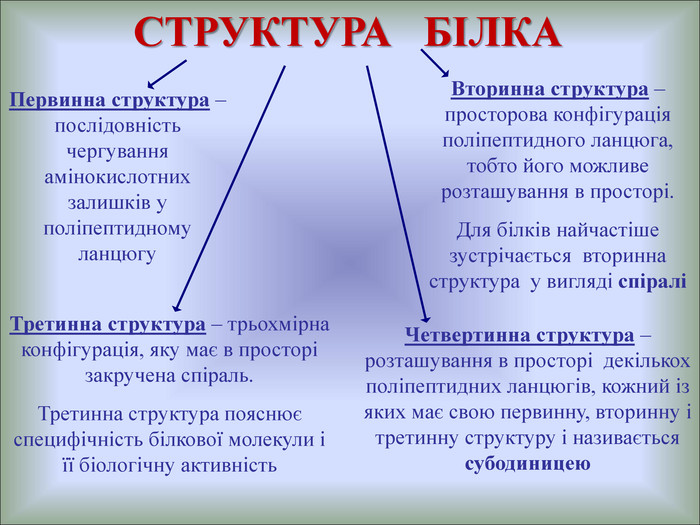
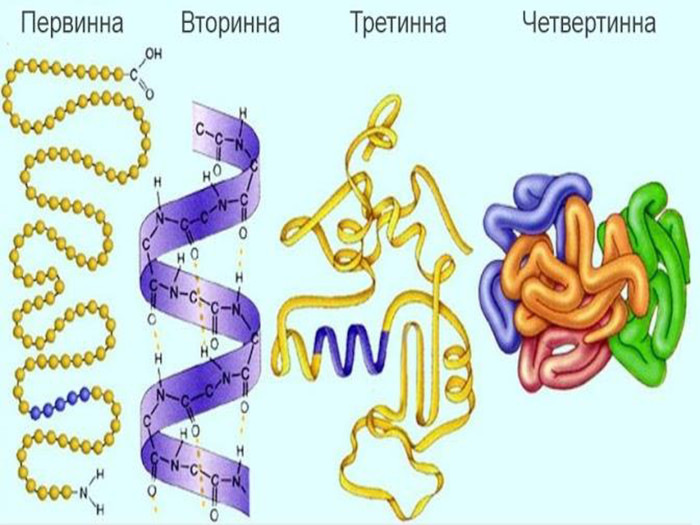
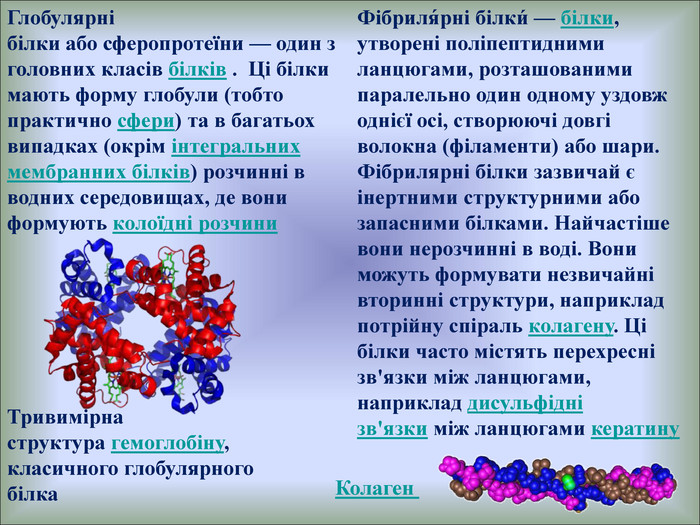
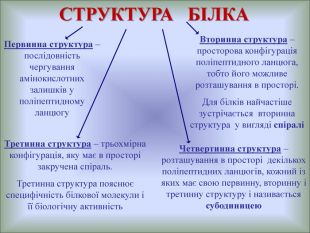
Білки - високомолекулярні природні органічні полімери
Про матеріал
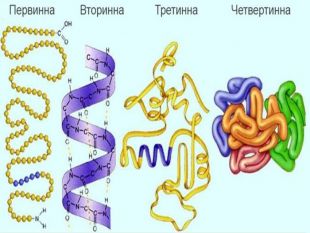
Презентаційний матеріал до уроку розкриває структуру білків (первинну, вторинну, третинну, четвертинну, протеїни, протеїди, глобулярні, фіюрілярні білки), властивості, кольорові реакції реакції на білки, функції. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
ppt
До підручника
Хімія 9 клас (Березан О.В.)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку