Білки як високомолекулярні сполуки. Хімічні властивості білків (без запису рівнянь реакцій)».
Тема уроку №42: «Білки як високомолекулярні сполуки. Хімічні властивості білків (без запису рівнянь реакцій)».
Мета:
освітня – створити умови для формування поняття про білки як природні полімери та їх значення в житті людини; про склад та структуру білкових молекул: первинну, вторинну, третинну, четвертинну; фізичні та хімічні властивості на прикладі гідролізу й денатурації;
розвиваюча - допомогти розвивати пізнавальні здібності, логічне мислення: вміння робити висновки, порівнювати, виділяти головне.
виховна – сприяти формуванню культури розумової праці, самовладання, емпатіі, вмінню працювати індивідуально, в групі, в колективі.
Формування ключових компетентностей: спілкування державною мовою, основні компетентності у природничих науках і технологіях, ініціативність і підприємливість, уміння вчитися впродовж життя, соціальна та громадянська компетентності, обізнаність та самовираження у сфері культури, екологічна грамотність і здорове життя.
Наскрізні лінії: «Здоров’я і безпека».
Обладнання: ПК, презентація, яєчний білок, хімічна склянка, вода, скляна паличка, спирт етиловий (98%), спиртівка, купрум(ІІ) сульфату СuSO4.
Основні поняття та терміни: білки, амінокислоти, полімери, мономери, первинна, вторинна, третинна, четвертинна структура, денатурація, гідроліз, осадження.
Методи та прийоми: Інтелектуална розминка: «Так чи Ні», ілюстрація, фронтальна бесіда, демонстрація, розповідь, самостійна робота.
Тип уроку: засвоєння нових знань.
Дата проведення: ___________
Клас: 10
Структура уроку
І.Етап орієнтації, мотивації діяльності.
ІІ. Етап контролю домашнього завдання.
 ІІІ. Етап цілевизначення та планування.
ІІІ. Етап цілевизначення та планування.
ІV.Етап цілереалізації.
V. Рефлексивно-оцінювальний етап.
VІ. Етап повідомлення домашнього завдання.
Хід уроку.
І.Етап орієнтації, мотивації діяльності.
Привітання з класом, налаштування на робочий настрій.
ІІ. Етап контролю домашнього завдання.
Усне опитування.
1. Поняття про амінокислоти. Загальна формула, функціональні групи.
2. Ізомерія амінокислот.
3. Хімічні властивості амінокислот.
Щоб приступити до вивчення нового матеріалу, необхідно пригадати, яку тему ми вивчили на минулому уроці? (Амінокислоти) (Слайд 3)
Інтелектуална розминка: «Так чи Ні»
1.Амінокислоти зустрічаються в живих організмах.
2.Амінокислоти містять групу -NH2 ;
3.Молекули амінокислот містять три функціональні групи;
4.Хімічна формула амінооцтової кислоти С2Н5NО2;
5.Молекули амінокислот з’єднуються пептидним зв’язком;
6.Амінокислоти є амфотерними сполуками;
7.-СО-NН2- карбоксильний зв'язок;
8.У природі існують родовища амінокислот;
9. Індикатор у розчинах амінокислот виявляє нейтральну реакцію;
10.За допомогою пептидного зв’язку з амінокислотних залишків побудовані молекули білків.
ІІІ. Етап цілевизначення та планування.
Опрацювавши тему «Білки» ви зможете: (Слайд 2)
 Ми продовжуємо вивчати азотовмісні сполуки. Отож, можна констатувати, що ви маєте добрі знання про амінокислоти, що є добрим підґрунтям для вивчення теми сьогоднішнього уроку.
Ми продовжуємо вивчати азотовмісні сполуки. Отож, можна констатувати, що ви маєте добрі знання про амінокислоти, що є добрим підґрунтям для вивчення теми сьогоднішнього уроку.
Проте, як говорив великий учений-астроном П’єр Симон Лаплас: «Те, що ми знаємо – обмежене, а те, чого ми не знаємо – нескінченне». Тому наші знання про нітрогеновмісні органічні сполуки ми будемо доповню вати, вивчаючи білки.
- Характеризувати:
- Склад білків;
- Рівні організації білкової молекули – її первинну, вторинну, третинну та четвертинну структури;
- Фізичні та хімічні властивості білків;
- Навчитеся:
- Розпізнавати білки дослідним шляхом;
- Обґрунтовувати значення та роль білків для живих організмів
- Аналізувати та встановлювати причинно-наслідкові зв’язки між складом, будовою, властивостями та біологічними функціями і застосуванням білків.
ІV.Етап цілереалізації.
1. Поняття про білки, їх структуру.
Назва «білки» походить від відомого з давніх давен яєчного білка (лат. Albumen - білий), який внаслідок нагрівання перетворюється на білу нерозчинну масу. (Слайд 4)
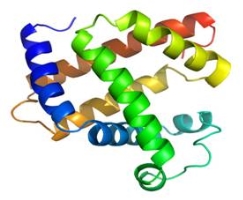 Білки — природні полімери. Мономерами білків є амінокислоти. Відомо всього 20 основних амінокислот. Відомо біля 5 млн. типів білкових молекул. Нескінченна різноманітність білкових молекул забезпечується різними комбінаціями залишків 20 амінокислот (2 · 1018).
Білки — природні полімери. Мономерами білків є амінокислоти. Відомо всього 20 основних амінокислот. Відомо біля 5 млн. типів білкових молекул. Нескінченна різноманітність білкових молекул забезпечується різними комбінаціями залишків 20 амінокислот (2 · 1018).
Формальне утворення білкової макромолекули можна представити як реакцію поліконденсації α-амінокислот:
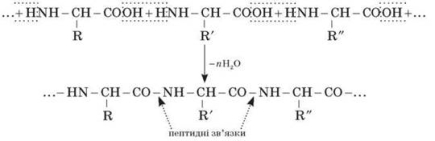
Під час взаємодії двох молекул а-амінокислот відбувається реакція між аміногрупою однієї молекули й карбоксильною групою — іншої. Це приводить до утворення дипептиду, наприклад:
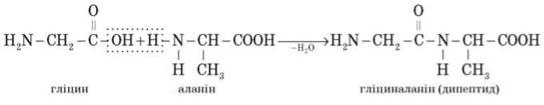
Слід відзначити, що в штучних умовах (поза організмом) дві різні амінокислоти можуть утворити чотири ізомерні дипептиди (у цьому випадку — гліцилаланін, аланілгліцин, аланілаланін і гліцилгліцин).
З трьох молекул а-амінокислот (гліцин + аланін + гліцин) можна одержати трипептид:
![]()
Гліцилаланілгліцин
Аналогічно відбувається утворення тетра-, пента- й поліпептидів.
Молекулярні маси різних білків (поліпептидів) становлять від 10 тисяч до кількох мільйонів. Макромолекули білків мають стереорегулярну будову, винятково важливу для прояву ними певних біологічних властивостей. Незважаючи на численність білків, до їхнього складу входять залишки лише двадцяти α-амінокислот.
Відомо чотири рівні структурної організації білків: первинна, вторинна, третинна і четвертинна. Розглянемо їх докладніше.(Слайд 5)
Первинна структура – це послідовність амінокислотних залишків у поліпептидному ланцюгу. Різноманітність білкових молекул зумовлена різними комбінаціями залишків лише 20 ά-амінокислот. Їх кількість у молекулах окремих білків коливається у великих межах. Приміром в інсуліні їх 51, у міоглобіні – близько 140. Тому й відносна молекулярна маса білків різноманітна. Наприклад, в інсуліні вона становить близько 6500, а в білка вірусу грипу – 320 000 000.
Таким чином первинна структура білка виникає внаслідок утворення пептидних зв’язків між амінокислотними залишками, а певна послідовність амінокислот зумовлює специфічні функції білка в організмі.
Вторинна структура характеризує просторове розміщення молекули білка
внаслідок утворення водневих зв’язків між групами N-Н і С=О. Якщо полярні групи фрагментів первинної структури віддалені одна від одної, то при цьому утворюються складчасті шари з кількох зигзагуватих поліпептидних ланцюгів. Якщо ж полярні групи фрагментів первинної структури розташовані близько, то утворюється так звана α-спіраль. Один виток якої містить чотири амінокислотні залишки.
Третинна структура зумовлена здатністю поліпептидної спіралі закручуватись певним чином утворюючи грудку, або глобулу (кульку). Така структура підтримується ковалентними зв’язками, що виникають між функціональними групами різної хімічної природи.
Четвертинна структура білків виникає внаслідок об’єднання окремих глобул,
Які разом утворюють функціональну одиницю. Наприклад: четвертинна структура гемоглобіну складається з чотирьох макромолекул. Вони утворюють надмолекулярну структуру сферичної форми.
- Функції білків.
Одна з основних функцій – будівельна, або структурна. Це означає, що білки є основою, складовою частиною клітинних мембран, вони є основою всіх клітинних структур. З білків складається вся сполучна тканина організмів. Компонентом хрящів і сухожиль є білок колаген, а пружності кісткам надає білок осеїн. (Слайд 6)
Друга функція – захисна. Вона полягає в тому, що білки крові (антитіла, інтерферон, імуноглобулін) знешкоджують мікроорганізми та отруйні речовини, які попадають в організм. А такі білки крові як фібрин, тромбін беруть участь у зсіданні крові, запобігаючи великим втратам крові при кровотечах: (Слайд 7)
- Кровотеча почалася – ти не панікуй.
Білки крові – фібрин та тромбін рану залікують.
Щоб старанно лікувати
Кровотечні рани,
Треба правила всі знати,
Добре біологію вивчати.
Важлива функція білків – транспортна. У крові є білок – пігмент гемоглобін, який містить елемент залізо (ферум) і забезпечує перенесення кисню, тобто, забезпечує газообмін у клітинах і тканинах організму. (Слайд 8)
- Всі тварини мають кров.
І людей таких немає,
Щоб без крові існували.
Гемоглобін – важливий показник
Знають це усюди.
Якби взагалі він зник
Згинули б всі люди.
В крові є гемоглобін
Це білок важливий
Транспортує кисень він
По усіх судинах!
 Скоротлива або рухова функція білків дає змогу клітинам, тканинам і всьому організмові – рухатись. Скоротливі білки – актин і міозин, що входять до складу м’язів, забезпечують скорочення м’язів. Людина повинна рухатись, працювати, займатися фізкультурою, спортом, щоб бути бадьорими, мати міцне здоров’я і витривалі м’язи.(Слайд 9)
Скоротлива або рухова функція білків дає змогу клітинам, тканинам і всьому організмові – рухатись. Скоротливі білки – актин і міозин, що входять до складу м’язів, забезпечують скорочення м’язів. Людина повинна рухатись, працювати, займатися фізкультурою, спортом, щоб бути бадьорими, мати міцне здоров’я і витривалі м’язи.(Слайд 9)
Сигнальна функція білків полягає в тому, що є білки, які змінюють свою структуру, передаючи сигнали із зовнішнього середовища іншим клітинам, органам, які відповідають на подразнення. Цю функцію виконують білки нервової системи.(Слайд 10)
Запасаюча функція – це відкладання білків у запас. Наприклад, птахи несуть яйця, в яких є білок овальбумін. Його споживає пташеня перед вилупленням із яйця. (Слайд 11).
В ендоспермі насіння багатьох рослин є білки, які споживають зародки під час проростання. Це живильна функція білків. (Слайд 12)
Енергетична функція білків полягає в тому, що при розщепленні білків вивільняється енергія. Ось тому після споживання їжі нам стає трохи тепліше.(Слайд 13)
Особливо важливою функцією білків є регуляторна функція. Є білки – гормони, їх є в малій кількості, але без них неможливе нормальне існування організмів. Наприклад, в людей є підшлункова залоза, яка виробляє інсулін. Це перший білок, будову якого було повністю розшифровано. На це пішло 20 років складних досліджень. І за це відкриття канадському лікареві – хірургу Ботнінгу та керівнику досліджень Маклеоду за дослідження інсуліну в 1923 році присуджено Нобелівську премію. Інсулін реагує стан цукру в крові. Від інсуліну залежить життя людей, хворих на цукровий діабет. Український вчений – ендокринолог (1889 – 1958) Коган поклав початок виробництву інсуліну в Україні.(Слайд 14)
3. Фізичні властивості білків. (Слайд 15)
Розчинні ← Розчинність у воді→ Нерозчинні
↓ ↓
Глобулярні білки ← Будова → Фібрилярні білки
.
Ферменти. ← Наприклад → М’язових тканин.
Антитіла. Шкірних покривів.
Гормони. Волосся.
Альбуміни, що містяться: Рогових покривів.
в яєчному жовтку, Вовни.
в сироватці крові, П’іря
в молоці,
в насінні рослин.
4. Хімічні властивості білків. (Слайд 16)
Основна властивість білків – це їхня здатність під впливом різних факторів змінювати свою структуру і властивості - осадження і денатурація.
Осадження білків – це руйнування гідратної оболонки під дією солей лужних і лужноземельних металів (NaCl, MqSO4). При цьому утворюється осад, який знову можна розчинити у воді. Осадження білків спиртом оборотне, якщо процес відбувався без нагрівання й вплив реагента був короткочасним.
Денатурація білків (лат.- втрата природних властивостей) пов’язана з глибокими змінами в будові молекули, руйнуванням четвертинної, третинної, і вторинної структур. Це приводить до втрати розчинності та біологічної активності білка.
Проте на початкових стадіях денатурації за умови припинення дії факторів, що спричиняють цей процес, білок може відновити свій початковий стан. Це явище називається ренатурація (лат. - поновлення природних властивостей). Хімічні опіки шкіри і слизових оболонок також зумовлені денатурацією білків під впливом їдких речовин лугів, кислот. Термічні опіки – це приклади денатурації білків за високої температури. При цьому відбувається повне руйнування білкових молекул і виділення летких продуктів, що мають запах паленого пір’я. Цією властивістю користуються для розпізнавання білків, встановлення волокон білкового походження таких як вовна, натуральний шовк.
Денатурацію білків застосовують для лікування під час отруєння важкими металами Купрум, Плюмбум тощо. Хворому дають молоко, або сирі яйця. Токсичні сполуки денатурують білки молока або яєць й поглинаються їхньою поверхнею. Денатурація має місце під час кулінарної обробки м’яса, риби, яєць.
(Слайд 17).
|
Чинники, які зумовлюють денатурацію білків |
|
|
Хімічні |
Фізичні |
|
|
Важливою хімічною властивістю білків є їх гідроліз – розщеплення полімерної білкової молекули на амінокислоти під дією кислот, лугів або ферментів.
Приміром, у сильно кислому середовищі шлунка спочатку відбувається. денатурація білків. Потім, під дією ферментів білки розщеплюються (гідролізуються) до амінокислот. Так відбувається перетравлювання їжі.
Амінокислоти, добре розчиняючись у водному середовищі, проникають у кров і надходять до всіх тканин і клітин організму. Тут найбільше амінокислот витрачається на синтез білків різних органів і тканин, частина – на синтез гормонів, ферментів та інших біологічно активних речовин, а решта витрачається як енергетичний матеріал. Білки є основним будівельним матеріалом тваринних організмів та організму людини.
Білки можуть розкладатися під дією мікроорганізмів. У результаті утворюються не амінокислоти, а аміак, сірководень, фенол та інші речовини з неприємним запахом. Його поява свідчить про те, що відбувається процес розкладу, тобто гниття білка. Неприємний запах мають протухше яйце, зіпсоване м'ясо чи риба.
Горіння білків.Пригадайте запах паленого пір’я або присмаленого волосся. Це запах білка кератину, який є складі пір’я та волосся.
Демонстрація « Розчинення й осадження білків».
1) Яєчний білок поміщаємо в хімічну склянку, додаємо води у співвідношенні 1:1, розмішуємо. Що спостерігаємо? Зробіть висновок про розчинність білка.
2) Наливаємо 1-2 мл одержаного розчину в пробірку. Дотримуючись правил техніки безпеки, нагріваємо до згортання білка.
3) Наливаємо 1-2 мл розчину білка в пробірку, доливаємо 1-2 мл спирту (98 %). Що спостерігаємо?
Очікувані висновки
Курячий білок добре розчиняється у воді.
Спостерігаємо утворення осаду. Внаслідок дії спирту руйнується гідратна оболонка білка й утворюється осад, який знову можна розчинити у воді. За такого осадження і розчинення властивості білків відновлюються, вони не втрачають ферментативної активності. За умови, що дія спирту буде короткочасною.
Демонстрація « Денатурація білків»
Денатурація білків при дії високих температури.
Дослід 1.. Наливаємо 1-2 мл одержаного розчину білка в пробірку, дотримуючись правил техніки безпеки, нагріваємо. Що спостерігаємо? Що відбувається з білком?
Очікувані висновки
Спостерігаємо, що під дією температури білок згортається, тобто відбувається денатурація. Вона пов’язана з глибокими внутрішньо молекулярними змінами його будови, руйнуванням четвертинної, третинної і вторинної структур. Це призводить до втрати білком розчинності і біологічної активності.
Денатурація білків при дії розчинів солей важких металів.
Дослід 1. До розчину білка додайте декілька крапель розчину купрум(ІІ) сульфату СuSO4. Що спостерігаєте? Що відбувається з білком?
Очікувані висновки
Спостерігаємо утворення осаду. Відбувається денатурація білка. Руйнується четвертинна, третинна і вторинна структури. Це призводить до втрати білком розчинності та біологічної активності.
Кольорові реакції на білки.
Робота № 1. Ксантопротеїнова реакція на білки
Хід роботи: до 1мл білка додати 5-6 крапель конц. HNO3, до появи білого осаду, або каламуті, потім осад нагріти до появи яскраво-жовтого кольору. Суміш охолодити й обережно додати конц. NaOH до розчинення осаду.
Висновок: ксантопротеїнова реакція є кольоровою якісною реакцією на білки. Це відбувається тому, що бензольне кільце нітрується.
Робота № 2. Біуретова реакція
Хід роботи: до 2мл розчину білка додати такий самий об’єм 10% розчину NaOH. До суміші прилит 2-3 краплі розчину CuSO4, забарвлення розчину змінюється на фіолетове.
Висновок: тому що утворюється комплексна сіль Купрума з допмогою пептидних зв’язків білка. У 80-х роках 19 ст. російський учений О. Данилевський указав на наявність пептидних груп у білковій молекулі.
Фронтальна бесіда.
- Що таке білки? – Що є мономерами білкових молекул? Яка будова амінокислот?
- Скільки відомо амінокислот?
- Як з’єднуються амінокислоти одна з одною?
- Що таке первинна (вторинна, третинна, четвертинна) структура білка?
- Що таке „денатурація”, „деструкція”?
- Перелічити функції білків.
V. Рефлексивно-оцінювальний етап.
Рефлексія.
(На якому рівні засвоїли матеріал)
Кльорові смужки паперу:
- червоний-дуже гарно засвоїли матеріал;
- зелений- треба дома попрацювати;
- жовтий - нічого з уроку для себе не взяв.
VІ. Етап повідомлення домашнього завдання.
Опрацювати §, підготувати кросворд до теми.(Слайд 18)

про публікацію авторської розробки
Додати розробку
