Дата ___/____/____ Клас _________ Прізвище вчителя __________________________ Урок № 24 Добування кисню в лабораторних умовах та в промисловості. Реакції розкладу. Поняття про к
Дата ___/____/____ Клас _________ Прізвище вчителя __________________________
Урок № 24
Добування кисню в лабораторних умовах та в промисловості.
Реакції розкладу. Поняття про каталізатор
Мета уроку: ознайомити учнів зі способами добування кисню в лабораторних умовах та в промисловості; сформувати уявлення про реакції розкладу та каталізатори на прикладі способів добування кисню; поглибити знання учнів про кисень як просту речовину, його фізичні властивості.
Очікувані результати: учні мають уміти описувати способи добування кисню в промисловості та лабораторії; розпізнавати реакції розкладу; усвідомити роль каталізаторів у хімічних реакціях.
Базові поняття й терміни: Оксиген, кисень, прості й складі речовини, хімічна реакція, хімічне рівняння, реакції розкладу, каталізатор.
Обладнання: _______________________________________________________________
Тип уроку: комбінований.
1. Організаційний етап
1.1. Привітання.
1.2. Перевірка присутності учнів: кількість за списком _________,
кількість присутніх на уроці ___________, відсутніх ___________.
1.3. Перевірка готовності учнів до уроку.
2. Етап перевірки домашнього завдання
2.1. Перевірка наявності в учнів виконаних письмових робіт. Обговорення питань, які виявилися найбільш складними.
2.2. Прийом «Незакінчені речення».
Учні мають закінчити речення, вставивши слова Оксиген та кисень відповідно до контексту.
1. Оксиген — найпоширеніший на Землі хімічний елемент.
2. Молекула простої речовини кисень утворена двома атомами Оксигену.
3. У повітрі міститься 21 % кисню.
4. Вода складається з двох атомів Гідрогену й одного атома Оксигену.
5. Риби дихають киснем, розчиненим у воді.
6. У ґрунті знаходяться сполуки, які містять Оксиген.
7. Ми відкриваємо кватирки в кабінеті, щоб збагатити повітря киснем.
8. Оксиген входить до складу життєво важливих органічних сполук — білків, жирів, вуглеводів.
2.3. Бліцконтроль.
Учитель зачитує запитання, а учні записують відповіді на них. Один учень працює біля дошки.
1. Який хімічний елемент є найпоширенішим у природі? (Оксиген.)
2. Хто вперше припустив, що атмосферне повітря складається з «вогненного» і «зіпсованого»? (К. Шеєле.)
3. Як називали теорію про склад повітря до відкриття кисню? (Теорія флогістону.)
4. Хто вперше вивчив властивості кисню й дав йому назву як хімічному елементу? (А. Л. Лавуазьє.)
5. Чому дорівнює відносна атомна маса Оксигену? (16.)
6. Чому дорівнює відносна молекулярна маса кисню? (32.)
7. Чому дорівнює валентність кисню? (ІІ.)
8. Яким є агрегатний стан кисню за нормальних умов? (Рідким.)
9. З чого складається повітря? (Азот, кисень, вуглекислий та інші гази.)
10. У якій групі та в якому періоді розташовано Оксиген ? (VІ група, 2 період.)
11. Як називається проста речовина, яка складається з трьох атомів Оксигену? (Озон.)
12. Який колір має кисень за температури –200 ºС? (Синій.)
Учні обмінюються зошитами. Учитель зачитує відповіді, а діти перевіряють їх на дошці і в зошитах.
2.4. Письмова самостійна робота.
І варіант
- Закінчіть речення.
Каталізатори — це речовини, які ____________________________________________
_____________________________________________________________________________.
- Закінчіть речення.
Фізичні властивості кисню: газ, без кольору __________________________________
_____________________________________________________________________________.
- Позначте за допомогою символів:
а) 5 атомів Оксигену;
б) 3 молекули кисню;
в) 2 молекули озону.
Відповідь: а) 5О; б) 3О2; в) 2О3.
- Складіть формули сполук Оксигену за вказаними валентностями елементів:
![]() ;
; ![]() ;
; ![]() ;
; ![]() ; BO.
; BO.
Відповідь: Cl2O, As2O3, SeO2, I2O7, B2O3.
- Закінчіть схеми реакцій добування кисню й розставте коефіцієнти:
1) 2KNO3 = 2KNO2 + O2↑;
2) 2Ag2O = 4Ag + O2↑;
3) 2N2O5 → 4NO2 + O2↑.
- Визначте масову частку Оксигену:
а) у вуглекислому газі;
б) у метанолі СН3ОН.
Відповідь: а) w(O) = 0,73, або 73 %; б) w(O) = 0,5, або 50 %.
ІІ варіант
- Закінчіть речення.
Реакції розкладу — це хімічні реакції, у результаті яких із ______________________
_____________________________________________________________________________.
- Закінчіть речення.
Основне природне джерело кисню — ________________________________________
_____________________________________________________________________________.
- Укажіть, що означають записи:
а) 4О2;
б) 3О;
в) 7СО2.
Відповідь: а) 4 молекули кисню; б) 3 атоми Оксигену; в) 7 молекул вуглекислого газу.
- Складіть формули сполук Оксигену за вказаними валентностями елементів:
![]() ;
; ![]() ;
; ![]() ;
; ![]() ;
; ![]()
Відповідь: P2O5, Br2O7, SO2, As2O5, XeO4.
- Закінчіть схеми реакцій добування кисню й розставте коефіцієнти:
1) 2KClO3 = 2KNO2 + O2↑;
2) 2H2O = 2H2 + O2↑;
3) 2KMnO4 = K2MnO4 + MnO2 + O2↑.
- Визначте масову частку Оксигену:
а) у чадному газі СО;
б) у сірчистому газі SO2.
Відповідь: а) w(O) = 0,89, або 89 %; б) w(O) = 0,5, або 50 %.
3. Актуалізація опорних знань і мотивація навчальної діяльності
3.1. Показ практичного значення вивчення нового матеріалу.
Завдання на ерудицію.
3.2. Бесіда.
1. Чому часто говорять, що кисень було відкрито тричі?
2. Хто з науковців довів, що кисень — проста речовина?
3. Спробуйте припустити, з яких речовин можна отримати кисень — простих чи складних?
4. Що може об’єднувати ці речовини?
3.3. Повідомлення теми уроку.
3.4. Формулювання разом з учнями мети й завдань уроку.
4. Етап засвоєння нових знань
План пояснення нового матеріалу
- Добування кисню в природі. (Евристична бесіда.)
Використовуючи кисень із повітря для дихання, ми автоматично зменшуємо його кількість. Але вміст кисню в повітрі лишається сталим — 21 %. Тож як підтримується необхідний нам сталий вміст кисню в атмосфері? Як добувають кисень у природі?
Англійський учений Дж. Прістлі в 1774 р. провів дослід: під ковпак помістив мишу й поклав гілочку м’яти. Миша продовжувала жити, незважаючи на те, що повітря під ковпак не надходило. Дж. Прістлі дійшов висновку, що зелені рослини «покращують» повітря, зіпсоване диханням і горінням, роблячи його придатним для життя.
Рослини, поглинаючи атмосферний кисень під час дихання, паралельно активно виробляють його в процесі фотосинтезу:
6СО2 + 6Н2О = С6Н12О6 + 6О2.
Висновок: у природі кисень виробляється в хлоропластах рослин під час фотосинтезу з вуглекислого газу й води під дією світла.
Запитання для бесіди
1. Згадайте з курсу природознавства, який процес називають фотосинтезом.
2. Які живі організми здатні до фотосинтезу?
3. Назвіть умови, необхідні для перебігу фотосинтезу.
4. Чому зелені рослини називають «легенями Землі»?
- Добування кисню в промисловості. (Розповідь учителя.)
- Кисень необхідний не тільки в природі. У промисловості його використовують для отримання металів та інших необхідних речовин. Для цього кисень потрібний у великих кількостях. Способи отримання, які використовуються при цьому, називаються промисловими.
- У промисловості кисень отримують із рідкого повітря. Спочатку повітря стискають потужними компресорами. При цьому він, як і будь-який газ за стискання, сильно нагрівається. Якщо вам доводилося енергійно накачувати велосипедну камеру, ви маєте пам’ятати, що корпус насоса й шланг нагріваються досить відчутно.
- Стиснуте повітря у великих балонах охолоджується. Якщо газ стиснули дуже сильно, його подальше розширення може призвести до такого сильного охолодження, що частина повітря зріджується. Рідке повітря збирають у спеціальні ємності, які називаються посудинами Дюара й за будовою нагадують звичайний термос. Посудина Дюара має дві стінки, з простору між якими відпомповано повітря. За рахунок цього посудина практично не пропускає теплоти, тож у ній можна досить довго зберігати зріджений газ за низької температури.
- Як ви вже знаєте, рідкий кисень кипить за більш «високої» температури (–183 °С), ніж рідкий азот (–196 °С). Тому за «нагрівання» рідкого повітря, коли температура цієї дуже холодної рідини повільно підвищується від –200° до –180 °С, насамперед за –196 °С переганяють азот (який знову зріджують), а вже потім — кисень. Якщо таку перегонку рідких азоту й кисню виконувати неодноразово, можна отримати досить чистий кисень. Зазвичай його зберігають стиснутим у сталевих балонах, пофарбованих у блакитний колір. Характерне блакитне забарвлення балонів потрібне для того, щоб не сплутати кисень із яким-небудь іншим стисненим газом.
3. Добування кисню в лабораторних умовах. (Розповідь учителя з демонструванням дослідів.)
Демонстрації
— Добування кисню з калій перманганату.
— Добування кисню з гідроген пероксиду.
— Добування кисню витисненням води.
— Виявлення наявності кисню.
Апаратура для промислового одержання кисню дуже складна й енергоємна. У лабораторії кисень найпростіше отримувати з оксигеновмісних сполук.
Уперше кисень було добуто, як ви вже знаєте, нагріванням меркурій(ІІ) оксиду за допомогою сфокусованого сонячного проміння (метод Дж. Прістлі):
2HgO = 2Hg + O2.
Найчастіше кисень отримують нагріванням таких оксигеновмісних речовин, як калій перманганат (марганцівка, KMnO4), калій хлорат (бертолетова сіль, KClO3), калій нітрат (індійська, або чилійська, селітра, KNO3), гідроген пероксид Н2О2, до складу яких Оксиген входить у зв’язаному вигляді:
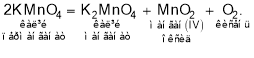
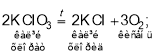
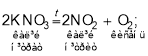
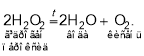
Цікавим є спосіб отримання кисню з пероксидів металів, який раніше застосовували на підводних човнах, оскільки в цій реакції одночасно з виділенням кисню відбувається поглинання вуглекислого газу:

На сучасних атомних підводних човнах, де є потужне й майже невичерпне джерело електричної енергії, є можливість отримувати кисень розкладанням води під дією електричного струму (електроліз води):
![]()
4. Поняття про каталізатор. (Розповідь учителя.)
Гідроген пероксид зазвичай використовують у вигляді 3-відсоткового водного розчину. Багато хто з вас знайомий із ним, тому що цей розчин застосовують як дезінфікувальний засіб для обробки подряпин і неглибоких ран. Він нестійкий і повільно розкладається на кисень і воду вже в пляшечці. Потрапивши на подряпину або ранку, пероксид починає виділяти кисень набагато інтенсивніше (сильно пузириться, шипить). Справа в тому, що кров містить особливі речовини (каталізатори), які прискорюють реакцію розкладу гідроген пероксиду.
Каталізатори — це речовини, здатні прискорювати хімічні перетворення, залишаючись при цьому незмінними. Каталітична реакція — це хімічна реакція, яка відбувається за участю каталізатора.
Каталізаторами розкладу Н2О2 можуть служити багато речовин, зокрема й неорганічні: манган(ІV) оксид (MnO2), деревне вугілля (вуглець), залізний порошок. Існують також «антикаталізатори» — речовини, які уповільнюють хімічні перетворення. Такі сповільнювачі хімічних реакцій називаються інгібіторами. Наприклад, фосфатна кислота (Н3РО4) перешкоджає розкладанню гідроген пероксиду.
Для того щоб зрозуміти, як працює каталізатор, учитель пропонує учням ознайомитися з арабською притчею, яку в 1941 р. біохімік К. Ліндерстрем-Ланг розповів королю Данії Християнові Х на церемонії вручення найпочеснішої наукової нагороди цієї країни.
Помирав старий араб. Усе його багатство складалося з 17 прекрасних білих верблюдів. Перед смертю він зібрав своїх синів й оголосив їм останню волю: «Мій старший син, опора сім’ї, повинен отримати після моєї смерті половину всіх верблюдів, середньому синові я залишаю третину, а молодшому — дев’яту частину стада». Сказав так і помер. А брати, поховавши батька, почали ділити стадо. Але 17 не ділиться ні на 2, ні на 3, ні на 9. Допоміг їм старий мудрець. «Виконати волю батька дуже просто,— сказав він.— Я дарую вам свого старого чорного верблюда, а ви спробуйте розділити стадо». У братів тепер було 18 верблюдів. Старший син отримав 9, середній — 6, а молодший — 2 з них. Однак, 9 + 6 + 2 = 17, чорний верблюд виявився зайвим. Саме цей чорний верблюд подібний до каталізатора: він зробив можливим процес, який без нього був немислимим, не зазнавши при цьому змін.
Каталізатори відіграють важливу роль у житті людини: усі процеси у живих організмах відбуваються за наявності каталізаторів (ферментів), майже всі хімічні виробництва існують завдяки участі каталізаторів у різноманітних хімічних реакціях.
5. Реакції розкладу. (Евристична бесіда.)
Хімічні реакції, під час яких з однієї речовини утворюються дві або більше інших, називаються реакціями розкладу.
У результаті реакцій розкладу з молекули складної речовини утворюється кілька простих або складних речовин:
А → В + С +...
Запитання для бесіди
1. Що називають хімічними реакціями?
2. Дайте визначення реагенту.
3. Що таке продукти реакції?
5. Узагальнення й систематизація знань
5.1. Завдання на закріплення матеріалу.
1. Для добування кисню в лабораторії учням надано речовини: а) KClO3; б) H2O2; в) KMnO4; г) MnO2. Яку з них учні мають використати як каталізатор? Запишіть рівняння реакцій розкладу для цих речовин.
Відповідь: а) 2KClO3 → 2KCl + 3O2; б) 2H2O2 → 2H2O + O2;
в) 2KMnO4 → K2MnO4 + MnO2 + O2; г) каталізатор.
2. Складіть рівняння реакції розкладу калій нітрату (KNO3), якщо відомо, що продуктами реакції є калій нітрит (KNO2)
і кисень. Порівняйте вміст (масові частки) Оксигену у вихідній речовині та продукті реакції.
Відповідь: 2KNO3 → 2KNO2 + O2; w(O) = 47,5 %; w(O) = 38 %.
5.2. Прийом «Склади слово».
На столах в учнів лежать завдання — 11 запитань.
Завдання для учнів: одним словом дати відповіді на ці запитання, потім із кожного слова взяти першу літеру й виписати їх навпроти запитань в окремий стовпчик.
Якщо відповіді правильні, з отриманих літер складеться ключове слово.
|
№ з/п |
Запитання |
Перші букви ключових слів |
|
1 |
Яка проста газоподібна речовина має молекулярну масу 32? (Кисень.) |
К |
|
2 |
Назвіть ім’я Лавуазьє. (Антуан.) |
А |
|
3 |
Який фізичний параметр необхідний для розкладання KMnО4? (Температура.) |
Т |
|
4 |
Як називаються частинки, що утворюють молекулу кисню? (Атоми.) |
А |
|
5 |
Де можна отримати кисень, окрім промислових виробництв? (Лабораторія.) |
Л |
|
6 |
Як називаються речовини, що уповільнюють перебіг хімічних реакцій? (Інгібітори.) |
І |
|
7 |
Яку фізичну властивість має озон на відміну від кисню? (Запах.) |
З |
|
8 |
Якого газу в повітрі найбільше? (Азоту.) |
А |
|
9 |
Яку скіпку використовують для визначення наявності кисню? (Тліючу.) |
Т |
|
10 |
Як називається хімічний елемент з атомною масою 16? (Оксиген.) |
О |
|
11 |
Який тип реакції необхідний для отримання кисню з гідроген пероксиду, калій перманганату й води? (Розкладу.) |
Р |
5.3. Тестова робота.
Завдання 1–5 мають по чотири варіанти відповіді. У кожному завданні лише одна відповідь правильна.
І варіант
1. Щоб довести наявність в посудині кисню, а не повітря, слід скористатися:
А різницею в густині повітря й кисню;
Б подібністю кольорів обох газів;
В тліючою скіпкою;
Г різницею в ступені розчинності у воді двох газів.
2. Уперше про відкриття кисню повідомив:
A К. Шеєле;
Б Дж. Прістлі;
B А. Лавуазьє;
Г М. Ломоносов.
3. Укажіть фізичну властивість кисню:
А газ із різким запахом;
Б тверда речовина;
В важчий за повітря;
Г газ жовто-зеленого кольору.
4. Для добування кисню в лабораторії не використовують речовину, формула якої:
А H2O;
Б KMnO4;
В H2O2;
Г Fe3O4.
5. Укажіть необхідні дії, якщо пролилася ртуть:
А залишити випаровуватися;
Б засипати подрібненою сіркою й видалити через деякий час;
В акуратно зібрати й викинути до сміттєвого баку;
Г зібрати й вилити до раковини.
ІІ варіант
1. Укажіть найбільш поширений у літосфері хімічний елемент:
А Ферум;
Б Оксиген;
В Силіцій;
Г Алюміній.
2. Кисень уперше було відкрито шляхом:
А нагрівання бертолетової солі;
Б розкладання води електричним струмом;
В розкладання калій перманганату;
Г розкладання меркурій(II) оксиду під час нагрівання.
3. У якому столітті було відкрито кисень?
А XVII;
Б XVI;
В XVIII;
Г XIX.
4. У лабораторії кисень можна зібрати:
А витісненням води й повітря в пробірку, розташовану отвором униз;
Б над водою й витісненням повітря в пробірку, розташовану дном униз;
В тільки витісненням води;
Г тільки витісненням повітря в пробірку, розташовану дном униз.
5. Чому в історію дослідження кисню як першовідкривач увійшов Дж. Прістлі, а не К. Шеєле?
A Він першим в історії хімії відкрив кисень;
Б він першим опублікував свою роботу з отримання кисню;
B він першим провів біологічні досліди з киснем;
Г він першим довів, що кисень є складовою повітря.
Відповіді
І варіант
1. В.
2. Б.
3. В.
4. Г.
5. Б.
ІІ варіант
1. Б.
2. Г.
3. В.
4. А.
5. Б.
6. Домашнє завдання, інструктаж щодо його виконання
6.1. Завдання для всього класу.
Підручник _____________________________________________
Збірник завдань ________________________________________
6.2. Індивідуальне завдання.
7. Підбиття підсумків уроку
Учитель пропонує учням висловитися щодо досягнення мети уроку.
І варіант
- Закінчіть речення.
Каталізатори — це речовини, які ____________________________________________
_____________________________________________________________________________.
- Закінчіть речення.
Фізичні властивості кисню: газ, без кольору __________________________________
_____________________________________________________________________________.
- Позначте за допомогою символів:
а) 5 атомів Оксигену;
б) 3 молекули кисню;
в) 2 молекули озону.
- Складіть формули сполук Оксигену за вказаними валентностями елементів:
![]() ;
; ![]() ;
; ![]() ;
; ![]() ; BO.
; BO.
- Закінчіть схеми реакцій добування кисню й розставте коефіцієнти:
________ = KNO2 + O2 ↑;
Ag2O = ________ + O2↑;
- N2O5 → NO2 + ________ ↑.
- Визначте масову частку Оксигену:
а) у вуглекислому газі;
б) у метанолі СН3ОН.
ІІ варіант
- Закінчіть речення.
Реакції розкладу — це хімічні реакції, у результаті яких із ______________________
_____________________________________________________________________________.
- Закінчіть речення.
Основне природне джерело кисню — ________________________________________
_____________________________________________________________________________.
- Укажіть, що означають записи:
а) 4О2;
б) 3О;
в) 7СО2.
- Складіть формули сполук Оксигену за вказаними валентностями елементів:
![]() ;
; ![]() ;
; ![]() ;
; ![]() ;
; ![]()
- Закінчіть схеми реакцій добування кисню й розставте коефіцієнти:
KClO3 = ________ + O2 ↑;
________ = H2 + O2 ↑;
KMnO4 = K2MnO4 + MnO2 + ________ ↑.
- Визначте масову частку Оксигену:
а) у чадному газі СО;
б) у сірчистому газі SO2.
|
№ з/п |
Запитання |
Перші букви ключових слів |
|
1 |
Яка проста газоподібна речовина має молекулярну масу 32? (Кисень.) |
|
|
2 |
Назвіть ім’я Лавуазьє. (Антуан.) |
|
|
3 |
Який фізичний параметр необхідний для розкладання KMnО4? (Температура.) |
|
|
4 |
Як називаються частинки, що утворюють молекулу кисню? (Атоми.) |
|
|
5 |
Де можна отримати кисень, окрім промислових виробництв? (Лабораторія.) |
|
|
6 |
Як називаються речовини, що уповільнюють перебіг хімічних реакцій? (Інгібітори.) |
|
|
7 |
Яку фізичну властивість має озон на відміну від кисню? (Запах.) |
|
|
8 |
Якого газу в повітрі найбільше? (Азоту.) |
|
|
9 |
Яку скіпку використовують для визначення наявності кисню? (Тліючу.) |
|
|
10 |
Як називається хімічний елемент з атомною масою 16? (Оксиген.) |
|
|
11 |
Який тип реакції необхідний для отримання кисню з гідроген пероксиду, калій перманганату й води? (Розкладу.) |
|
Тестова робота
Завдання 1–5 мають по чотири варіанти відповіді. У кожному завданні лише одна відповідь правильна.
І варіант
1. Щоб довести наявність в посудині кисню, а не повітря, слід скористатися:
А різницею в густині повітря й кисню;
Б подібністю кольорів обох газів;
В тліючою скіпкою;
Г різницею в ступені розчинності у воді двох газів.
2. Уперше про відкриття кисню повідомив:
A К. Шеєле;
Б Дж. Прістлі;
B А. Лавуазьє;
Г М. Ломоносов.
3. Укажіть фізичну властивість кисню:
А газ із різким запахом;
Б тверда речовина;
В важчий за повітря;
Г газ жовто-зеленого кольору.
4. Для добування кисню в лабораторії не використовують речовину, формула якої:
А H2O;
Б KMnO4;
В H2O2;
Г Fe3O4.
5. Укажіть необхідні дії, якщо пролилася ртуть:
А залишити випаровуватися;
Б засипати подрібненою сіркою й видалити через деякий час;
В акуратно зібрати й викинути до сміттєвого баку;
Г зібрати й вилити до раковини.
ІІ варіант
1. Укажіть найбільш поширений у літосфері хімічний елемент:
А Ферум;
Б Оксиген;
В Силіцій;
Г Алюміній.
2. Кисень уперше було відкрито шляхом:
А нагрівання бертолетової солі;
Б розкладання води електричним струмом;
В розкладання калій перманганату;
Г розкладання меркурій(II) оксиду під час нагрівання.
3. У якому столітті було відкрито кисень?
А XVII;
Б XVI;
В XVIII;
Г XIX.
4. У лабораторії кисень можна зібрати:
А витісненням води й повітря в пробірку, розташовану отвором униз;
Б над водою й витісненням повітря в пробірку, розташовану дном униз;
В тільки витісненням води;
Г тільки витісненням повітря в пробірку, розташовану дном униз.
5. Чому в історію дослідження кисню як першовідкривач увійшов Дж. Прістлі, а не К. Шеєле?
A Він першим в історії хімії відкрив кисень;
Б він першим опублікував свою роботу з отримання кисню;
B він першим провів біологічні досліди з киснем;
Г він першим довів, що кисень є складовою повітря.


про публікацію авторської розробки
Додати розробку
