Дидактичний матеріал " Хімія 7 клас"
Посібник містить тестові завдання, які можуть бути використані як з метою перевірки рівня навчальних досягнень учнів, активізації навчальної діяльності учнів 7 класів відповідно до програми з хімії для загальноосвітніх навчальних закладів з відповідних тем, так і з метою самопідготовки учнів.
 НОВОСЕЛІВСЬКИЙ НВК
НОВОСЕЛІВСЬКИЙ НВК

Дидактичні матеріали
(за новим Державним стандартом базової і повної загальної середньої освіти)

Матіїва Наталія Володимирівна вчителька хімії та біології
першої категорії
Автор: Матіїва Наталія Володимирівна
Посада: вчитель хімії та біології
Місце роботи:
Новоселівський НВК «Загальноосвітня школа І-ІІІ ступенів-дитячий садок»
Назва роботи: ХІМІЯ – 7 клас. Дидактичні матеріали.
Анотація: Тестові матеріали відповідають навчальній програмі для 5-9 класів загальноосвітніх навчальних закладів (за новим Державним стандартом базової і повної загальної середньої освіти).
Завдання розроблені для кожної теми, підібрані так, що їх можна застосувати для фронтальної, групової та індивідуальної роботи з учнями.
Для активізації пізнавальної діяльності учнів у посібнику містяться фотозавдання, які включають зображення предмета, явища, формули тощо і запитання до нього.
Посібник містить тестові завдання, які можуть бути використані як з метою перевірки рівня навчальних досягнень учнів, активізації навчальної діяльності учнів 7 класів відповідно до програми з хімії для загальноосвітніх навчальних закладів з відповідних тем, так і з метою самопідготовки учнів.
Зміст
|
Вступ |
|
|
Хімія — природнича наука. Речовини та їх перетворення у навколишньому світі. Короткі відомості з історії хімії…………….. |
5
|
|
Правила поведінки учнів у хімічному кабінеті. Ознайомлення з обладнанням кабінету хімії та лабораторним посудом……………. |
5 |
|
Тема 1 Початкові хімічні поняття |
|
|
Фізичні тіла. Матеріали. Речовини. Молекули. Атоми. Як вивчають речовини. Спостереження й експеримент у хімії………… |
9
|
|
Фiзичні властивості речовин. Чисті речовини і суміші (однорідні, неоднорідні). Способи розділення сумішей…………..…..…………. |
10
|
|
Атом, його склад. Хімічні елементи, їхні назви і символи. Періодична система хімічних елементів Д.І. Менделєєва. Структура періодичної системи………………………………………. |
15
|
|
Маса атома. Атомна одиниця маси. Відносні атомні маси хімічних елементів.Хімічні формули речовин. Прості та складні речовини. Багатоманітність речовин……………………………………………... |
16
|
|
Метали й неметали. Металічні та неметалічні елементи, їх розміщення в періодичній системі………………………………….… |
21
|
|
Валентність хімічних елементів. Складання формул бінарних сполук за валентністю елементів. Визначення валентності елементів за формулами бінарних сполук. Зв'язок між розміщенням елемента у періодичній системі та його валентністю. |
24
|
|
Відносна молекулярна маса, її обчислення за хімічною формулою. |
25
|
|
Масова частка елемента в складній речовині………………………. |
28
|
|
Фізичні та хімічні явища. Хімічні реакції та явища, що їх супроводжують. Хімічні властивості речовин……………………… |
28
|
|
Самостійна робота з теми «Початкові хімічні поняття»……………. |
32 |
|
Тема 2 Кисень |
|
|
Повітря, його склад…………………………………………………….. |
34 |
|
Оксиген. Поширеність Оксигену в природі. Кисень, склад його молекули, поширеність у природі. Фізичні властивості кисню……. |
34 |
|
Закон збереження маси речовин під час хімічних реакцій. Схема хімічної реакції. Хімічні рівняння…………………………………… |
35
|
|
Добування кисню в лабораторії та промисловості. Реакція розкладу. Поняття про каталізатор. Способи збирання кисню. Доведення наявності кисню…………… |
36
|
|
Хімічні властивості кисню: взаємодія з простими речовинами (вуглець, водень, сірка, магній, залізо, мідь). Реакція сполучення… |
37
|
|
Поняття про оксиди, окиснення (горіння, повільне окиснення, дихання)………………………………………………………………… |
38
|
|
Взаємодія кисню зі складними речовинами (повне окиснення метану, гідроген сульфіду, глюкози)…………………………………. |
39
|
|
Умови виникнення та припинення горіння. Маркування небезпечних речовин…………………………………………………. |
40
|
|
Колообіг Оксигену в природі. Озон. Проблема чистого повітря. Застосування та біологічна роль кисню……………………………… |
41
|
|
Самостійна робота з теми «Кисень»………………………………….. |
42 |
|
Тема 3 Вода |
|
|
Вода, склад її молекули, поширеність у природі, фізичні властивості. Вода – розчинник ………………………………………. |
45
|
|
Розчин і його компоненти: розчинник, розчинена речовина……… |
45
|
|
Кількісний склад розчину. Масова частка розчиненої речовини. Виготовлення розчину……………………………………………….. |
46
|
|
Взаємодія води з оксидами. Поняття про гідрати оксидів: кислоти й основи. Поняття про індикатори…………………………………… |
47
|
|
Значення води і водних розчинів у природі та житті людини. Кислотні дощі. Проблема чистої води. Охорона водойм від забруднення. Очищення води на водоочисних станціях та в домашніх умовах………………………………………………………. |
49
|
|
Література……………………………………………………………… |
50 |
Вступ
Хімія — природнича наука. Речовини та їх перетворення у навколишньому світі. Короткі відомості з історії хімії.
Графічний диктант
- Хімія вивчає речовини та їх перетворення.
- Склад та будову речовин вивчає фізика.
- Араби називали хімію – алхімією.
- Хімія приносить людині лише користь.
- Хімія означає – мистецтво виплавляння металів.
- Хімія, як наука виникла в 14 столітті.
- Хімія існує як окрема наука і немає зв’язків з іншими науками.
- Речовини в хімії називають реактивами, реагентами.
- Хімія відноситься до природничих наук.
- Археологічні розкопки свідчать, що ще на світанку розвитку людського суспільства видобували і переробляли руди металів.
Тестові завдання
1. Що вивчає хімія?
а) поширеність і міграцію хімічних елементів на Землі;
б) фізичні тіла та їх властивості;
в) речовини та їх перетворення;
г) хімічний склад і структуру сполук, які містяться в живих організмах.
2. Що вивчає хімія?
а) поведінку атомів і молекул в різних умовах;
б) перетворення різних елементів;
в) речовини і закони їхніх перетворень;
г) перетворення одного фізичного тіла на інше.
3. Яке з тверджень є неправильним:
а) хімія є експериментальною наукою;
б) хімія є галуззю природознавства;
в) хімія є технічною наукою;
г) хімія є точною наукою.
Правила поведінки учнів у хімічному кабінеті. Ознайомлення з обладнанням кабінету хімії та лабораторним посудом.
Графічний диктант
- Відомі речовини, які використовуєте для дослідів можна попробувати на смак.
- Особливо обережним треба бути коли виконуєш досліди з нагрівальними приладами.
- Якщо речовини для досліду взяли забагато, то потрібно зайву відлити назад в посуд для зберігання реактиву.
- Відомі речовини, які використовуєте для дослідів можна попробувати на смак.
- Під час виконання дослідів пробірку тримай завжди горизонтально.
- Під час наливання рідини в пробірку етикетку на склянці спрямовувати в бік до пробірки.
- Щоб пробірка не тріснула під час нагрівання, спочатку її варто прогріти всю.
- Реактиви для дослідів потрібно брати в великих кількостях, щоб був кращий результат.
- Для спалювання речовин в полум’ї спиртівки використовують пробіркотримач.
- На кінчику полум’я міститься найяскравіша частина.
Фотозавдання
|
1.Назвіть обладнання кабінету хімії, яке зображене на малюнках. У яких випадках використовують дане обладнання? |
||
|
|
|
|
|
А |
Б |
В |
|
2.Назвіть хімічний посуд, який зображений. В яких цілях його використовують? |
||
|
|
|
|
|
А |
Б |
В |
|
3.Назвіть хімічний посуд, який зображений. В яких цілях його використовують? |
||
|
|
|
|
|
А |
Б |
В |
|
4.Назвіть хімічний посуд, який зображений. В яких цілях його використовують? |
||
|
|
|
|
|
А |
Б |
В |
|
5.У яких випадках пробірка закріплена відповідно до правил техніки безпеки. Поясніть свій вибір. |
|
|
|
|
|
А |
Б |
|
6.Позначте сладові частини полум`я, штатива та спиртівки позначені на малюнках. |
||
|
|
|
|
|
А |
Б |
В |
Тема 1 Початкові хімічні поняття
Фізичні тіла. Матеріали. Речовини. Молекули. Атоми.
Як вивчають речовини. Спостереження й експеримент у хімії.
Тестові завдання
1. Яке з тверджень є неправильним:
а) молекула – нейтральна частинка;
б) молекула – найменша частинка речовини;
в) молекула – елементарна частинка;
г)молекула відбиває хімічні властивості речовини.
2. Яке з тверджень є правильним:
а) атом – найменша частинка речовини;
б) атом – найменша частинка хімічного елемента;
в) атом – найменша частинка молекули;
г) атом – найменша частинка маси.
3. Встановіть відповідність між тілами та хімічними речовинами, якими вони утворені:
1. цвях а) деревина;
2. свічка б) скло;
3. стілець в) залізо;
4. ваза г) парафін.
Фотозавдання
|
1.Виберіть правильне закінчення твердження – «До речовин не належить …». |
||
|
|
|
|
|
А |
Б |
В |
|
2.Назвіть прилади, які використовують для спостереження. |
||
|
|
|
|
|
А |
Б |
В |
Фiзичні властивості речовин. Чисті речовини і суміші
(однорідні, неоднорідні). Способи розділення сумішей.
ХІМІЧНИЙ ДИКТАНТ
- Крапля води, сніжинка, кусочок льоду – це …
- Олію від води можна відділити …
- Кухонна сіль і цукор подібні такими ознаками:
- За запахом можна впізнати такі речовини:
- Якщо можна помітити суміші окремі компоненти, то це …
- Складові суміші називаються …
- Суміші бувають …
- Щоб відокремити воду від цукру використовують…
- Суміш спирту і води можна розділити …
- Способи розділення неоднорідних сумішей: …
- Найпростіше позбутись від залізних домішок …
- Спосіб розділення: дистиляція ґрунтується на такій властивості
- Прозорий розчин. Що пройшов крізь фільтр –
- Однорідні суміші (приклади) –
- Відстоювання ґрунтується на властивості …
- Суміш заліза і сірки можна розділити …
- Суміш глини і води можна розділити…
- Молоко – це …
- Якщо порошок крейди засмічений тирсою, то потрібно …
- Щоб очистити забруднену кухонну сіль використовують такі способи розділення сумішей…
Тестові завдання
1. У якому ряду містяться лише чисті речовини?
а) кисень, повітря, вуглекислий газ;
б) дистильована вода, водень, цукор;
в) мінеральна вода, мідь, кухонна сіль;
г) граніт, азот, питна сода.
2. Позначити відповіді – «ч», якщо йдеться про чисту речовину; «с» - якщо йдеться про суміш:
а) мідний дріт; г) фосфор;
б) ґрунт; ґ) морська вода;
в) дистильована вода; д) повітря.
3. Позначте чисті речовини і суміші:
а) морська вода; д) срібло;
б) водень; е) латунь;
в) мідь; є) мармур;
г) повітря; ж) сірка.
ґ) глюкоза; з) ґрунт
4. Як розділити суміш:
а) пісок і тирса; г) рослинна олія + вода + сіль;
б) залізо і сода; ґ ) залізний порошок + вода + пісок;
в) сіль + вода + крейда; д) тирса + вода + спирт.
5. Як розділити такі суміші:
а) пісок і розтерте деревне вугілля; в) порошку крейди та кухонну сіль;
б) пісок і кухонну сіль; г) цукру й деревного вугілля
Фотозавдання
|
1.Вкажіть агрегатний стан води на кожному малюнку. Поясніть свій вибір. |
||
|
|
|
|
|
А |
Б |
В |
|
2.Вкажіть агрегатний стан води на кожному малюнку. Поясніть свій вибір. |
||
|
|
|
|
|
А |
Б |
В |
|
3.Вкажіть агрегатний стан речовин. Опишіть фізичні властивості цих сполук. |
||
|
|
|
|
|
А |
Б |
В |
|
4.Вкажіть агрегатний стан речовин. Опишіть фізичні властивості цих сполук. |
||
|
|
|
|
|
А |
Б |
В |
|
5.Вкажіть агрегатний стан речовин. Опишіть фізичні властивості цих сполук. |
||
|
|
|
|
|
А |
Б |
В |
|
6.Вкажіть агрегатний стан речовин. Опишіть фізичні властивості цих сполук. |
||
|
|
|
|
|
А |
Б |
В |
|
7.Вкажіть агрегатний стан речовин. Опишіть фізичні властивості цих сполук. |
||
|
|
|
|
|
А |
Б |
В |
|
8.Вкажіть агрегатний стан речовин. Опишіть фізичні властивості цих сполук. |
||
|
|
|
|
|
А |
Б |
В |
|
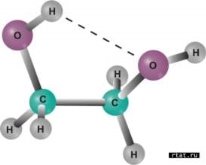
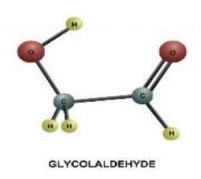
9.Назвіть речовини зображені на малюнках? Визначте агрегатний стан речовин. Опишіть фізичні властивості цих сполук. |
||
|
|
|
|
|
А |
Б |
В |
|
10.Визначте чисті речовини та суміші. Свою думку обґрунтуйте. |
||
|
|
|
|
|
А |
Б |
В |
|
11.Визначте чисті речовини та суміші. Свою думку обґрунтуйте. |
|||||
|
|
|
|
|||
|
А |
Б |
В |
|||
|
12.Назвіть запропоновані способи розділення сумішей. Поясніть суть кожного з них. |
|||||
|
|
|
|
|||
|
А |
Б |
В |
|||
|
13.Назвіть запропоновані способи розділення сумішей. Поясніть суть кожного з них. |
|||||
|
|
|
|
|||
|
А |
Б |
В |
|||
|
14.Визначте чисті речовини та суміші на поданих малюнках. Свою думку обґрунтуйте. |
||
|
|
|
|
|
А |
Б |
В |
|
15.Визначте чисті речовини та суміші на поданих малюнках. Свою думку обґрунтуйте. |
|||||
|
|
|
|
|||
|
А |
Б |
В |
|||
|
16.Визначте чисті речовини та суміші на поданих малюнках. Свою думку обґрунтуйте. |
|||||
|
|
|
|
|||
|
А |
Б |
В |
|||
Атом, його склад. Хімічні елементи, їхні назви і символи.
Періодична система хімічних елементів Д.І. Менделєєва.
Структура періодичної системи.
ГРАФІЧНИЙ ДИКТАНТ
- Структурними частинками речовин є: атоми, молекули, йони.
- Атом – найменша частинка речовини, що зберігає її властивості.
- Речовини є молекулярної та не молекулярної будови.
- Вид атомів із певним зарядом ядра – це хімічний елемент.
- Атом заряджений позитивно.
- Назви хімічних елементів пишуться з маленької літери.
- Структурними частинками речовин молекулярної будови є атоми.
- Ядро атома має негативний заряд.
- В природі зустрічаються 20 елементів періодичної системи.
- Атом складається з позитивно зарядженого ядра і негативно заряджених електронів.
- Кількість електронів завжди більша, ніж кількість протонів.
- Кількість електронів дорівнює порядковому номеру елемента.
Тестові завдання
1. Напшіть назви наступних хімічних елементів:
H, N, F, O, Na, Mg, Al, P, Cl, Ca, Fe, Zn, Cu.
2. Установіть відповідність між символом хімічного елемента та його назвою:
1. О а) Карбон;
2. С б) Флуор;
3. Са в) Кальцій;
4. F г) Оксиген.
3. Що таке «атом»?
а) це найдрібніша частинка речовини, що зберігає її властивості;
б) найдрібніша частинка речовини, що має позитивний заряд;
в) хімічно неподільна електронейтральна частинка речовини;
г) найдрібніша частинка речовини, що має негативний заряд.
4. З чого складається атом?
а) з протонів і нейтронів; в) з протонів і електронів;
б) з ядра і електронної оболонки; г) з нейтронів і електронів.
5. З чого складається ядро?
а) з протонів і електронів; в) з протонів, нейтронів і електронів;
б) з протонів і нейтронів; г) з нейтронів і електронів.
6. Скільки електронів має атом Оксигену?
а) 8 б) 16 в)15 г) 7
7. Скільки нейтронів має ядро атома Фосфору?
а) 15 в) 31
б) 30 г) 16
8. Яка з частинок має позитивний заряд?
а) нейтрон в) протон
б) електрон г) атом
9. Яка з частинок має негативний заряд?
а) протон в) електрон
б) катіон г) нейтрон
10. У III періоді, IV групі, головній підгрупі знаходиться хімічний елемент:
а) Ga; в) Si;
б) Sc; г) Al.
11. Заповнити таблицю:
|
Назва елементу |
Символ елементу |
Відносна атомна маса |
Номер періоду |
Номер групи |
Порядковий номер |
|
Натрій |
|
|
|
|
|
|
|
|
27 |
|
|
|
|
|
|
|
|
|
45 |
Маса атома. Атомна одиниця маси.
Відносні атомні маси хімічних елементів.
Хімічні формули речовин. Прості та складні речовини.
Багатоманітність речовин.
ГРАФІЧНИЙ ДИКТАНТ
- Відносна атомна маса позначається – m.
- За одиницю порівняння мас атомів вибрано мусу атома Карбону.
- Відносна атомна маса елемента величина безвимірна.
- Відносна атомна маса Нітрогену – 7.
- Значення відносної атомної маси і маси атома однакові.
- Атомна одиниця маси дорівнює – 1,66. 10-27 кг
- Маса атома Оксигену в 8 раз більша за 1/12 маси атома Карбону.
- Відносна атомна маса Карбону дорівнює 6.
- Найменша маса це маса атома Гідрогену.
- Відносна атомна маса показує у скільки раз маса атома елемента більша, чи менша за 1/12 маси атома Карбону.
- Відносна атомна маса Кальцію – 20.
- Маса атома Сульфуру в 2 рази більша за масу атома Оксигену.
Тестові завдання
1. Виберіть формули простих речовин: а) H2, б)HCl, в)O3, г)N2, д)N2O
а) а,в в) а, в, г
б) в,г г) б,д
2. У якому ряду є лише складні речовини?
а) Cu, H2O, HCl, H2SO4;
б) H2, Cl2, O2, O3, Al;
в) H2O, CaO, Cu, H3PO4;
г) HCl, H2O, H2SO4, NaOH.
3. З поданих нижче речовин випишіть окремо формули простих та складних:
а) Fe, H2O, CO2, H2, Al, CaC2, NaCl, N2;
б) MgO , Zn, SO2, Br2, N2O5, P, PH3.
4. Що означають вирази?
3Al, 8O3, 6CO2, 4N2, C, 6F2, SiO2, 2H, 2H2.
5. Позначити відповіді – «п», якщо записана хімічна формула простої речовини; «с» - якщо складної:
а) N2; г) Mg;
б) HNO3; ґ) PH3;
в) FeS2; д) PH3.
6. Напишіть формули речовин, до складу яких входять:
а) три атоми Калію,один атом Фосфору. чотири атоми Оксигену;
б) два атоми Натрію,один атом Силіцію,три атоми Оксигену;
в) чотири атоми Гідрогену,два атоми Фосфору,сім атомів Оксигену.
7. Вкажіть відносну атомну масу Натрію:
а) 11; в) 22;
б) 23; г) 3.
8. Опишіть якісний і кількісний склад молекули за хімічною формулою:
а) Al2O3; в) H3PO4;
б) H2SO4; г) C6H12O6.
9. Для позначення трьох молекул води використовують запис:
а) Н2О; б) 3Н2+О; в) 3Н2; г) 3Н2О.
10. Для позначення шести атомів Гідрогену використовують запис:
а) 3Н2; б) 2Н3; в) 6Н2; г) 6Н.
11. Установіть відповідність:
1. три молекули водню а) 3Н;
2. три вільні атоми Гідрогену б) NH3;
3. три атоми Гідрогену, що входять в) 3H2;
до складу речовини.
12. Установіть відповідність для запису 5СН4:
1. 4; а) коефіцієнт;
2. 20; б) загальне число атомів Гідрогену;
3. 5; в) число атомів Карбону в одній молекулі;
г) індекс.
Фотозавдання
|
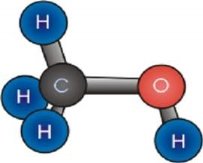
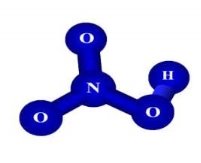
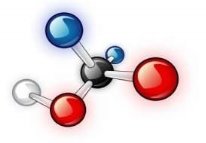
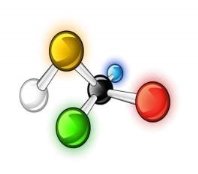
1.Вкажіть кількісний і якісний склад запропонованих формул речовин: |
||
|
|
|
|
|
А |
Б |
В |
|
2.Вкажіть кількісний і якісний склад запропонованих формул речовин: |
||
|
|
|
|
|
А |
Б |
В |
|
3.Вкажіть загальну кількість різних атомів у запропонованих молекулах речовин: |
||
|
|
|
|
|
А |
Б |
В |
|
4.Вкажіть загальну кількість різних атомів у запропонованих молекулах речовин: |
||
|
|
|
|
|
А |
Б |
В |
|
5.Вкажіть загальну кількість різних атомів у запропонованих молекулах речовин: |
||
|
|
|
|
|
А |
Б |
В |
|
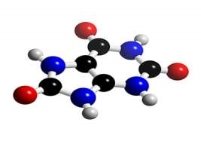
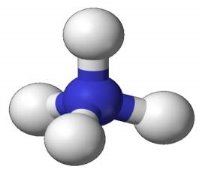
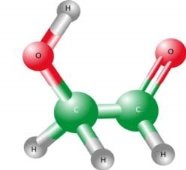
6.Складіть формули речовин за малюнками. Опишіть якісний і кількісний склад молекул. |
||
|
|
|
|
|
А |
Б |
В |
|
7.Складіть формули речовин за малюнками. Опишіть якісний і кількісний склад молекул. |
||
|
|
|
|
|
А |
Б |
В |
|
8.Вкажіть літери, де зображені формули: а)простих речовин; б)складних речовин: |
||
|
|
|
|
|
А |
Б |
В |
|
9. Вкажіть літери, де зображені формули: а) простих речовин; б)складних речовин: |
||
|
|
|
|
|
А |
Б |
В |
Метали й неметали.
Металічні та неметалічні елементи, їх розміщення в періодичній системі.
Тестові завдання
1. Виберіть рядок, у якому перелічені символи атомів металічних елементів:
а) Na, P, S, Cu, Al, H; в) C2, Br, P, S, Al, Mg;
б) Na, Ca, Al, Zn, Fe, K; г) H, K, Ca, Ba, Se, Si.
2. Виберіть рядок, у якому перелічені символи атомів неметалічних елементів:
а) Li, Na, Ca, Si, C, H; в) Si, C, H, Cl2, P, O;
б) Cr, Mn, Fe, O, C, H; г) Zn, Al, Cl, P, S, Na.
3. Позначте характерні риси металів:
а) пластичність; в) рідкий агрегатний стан;
б) золотистий колір; г) не проводять теплоту.
4. Виберіть підгрупу хімічних елементів, до яких не входять металічні елементи:
А) ІІІА; б) VБ; в) VІІІА; г) VІІБ.
Фотозавдання
|
1.Метали чи неметали зображено на малюнках? Опишіть їх фізичні властивості. |
||
|
|
|
|
|
А |
Б |
В |
|
2.Метали чи неметали зображено на малюнках? Опишіть їх фізичні властивості. |
||||
|
|
|
|
||
|
А |
Б |
В |
||
|
3.Метали чи неметали зображено на малюнках? Опишіть їх фізичні властивості. |
||||
|
|
|
|
||
|
А |
Б |
В |
||
|
4.Метали чи неметали зображено на малюнках? Опишіть їх фізичні властивості. |
||
|
|
|
|
|
А |
Б |
В |
|
5.Метали чи неметали зображено на малюнках? Опишіть їх фізичні властивості. |
||
|
|
|
|
|
А |
Б |
В |
|
6.Вкажіть метали чи неметали зображено на малюнках? Опишіть їх фізичні властивості. |
||
|
|
|
|
|
А |
Б |
В |
|
7.Вкажіть метали чи неметали зображено на малюнках? Опишіть їх фізичні властивості. |
||
|
|
|
|
|
А |
Б |
В |
|
8.Вкажіть метали чи неметали зображено на малюнках? Опишіть їх фізичні властивості. |
||
|
|
|
|
|
А |
Б |
В |
Валентність хімічних елементів. Складання формул бінарних сполук за валентністю елементів. Визначення валентності елементів за формулами бінарних сполук. Зв'язок між розміщенням елемента
у періодичній системі та його валентністю.
ГРАФІЧНИЙ ДИКТАНТ
- Нітроген, Сульфур і Фосфор мають постійну валентність.
- Na2O – валентність Натрію IV.
- Валентність можна визначити на підставі розміщення елемента в ПС.
- Хімічна формула – умовний запис речовини за допомогою символів та індексів.
- У формулах речовин молекулярної будови індекс показує кількість молекул.
- Валентність Гідрогену, Літію та Алюмінію – змінна.
- SO3 – валентність Сульфуру - IІІ.
- SiO2 – валентність Силіцію - IІ.
- Максимальна валентність Хлору – VII.
- У елементів – неметалів вища валентність дорівнює номеру групи.
- Властивість атомів хімічного елемента з’єднуватись з певним числом атомів інших хімічних елементів називається валентністю.
- Валентність Оксигену, Кальцію, Барію завжди – І.
- Li2O – валентність Літію - IV.
- У металів валентність частіше всього дорівнює номеру групи.
- Валентність буває стала та змінна.
Тестові завдання
1.Визначте і запишіть валентність хімічних елементів над символами, де їх валентність невідома (позначена за Х):
I х II х х II х х II х I х х х х II х х х х
FeBr3, Mg3N2, Mn2O7, SnO2, CuS, Cu2S, Cl2O7, Na2S, CH4, SnO
2.Складіть формули бінарних сполук за визначеною над символами хімічних елементів валентністю:
III II II III I IV II III II I II I I II II IV
Cr S, HS, Al І, C S, P O, MnCl, CaH, NaI, CaS, Si O
3.Обчисліть валентності елементів у їх сполуках з Оксигеном:
а) CO; г) NO2;
б) N2O; ґ) SO2;
в) WO3; д) B2O3.
4. Визначте ряд, в якому всі хімічні елементи мають сталу валентність:
а) Na, Cu, Zn, O, H; в) K, H, Ba, O, Al;
б) K, O, Fe, H, Cl; г) Ca, Zn, Si, P, O.
5. Визначте ряд, в якому всі хімічні елементи можуть мати валентність ІІ:
а) Mg, C, Cl, O, Al; в) Ba, Cu, Ca, O, C;
б) Cu, H, C, O, Fe; г) Al, O, Zn, Na, P.
6.Виправте помилки у формулах:
А1О, Р2О4, ZnО2, NаС12, CsF2, AgBr3, НI, SiН3.
7.Установіть відповідність між вказаною валентністю та сполуками:
1. N (I) a) NH3;
2. N (III) б) NO2;
3. N (IV) в) NO;
г) N2O.
8. Установіть відповідність між вказаною валентністю елемента та сполуками:
1. S (II) а) SO3;
2. S (IV) б) H2S;
3. S (VI) в) SO2;
9. Вкажіть сполуку у якій валентність елемента, сполученого з Оксигеном, найвища:
а) Н2О; б) СаО; в) РbO2; г) CrO3; ґ) Br2O7
10. В якій із сполук валентність елемента, сполученого з Гідрогеном, найнижча:
а) Н2О; б) NH3; в) НI; г) SiH4
11. Визначіть відповідність елемента в сполуках з Оксигеном та його валентності:
1. CrO3 а) І
2. K2O б) ІІ
3. SO2 в) ІІІ
4. MgO г) ІV
д) VI
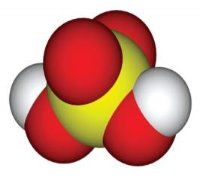
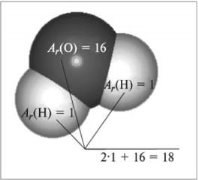
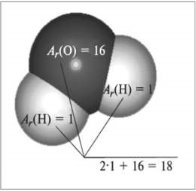
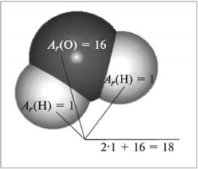
Відносна молекулярна маса, її обчислення за хімічною формулою.
ГРАФІЧНИЙ ДИКТАНТ
- Відносна молекулярна маса – це сума відносних атомних мас хімічних елементів, які входять до складу сполуки.
- Відносна молекулярна маса кисню – 16.
- Відносна молекулярна маса позначається –Ar?
- Відносна молекулярна маса азоту – 14.
- Відносна молекулярна маса води – 16.
- Відносна молекулярна маса показує відношення маси, яка припадає на елемент, до всієї речовини.
Тестові завдання
1. Чому дорівнює відносна молекулярна маса натрій сульфату Na2SO4?
а) 71; в) 376;
б) 142; г) 94.
2. Обчисліть відносну молекулярну масу наступних речовин:
H2SO4, CaF2, SiO2, H2CO3.
3. Позначте значення Mr (СаСО3):
а) 204; в) 200;
б) 100; г) 120.
4. Позначте значення Mr (K2SO4):
а) 167; в) 87;
б) 174; г) 204.
5. У якому ряду речовини розміщені в порядку зростання їх відносних молекулярних мас?
а) O2, H2O, H2S, H2; в) H2O, H2S, H2, O2;
б) O2, H2S, H2, H2O; г) H2, H2O, O2, H2S.
Фотозавдання
|
1.Беручи до уваги перший малюнок з розрахунками, обчисліть відносні молекулярні маси формул речовин Б і В: |
||
|
|
|
|
|
А |
Б |
В |
|
2.Беручи до уваги перший малюнок з розрахунками, обчисліть відносні молекулярні маси формул речовин Б і В: |
||
|
|
|
|
|
А |
Б |
В |
|
3.Беручи до уваги перший малюнок з розрахунками, обчисліть відносні молекулярні маси формул речовин Б і В: |
||
|
|
|
|
|
А |
Б |
В |
|
4.Обчисліть відносні молекулярні маси запропонованих формул речовин. |
|
|
|
|
|
А |
Б |
|
5.Обчисліть відносні молекулярні маси наступних формул речовин: |
||
|
|
|
|
|
А |
Б |
В |
|
6.Обчисліть відносні молекулярні маси наступних формул речовин: |
||
|
|
|
|
|
А |
Б |
В |
Масова частка елемента в складній речовині.
ГРАФІЧНИЙ ДИКТАНТ
- Масова частка елемента в складній речовині позначається – Mr?
- Масова частка елемента в речовині показує у скільки раз маса молекули більша за 1/12 маси атома Карбону.
- Прості речовини: сірка, фосфор, натрій складаються з двох атомів.
- Сполуки, які складаються з двох елементів називаються – бінарними.
- Бінарні сполуки елемента з гідрогеном називаються оксидами.
- Для будь-якої речовини характерні, як фізичні так і хімічні властивості.
Тестові завдання
1. Знайдіть помилку при обчисленні відносних молекулярних мас та масових часток елементів у речовинах:
а) Mr(ZnS) = 99 в) Mr(Ca3P2) = 182
ω(Zn) = 67 % ω(Са) = 68 %
ω(S) = 33 % ω(Р) = 32 %
б) Mr(Al4C3 ) = 141 г) Mr(CH4 ) = 16
ω(Al) = 75 % ω(С) = 70 %
ω(С) = 25 % ω(Н) = 30 %
2. Обчисліть масову частку Оксигену у речовині K2ClO3.
3. Обчисліть масову частку Нітрогену в речовині NaNO2.
Фізичні та хімічні явища. Хімічні реакції та явища, що їх супроводжують. Хімічні властивості речовин.
ГРАФІЧНИЙ ДИКТАНТ
- Фізичні явища супроводжуються утворенням нових речовин.
- Хімічне явище і є хімічною реакцією.
- Кипіння води та утворення туману – це є хімічне явище.
- Будь-які зміни називаються явищами.
- Фізичні явища виявляються у зміні форми тіла або агрегатного стану речовини.
- Під час фізичного явища повинна бути одна з ознак хімічно реакції.
- Горіння бензину та світіння електролампочки – це хімічні явища.
- Під час ржавіння заліза виділяється газ.
- Суть фізичного явища у перетворені речовин.
- Для початку хімічної реакції досить нагріти речовини до певної температури.
- Перегнивання листя та скисання молока – фізичні явища.
- Явища, під час яких не утворюються нові речовини називаються – фізичними.
- В результаті хімічного явища нові речовини не утворюються.
- Для виникнення хімічної реакції необхідно подрібнити і перемішати речовини.
- Танення льоду та кипіння води – це фізичні явища.
Тестові завдання
1. Позначити відповіді – «ф», якщо йдеться про фізичне явище; «х», якщо йдеться про хімічне явище:
а) випаровування води; г) танення криги;
б) обвуглення скалки; ґ) скисання молока;
в) іржавіння цвяха; д) горіння вугілля.
2. Вибрати хімічні явища:
1)іржавіння заліза; 2)плавлення парафіну; 3)випаровування води; 4)горіння сірки; 5)фотосинтез; 6)утворення сніжинок:
а) 1, 2, 4 в) 4, 5, 6
б) 1, 4 г) 1, 4, 5
3. Вкажіть властивість, що не є ознакою хімічної реакції:
а) зміна забарвлення; в) виділення температури;
б) зміна агрегатного стану; г) виділення газу.
4. Встановіть відповідність між явищем та ознакою, якою супроводжується таке хімічне перетворення:
1. горіння бензину а) виділення тепла;
2. гасіння вапна б) виділення бульбашок газу;
3. взаємодія питної соди та оцту в) виділення світла і тепла.
Фотозавдання
|
1.Із запропонованих природних явищ оберіть фізичні та хімічні. Поясніть свій вибір. |
||
|
|
|
|
|
А |
Б |
В |
|
2.Із запропонованих явищ оберіть фізичні та хімічні. Поясніть свій вибір. |
||
|
|
|
|
|
А |
Б |
В |
|
3.Із запропонованих явищ оберіть фізичні та хімічні. Поясніть свій вибір. |
||
|
|
|
|
|
А |
Б |
В |
|
4.Із запропонованих явищ оберіть фізичні та хімічні. Поясніть свій вибір. |
||
|
|
|
|
|
А |
Б |
В |
|
5.Із запропонованих явищ оберіть фізичні та хімічні. Поясніть свій вибір. |
||
|
|
|
|
|
А |
Б |
В |
|
6.Які ознаки хімічних явищ продемонстровано на малюнках? |
||
|
|
|
|
|
А |
Б |
В |
|
7.Які ознаки хімічних явищ продемонстровано на малюнках? |
||
|
|
|
|
|
А |
Б |
В |
Самостійна робота з теми «Початкові хімічні поняття»
Варіант І
1. Прості речовини — це...
2. Відносна атомна маса Сульфуру:
а) 16; б) 32; в) 8.
3. Про кисень як просту речовину йдеться в реченні:
а) кисень входить до складу повітря;
б) крейда — складна речовина, що містить Оксиген.
4. У III періоді, V групі, головній підгрупі знаходиться хімічний елемент:
а) Y; б) In; в) P.
5. Із запропонованого переліку виберіть формули простих речовин:
Fe(OH)3, Au, N2, H2S, F2, HCl, P2O5, S8, PbS, C, ZnO, Mg.
6. Установіть відповідність:
1. Li а) Силіцій
2. S б) Літій
3. Al в) Сульфур
4. Si г) Алюміній
7. Установіть відповідність:
1. Три молекули азоту а) 3N
2. Три вільні атоми Нітрогену б) NH3
3. Атом Нітрогену, що входить до складу речовини в) 3N2
8. Опишіть якісний і кількісний склад молекули за хімічною формулою:
а) N2O5; б) Ca(OH)2.
9. Обчисліть валентності елементів у їх сполуках з Оксигеном:
а) Ag2O; в) CrO3; д) CO2;
б) Cl2O7; г) CaО; е) As2O5.
10. Складіть формули сполук за валентністю:
Al O, K O, Са О.
Варіант ІІ
1. Атом — це...
2. Відносна атомна маса Флуору:
а) 18; б) 19; в) 9.
3. Про Арсен як хімічний елемент ідеться в реченні:
а) арсен за звичайних умов — рідкий метал;
б) до складу арсен(ііі) оксиду входить арсен.
4. У II періоді, V групі, головній підгрупі знаходиться хімічний елемент:
а) Cd; б) N; в) Sr.
5. Із запропонованого переліку виберіть формули простих речовин:
AgCl, Cl2, LiOH, C2H6, Ca, O2, Al2O3, H2SO4, Ag, Ag2O, Cu, FeS2.
6. Установіть відповідність:
1. Na а) Калій
2. N б) Натрій
3. H в) Гідроген
4. K г) Нітроген
7. Установіть відповідність:
1. Два вільні атоми Оксигену а) 2O2
2. Два атоми Оксигену в складі складної речовини б) CO2
3. Дві молекули кисню в) 2O
8. Опишіть якісний і кількісний склад молекули за хімічною формулою:
а) Fe2O3; б) HNO3.
9. Обчисліть валентності елементів у їх сполуках з Оксигеном:
а) CuО; в) SO3; д) P2O5;
б) NO; г) PbO2; е) K2O.
10. Складіть формули сполук за валентністю:
Ag O, Zn O, Nа O.
Тема 2 Кисень
Повітря, його склад.
Тестові завдання
1. Чому дорівнює об’ємна частка кисню в повітрі?
а) 23% в) 78%
б) 21% г) 0,04%
2. Чому дорівнює відносна молекулярна маса повітря?
а) 28; в) 29;
б) 32; г) 44.
3. Із запропонованих тверджень виберіть лише правильні чотири:
а) атмосферне повітря необхідне для дихання;
б) повітря – це суміш газів;
в) у складі повітря найбільше міститься кисню;
г) тепле повітря опускається вниз;
ґ) тепле повітря піднімається вгору;
д) повітря добре проводить тепло;
е) від нагрівання повітря розширюється.
Оксиген. Поширеність Оксигену в природі. Кисень, склад його молекули, поширеність у природі. Фізичні властивості кисню.
ГРАФІЧНИЙ ДИКТАНТ
- Оксиген у зв’язаному вигляді входить до складу повітря.
- Відносна атомна маса Оксигену – 32.
- Постійний вміст кисню в повітрі забезпечує процес фотосинтезу.
- Кисень легший за повітря.
- Кисень добре розчинний у воді.
- Кисень – речовина, яка складається з 2 атомів Гідрогену.
- Оксиген займає І місце за поширенням в Земній корі.
- Молекула озону складається з 3 атомів Нітрогену.
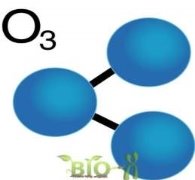
- Алотропія – явище коли один елемент має декілька простих речовин.
- Алотропними модифікаціями Оксигену є кисень і озон.
- Відносна молекулярна маса кисню – 16.
- В Європі кисень відкрили одночасно Д.Прістлі та К.Шеєле.
- Алмаз та графіт – алотропні модифікації Оксигену.
- Лавуазьє встановив, що кисень – складова повітря.
- Кисень в природі є лише руйнівником.
- Стала температура тварин підтримується енергією, виділеною під час окиснення.
Тестові завдання
1. Укажіть правильно зазначені фізичні властивості кисню:
а) синій газ, без запаху, без смаку, легший за повітря;
б) безбарвний газ, без запаху, без смаку, важчий за повітря;
в) за звичайних умов синя рідина з приємним запахом.
2. Позначте фізичні властивості кисню за звичайних умов:
а) кристали синього кольору;
б) добре розчиняється у воді;
в) газ без запаху і смаку;
г) на кисень припадає трохи більше 1/5 об’єму повітря.
3. У чому полягає біологічна роль кисню?
а) у здатності підтримувати горіння;
б) у здатності підтримувати дихання;
в) у здатності підтримувати дихання і вступати в реакції горіння;
г) у здатності підтримувати дихання і вступати в реакції окиснення.
4. Обчисліть масову частку Оксигену в ортофосфатній кислоті H3PO4 і вкажіть правильну відповідь:
а) 16% в) 65%
б) 32% г) 33%
Закон збереження маси речовин під час хімічних реакцій.
Схема хімічної реакції. Хімічні рівняння.
Тестові завдання
1. Розставте коефіцієнти у схемі рівняння реакції і вкажіть їх суму:
MnO2 + H2SO4 = MnSO4 + O2 + H2O
а) 10 б) 9 в)5 г) 6
2. Розставте коефіцієнти у схемах і вкажіть їх суму:
а) K + O2 = K2O; д) Na2O + H2O = NaOH;
б) Na + Cl2 = NaCl; е) Na + H2 = NH3;
в) KClO3 = KCl + O2; є) Al2O3 + Fe = Fe2O3 + Al;
г) Li+ H2O = LiOH + H2; ж) Pb(NO3)2=PbO + NO2+O2;
ґ) Al + H2SO4 = Al2(SO4)3 + H2; з) SiO2 + HF = SiF4 + H2O.
3. Розставте коефіцієнти у запропонованих схемах та вкажіть суму коефіцієнтів у вихідних речовинах:
а) РЬ + О2 = РЬО; в) Аg + S = Аg2S; б) Н2 + F2 = НF; г) Lі + О2 = Li2О.
4. Складіть і прочитайте хімічні рівняння таких реакцій:
а) взаємодіїї карбону й водню з утворенням метану (СН4); б) взаємодії водню з хлором з утворенням гідроген (І) хлориду (HCl).
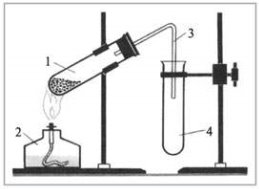
Добування кисню в лабораторії та промисловості. Реакція розкладу. Поняття про каталізатор. Способи збирання кисню.
Доведення наявності кисню.
ГРАФІЧНИЙ ДИКТАНТ
- Кисень добувають реакцією сполучення.
- В лабораторних умовах кисень добувають з оксигеновмісних речовин.
- Інгібітор – речовина, яка прискорює швидкість реакції.
- Кисень збирають витісненням води та витісненням повітря.
- Кисень – газ блакитного кольору з різким запахом.
- Для розкладу води потрібний каталізатор – Купрум(ІІ)оксид.
- Збираючи кисень, пробірку повертають вниз дном.
- Каталізатор – речовина, яка сповільнює швидкість хімічної реакції.
- У промисловості кисень добувають з калій перманганату.
Тестові завдання
1. Як називаються речовини, які прискорюють хімічні реакції, але не входять до складу їх продуктів?
а) ензими; в) інгібітори;
б) ферменти; г) каталізатори.
2. В одній колбі - кисень, а в іншій - повітря. Як дізнатися, у якій колбі кисень?
а) за допомогою лакмусового папірця; в) за запахом;
б) за кольором; г) за спалахуванням тліючої скіпки.
3. Установіть послідовність одержання кисню з калій перманганату:
а) заповнення пробірки калій перманганатом;
б) кріплення приладу для збирання газів у штативі;
в) під’єднання газовідвідної трубки до приладу;
г) збирання кисню витісненням води.
Фотозавдання
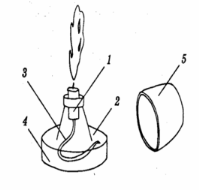
б) на малюнку А підпишіть складові частини приладу для збирання газів; в) на малюнку Б позначте та підпишіть складові частини приладу для збирання газів. |
|
|
|
|
|
А |
Б |
|
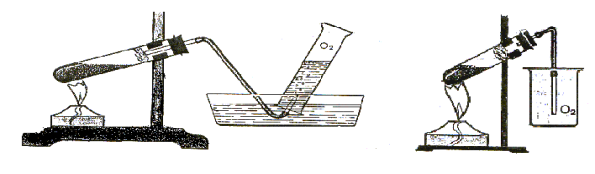
2.Яким методом збирають кисень на поданих малюнках? Поясніть суть кожного методу. |
|
|
|
А Б |
Хімічні властивості кисню: взаємодія з простими речовинами
(вуглець, водень, сірка, магній, залізо, мідь). Реакція сполучення.
ГРАФІЧНИЙ ДИКТАНТ
- При згоранні сірки утворюється густий білий дим.
- Кисень хімічно пасивний.
- Реакція сполучення – це реакція в результаті якої з однієї речовини утворюється декілька.
- Окиснення та горіння не мають нічого спільного.
- При недостачі кисню вуглець згорає з утворенням вуглекислого газу.
- При взаємодії кисню з простими речовинами утворюються оксиди.
- Суть реакцій окиснення та горіння одна й та сама.
- Окислюючи органічні речовини, кисень підтримує дихання. Вивільнена енергія забезпечує життєдіяльність організмів.
- Під час горіння фосфору утворюється газ з різким запахом.
- Хімічна взаємодія речовин з киснем називається окисненням.
- Горіння речовин в кисні відбувається повільніше, ніж в повітрі.
- До складу оксидів входять два елементи, один з яких – Оксиген.
- Реакції горіння це окиснення, яке супроводжується виділенням теплоти
- Щоб відбулося горіння речовини потрібно її охолодити.
- Під час іржавіння заліза речовина повинна про взаємодіями з киснем.
Тестові завдання
1. Скласти рівняння реакцій за схемами:
а) В + O2 = В2О3; в) Рb + О2 = РЬО; ґ) Lі + О2 = Li2О;
б) K + O2 = K2O; г) Fe + O2 = FeO; д) Fe + O2 = Fe2O3
2. Дописати рівняння реакцій за схемами:
а) Zn + O2 = г) Fe + О2 =
б) C + O2 = ґ) P + O2 =
в) S+ О2 = д) Al + O2 =
Поняття про оксиди, окиснення (горіння, повільне окиснення, дихання).
Тестові завдання
1. Які реакції називаються реакціями окиснення?
а) реакції горіння; в) реакції обміну;
б) взаємодія з киснем; г) реакції сполучення.
2. Які реакції називаються реакціями горіння?
а) реакції окиснення, що супроводжуються виділенням тепла і світла;
б) реакції розкладу;
в) реакції обміну;
г) реакції окиснення, що відбуваються при наявності каталізаторів.
3. Оберіть більш повне визначення поняття «оксиди»:
а) складні речовини, що містять Оксиген;
б) бінарні сполуки, що містять Оксиген;
в) бінарні сполуки;
г) складні речовини.
4. Що спільного, а що відмінного у процесах горіння та окиснення.
|
Риси |
Горіння |
Повільне окиснення |
|
Спільне |
|
|
|
Відмінне |
|
|
5. Скласти формули речовин за їх назвами:
а) калій оксид; г) карбон (ІІ) оксид; б) фосфор (V) оксид; ґ) ферум (ІІІ) оксид; в) алюміній оксид. д) нітроген (IV) оксид.
6. Заповнити таблицю:
|
Елемент |
Формула оксиду |
Назва оксиду |
|
Na |
|
|
|
C (IV) |
|
|
|
Ba |
|
|
|
Fe (III) |
|
|
|
Cl(VII) |
|
|
7. Виберіть із списку речовин формули оксидів. Розташуйте ці оксиди в ряд у міру зростання їх відносної молекулярної маси.
|
№ варіанту |
Речовини |
|
I |
H3PO4, Cu(OH)2, Na2O, HNO3, P2O5, Al2(SO4)3, KOH, SO3 |
|
II |
Fe(OH)3, CaO, SO2, H2SiO3, MgCl2, NaOH, K2O, NH3 |
|
III |
BaO, Fe(OH)2, CO2, HCl, Zn(NO3)2, Ba(OH)2, HNO3, Al2O3 |
|
IV |
Al(OH)3, MgO, Cl2O7, H2SO4, CaCl2, KOH, Na2O, H2SO3 |
|
V |
ZnO, HBr, P2O5, Cu(OH)2, Ca3(PO4)2, Ba(OH)2, SO2, H2SO4 |
8. Встановіть відповідність: Назви оксидів:
1. Сu2O; а) сульфур (VІ) оксид;
2. SO2. б) купрум (І) оксид;
в) купрум (ІІ) оксид.
Взаємодія кисню зі складними речовинами
(повне окиснення метану, гідроген сульфіду, глюкози).
Тестові завдання
1. Скласти рівняння реакцій за схемами:
а) С2Н6 + О2 = СО2 + Н2О; г) PH3 + O2 = P2O5 + H2O; б) NH3 + O2 = N2 + H2O; ґ) СS2 + О2 = СО2 + SО2; в) NН3 + О2 = NО + Н2О; д) С7Н12 + О2 = СО2 + Н2О.
2. Дописати схеми реакцій за участю кисню і перетворити їх на хімічні рівняння:
а) ZnS + O2 = г) SO2 + … = SO3
б) C2H2 + O2 = ґ) Н2S + … = … + Н2О;
в) C12H22O11 + O 2= д) РН3 + … = Р2 О5 + …;
Умови виникнення та припинення горіння.
Маркування небезпечних речовин.
Тестові завдання
1. Закінчіть речення:
а) Я знаю, що умовами виникнення горіння є:____________________. б) Я знаю, що для припинення горіння необхідно:________________. в) Я знаю, що вибух супроводжується:__________________________. г) Я знаю, що небезпечні речовини маркують:___________________.
2. Позначте умови горіння:
а) потрібно залити речовину водою;
б) наявність кисню;
в) спрямувати на речовину струмінь вуглекислого газу;
г) речовина повинна бути газоподібною.
3. Позначте умови припинення горіння:
а) потрібно речовину засипати піском;
б) нагрівання речовин до температури самозаймання;
в) спрямувати на речовину струмінь вуглекислого газу;
г) речовина може перебувати в будь-якому агрегатному стані.
4. Розташуйте речовини у порядку зростання їх температури займання:
а) деревина; б) папір; в) азот; д) бензин.
5. Заповніть таблицю:
|
Ознака |
горіння |
повільного окиснення |
|
Спільна |
|
|
|
Відмінна |
|
|
|
|
|
|
|
|
|
|
Фотозавдання
|
1.Опишіть методи, які використовують для припинення горіння |
||
|
|
|
|
|
А |
Б |
В |
|
2. На що вказують знаки маркування небезпечних речовин? |
||
|
|
|
|
|
А |
Б |
В |
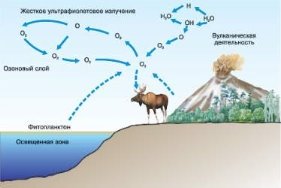
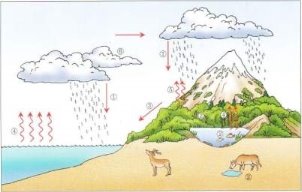
Колообіг Оксигену в природі. Озон. Проблема чистого повітря. Застосування та біологічна роль кисню.
Тестові завдання
1. Встановіть послідовність у зростанні об’ємних часток газів, компонентів повітря:
а) аргон; в) кисень;
б) вуглекислий газ; г) азот.
2. Позначте слова пропущені у фразі «… Оксиген входить до складу всіх життєво важливих органічних речовин: білків, жирів, вуглеводів»:
а) складна речовина; в) хімічний елемент;
б) алотропна модифікація; г) проста речовина.
3. Встановіть відповідність:
Застосування кисню: Властивості кисню:
- кисневі маски а) процес супроводжується
великою кількістю теплоти;
2. гниття б) повільне окиснення;
в) забезпечує дихання.
Самостійна робота з теми «Кисень»
Варіант І
І рівень
Завдання з вибором однієї правильної відповіді
1. Позначте символ хімічного елемента Оксигену:
а) О; б) О3; в) О2; г) О5.
2. Позначте, де у виразі йдеться про просту речовину, а не про елемент:
а) Оксиген входить до складу води;
б) кисень входить до складу земної кори;
в) Оксиген сприяє колообігу інших елементів;
г) Оксиген входить до складу вуглекислого газу.
3. Позначте фізичні властивості кисню за звичайних умов:
а) газ без запаху і смаку; в) добре розчиняється у воді;
б) кристали синього кольору; г) кисню в повітрі близько 21%.
4. Позначте оксид, у якого найбільша відносна молекулярна маса:
а) СО; б) SO2; в) N2O; г) Na2O.
5. Позначте умови горіння:
а) потрібно засипати речовину піском;
б) наявність кисню;
в) спрямувати на речовину струмінь вуглекислого газу;
г) речовина повинна бути твердою.
6. Позначте агрегатний стан та колір продукту реакції горіння магнію в кисні:
а) газ без кольору; в) тверда речовина жовтого кольору;
б) речовина білого кольору; г) блакитна рідина.
ІІ рівень
Завдання на встановлення відповідності. До кожного рядка, позначеного цифрою, доберіть відповідник, позначений буквою.
7. Встановіть відповідність:
Формули оксидів: Назви оксидів:
- Р2О5; а) фосфор (ІІІ) оксид;
- СаО. б) фосфор (V) оксид;
в) кальцій оксид.
8. Встановіть відповідність:
Застосування кисню: Властивості кисню:
- кисневі маски; а) процес супроводжується
великою кількістю теплоти;
2. гниття. б) повільне окиснення.
в) забезпечує дихання
Завдання на встановлення послідовності.
9. Встановіть послідовність у зростанні об’ємних часток газів, компонентів повітря:
а) аргон; в) кисень;
б) вуглекислий газ; г) азот.
ІІІ рівень
10. Допишіть схеми реакцій за участю кисню, під час яких утворюється оксиди, і перетворіть їх на хімічні рівняння:
t0 t0
а) В + … = В2О3; в) Н2S + … = … + Н2О;
t0 t0
б) РН3 + … = Р2 О5 + …; г) Li + … = Li2 O.
11. Складіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
H2O → O2→CO → X.
IV рівень
12.Розв’яжіть задачу.
Складіть найпростішу формулу речовини за нижченаведеними масовими частками елементів: Карбон – 27,27%, Оксиген – 72,73%.
Варіант ІІ
І рівень
Завдання з вибором однієї правильної відповіді
1. Позначте формулу простої речовини, яка підтримує горіння:
а) О; б) СО2; в) О2; г) Н2О.
2. Позначте валентність Оксигену:
а) І; б) ІІ; в) -2; г) 2.
3. Позначте слова пропущені у фразі «… Оксиген входить до складу всіх життєво важливих органічних речовин: білків, жирів, вуглеводів»:
а) складна речовина; в) хімічний елемент;
б) алотропна модифікація; г) проста речовина.
4. Позначте фізичні властивості кисню за звичайних умов:
а) кристали синього кольору; в) газ без запаху і смаку;
б) добре розчиняється у воді; г) на кисень припадає трохи більше 1/5 об’єму повітря.
5. Позначте оксид, у якого найбільша відносна молекулярна масса:
а) СО; б) SO2; в) N2O; г) К2О.
6. Позначте умови припинення горіння:
а) потрібно речовину засипати піском;
б) нагрівання речовин до температури самозаймання;
в) спрямувати на речовину струмінь вуглекислого газу;
г) речовина може перебувати в будь-якому агрегатному стані.
ІІ рівень
Завдання на встановлення відповідності. До кожного рядка, позначеного цифрою, доберіть відповідник, позначений буквою.
7. Встановіть відповідність: Назви оксидів:
1. Сu2O; а) сульфур (VІ) оксид;
2. SO2. б) купрум (І) оксид;
в) купрум (ІІ) оксид.
8. Встановіть відповідність:
Речовина: Властивості:
1. кисень а) безбарвний газ, має запах;
2. сірчистий газ б) твердий, притягується магнітом;
в) безбарвний газ, без запаху;
Завдання на встановлення послідовності
9. Встановіть послідовність у зростанні масових часток газів, компонентів повітря:
а) аргон; в) азот;
б) вуглекислий газ; г) кисень.
ІІІ рівень
10. Допишіть рівняння хімічних реакцій згідно зі схемами, дайте назви продуктів реакцій:
а) Fe + О2 = в) C + O2 =
б) S+ О2 = г) KNO3=
11. Напишіть рівняння реакцій, за допомогою яких можна здійснити перетворення:
КСІО3 →О2 → Fe3O4
IV рівень
12.Розв’яжіть задачу.
Складіть найпростішу формулу речовини, якщо масова частка елементів: Нітроген – 63,64%, Оксисен – 36,36%.
Тема 3 Вода
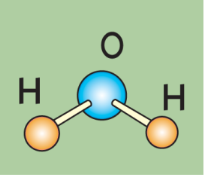
Вода, склад її молекули, поширеність у природі, фізичні властивості.
Вода – розчинник.
Тестові завдання
1. Який розчинник є найпоширенішим?
а) вода; в) бензин;
б) спирт; г) кислота.
2. Які з цих речовин розчиняються у воді:
а) AlPO4; б) NaOH; в)AgNO3; г) CuS;
ґ) NaCl; д) PbCl2; е) AgCl; є) Ca(OH)2.
3. Розчин складається з двох рідин (спирту та води). Розчинником у ньому буде:
а) вода; в) компонент, якого міститься в системі більше;
б) спирт; г) компонент, вміст якого в системі менше.
4. Вкажіть неправильне тлумачення поняття „розчинність”:
а) усі речовини розчиняються у воді однаково;
б) розчинність багатьох речовин у воді не безмежна;
в) розчинність – це характеристика здатності однієї речовини розчинятися в іншій.
Розчин і його компоненти: розчинник, розчинена речовина.
Хімічний диктант
1.Однорідні системи, які складаються з двох чи більше речовин, називаються …
2.Розчин складається із розчинника та …
3.Здатність речовини розчинятися в тому чи іншому розчиннику називається..
4.Розчинність більшості солей збільшується із….. температури.
Тестові завдання
1.Виберіть твердження, що характеризує розчин:
а) речовина у рідкому агрегатному стані;
б) однорідна суміш речовин;
в) хімічна сполука;
г) гетерогенна система, що складається з кількох речовин.
2. У водному розчині купрум (ІІ) сульфату останній є:
а) розчинником і розчиненою речовиною;в) розчинником;
б) нерозчинною речовиною; г) розчиненою речовиною.
Фотозавдання
|
1.Позначте речовини, які розчиняються у воді. |
||
|
|
|
|
|
А |
Б |
В |
|
2.Позначте речовини, які розчиняються у воді. |
||
|
|
|
|
|
А |
Б |
В |
Кількісний склад розчину.
Масова частка розчиненої речовини. Виготовлення розчину.
Тестові завдання
1. Заповніть вільні клітинки у таблиці, розв’язавши задачу, використовуючи наступні дані:
|
Ум зад. Варіант |
т (реч.) г |
т (Н2О) г |
т (р-ну) г |
W (р.р.) % |
V(р-ну) мл |
ρ (р-ну) г/мл |
|
1. |
|
|
300 |
30 |
|
1,13 |
|
2. |
20 |
180 |
|
|
|
1,07 |
|
3. |
|
|
|
25 |
500 |
1,1 |
|
4. |
30 |
270 |
|
|
|
1,14 |
|
5. |
160 |
|
|
40 |
381 |
|
|
6. |
32 |
|
|
40 |
|
1,2 |
|
7. |
|
200 |
|
10 |
|
1,02 |
|
8. |
|
|
|
30 |
600 |
1,02 |
|
9. |
50 |
|
250 |
|
238 |
|
|
10. |
60 |
240 |
|
|
|
1,12 |
Взаємодія води з оксидами.
Поняття про гідрати оксидів: кислоти й основи. Поняття про індикатори.
Тестові завдання
1. Розставте коефіцієнти в схемах реакцій та вкажіть реакції в результаті яких: 1) утворюється основа; 2) утворюється кислота
а) P2O5 + H2O = H3PO4; ґ) Li2О + Н2О = LiOH;
б) ВаО + Н2О = Ва(ОН)2; д) Р2О5 + Н2О = НРО3;
в) Р2О5 + Н2О = Н3РО4; е) Na2O + Н2О = NaOH;
г) Сl2O7 + Н2О = НСlО4 є) N2O5 + Н2О = HNО3.
2. Яким індикатором неможливо виявити кисле середовище розчину?
а) лакмус; в) фенолфталеїн;
б) універсальний індикатор; г) метилоранж.
3. Яке забарвлення має лакмус у кислому середовищі?
а) червоне; в) жовте;
б) синє; г) фіолетове.
4. Яке забарвлення має фенолфталеїн у лужному середовищі?
а) червоне; в) малинове;
б) жовте; г) безбарвне.
5. Яке забарвлення має універсальний індикатор у кислому середовищі?
а) червоне; в) жовте;
б) синє; г) фіолетове.
6. Вибери ряд із формулами лугів:
а) NaOH, Ca(OH)2, Cu(OH)2, KOH;
б) NaOH, Sr(OH)2, Ba(OH)2, NH4OH;
в) Ca(OH)2, Cu(OH)2, Zn(OH)2, Ba(OH)2;
г)Fe(OH)3, Al(OH)3, Cr(OH)3, NH4OH.
7. Яка з формул є зайвою в ряду: NH4OH, Ca(OH)2, NaOH, Sr(OH)2, Cu(OH)2? Чому?
а) NH4OH; в) Ca(OH)2;
б) NaOH; г) Cu(OH)2.
8. У якому ряду є лише формули кислот? Чому?
а) NaCl, HCl, HNO3, KOH; в) CuS, NaOH, CuCl2, Ca(OH)2;
б) HCl, H2S, HBr, HNO3; г) NaOH, KOH, Ca(OH)2, Al(OH)3.
9. Які речовини реагують між собою? (позначити «+»). Написати відповідні реакції.
|
|
MgO |
BaO |
SO3 |
CO2 |
NaOH |
|
H2O |
|
|
|
|
|
|
|
HNO3 |
Li2O |
P2O5 |
Mg(OH)2 |
CaO |
|
H2O |
|
|
|
|
|
Фотозавдання
|
1.Беручи до уваги перше рівняння реакції, складіть рівняння реакції до другого малюнка. |
|
|
|
|
|
А |
Б |
|
2.Вкажіть назву індикатора, який використовують у кожному з випадків. Поясніть свій вибір. |
||
|
|
|
|
|
А |
Б |
В |
|
3.Вкажіть назву індикатора, який використовують у кожному з випадків. Поясніть свій вибір. |
||
|
|
|
|
|
А |
Б |
В |
|
4.Чому відбулася зміна кольору лакмусового папірця на малюнках А і В? Про що свідчить зміна забарвлення індикатора в кожному з випадків? |
||
|
|
|
|
|
А |
Б |
В |
Значення води і водних розчинів у природі та житті людини.
Кислотні дощі. Проблема чистої води. Охорона водойм від забруднення.
Очищення води на водоочисних станціях та в домашніх умовах.
Фотозавдання
|
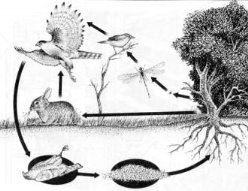
1.Кругообіг яких речовин зображено на малюнках? Опишіть його. |
|
|
|
|
|
А |
Б |
|
2.Опишіть кругообіг речовин у природі. |
|
|
|
|
|
А |
Б |
Література
- Базелюк І.І. та ін. Довідкові матеріали з хімії. – Київ; Ірпінь:DNA «Перун»,1998.
- Баланюк Т., Максимов І. Зошит для практичних робіт з хімії, 8 клас. Навч. посібники, 2008.
- Буринська Н.М.Хімія. Підручник для 8 класу загальноосвітніх навчальних закладів. – К.: Перун, 2008.
- Гладюк М. М. Дидактичний матеріал з хімії. 8 клас. — Тернопіль, 1999.
- Дубовик О.А., Зубарук Т.Ю., Сергуніна Р.О. Зошит для практичних робіт та тематичного оцінювання з хімії, 7 клас. К.: ЛВК, 2007.
- Дубовик О.А., Зубарук Т.Ю., Сергуніна Р.О. Зошит для практичних робіт та тематичного оцінювання з з хімії, 8 клас. К.: ЛВК, 2008.
- Задорожний К.М. Хімія: Дидактичні матеріали до курсу. 7 клас [Текст] / К.М. Задорожний. – Х.: Видавнича група «Основа», 2007. – 112 с. – (Бібліотека журналу «Хімія». Вип. 6 (54)).
- Максимов І., Баланюк Т., Берлізова О. Зошит для практичних робіт з хімії, 7 клас. К.: Навч. посібники, 2007.
- Максимов І.О., Філоненко І.О. Хімія. Визначення, закони, формули. Довідник для учнів 7-11 класів та вступників до вузів. К.: ЛВК, 2007.
- Попель П.П., Крикля Л.С. Хімія. Підручник для 8 класу загальноосвітніх навчальних закладів. – К.: Академія, 2008.
- Савчин М. М. Уроки хімії у 8 класі. — Львів, 1999. Тематичне оцінювання. Хімія. Різнорівневі завдання. — Х.: Торсінг, 2005
- Старовойтова І. Ю.Усі уроки хімії. 8 клас / І. Ю. Старовойтова, О. В. Люсай. – Х.: Вид. група «Основа», 2008. – 222, [2] с. – (Серія «12-річна школа»).
- Титаренко Н.В. Тести з неорганічної хімії. – К.: Перун, 1998.
- Хімія в побуті / За ред. Коваленка І.Р. – К., 1994.
- Хімія: Довідник для абітурієнтів та школярів загальноосвітніх навчальних закладів: навчально-методичний посібник. – Літера ЛТД, 2010. – 464 с.
- Хімія - завдання та відповіді зовнішнього незалежного оцінювання 2008 року
- Хімія - завдання та відповіді зовнішнього назалежного оцінювання 2007 року
- Хомченко Г. П. Збірник задач з хімії для вступників до вищих навчальних закладів / Г. П. Хомченко, І. Г.Хомченко; Пер. з рос. – К.: Арій, 2008. – 320 с.
- Хомченко Г. П. Посібник з хімії для вступників до вищих навчальних закладів. 2-ге вид. вмправл. / Пер. з рос. – К.: Арій, 2008. – 480 с.: іл.
- Царьова Н. Хімія 8: Збірник рівневих завдань. — Тернопіль, 2004.
- Ярошенко О.Г. Хімія. Підручник для 8 класу загальноосвітніх навчальних закладів. – К.: Освіта, 2008.
Інтернет-сайти:
- mon.gov.ua;
- www.elnik.kiev.ua;
- library.tup.km.ua;
- http://chemists.at.ua;
- http://school.xvatit.com;
- http://osvita.ua
![]()
1


про публікацію авторської розробки
Додати розробку























































































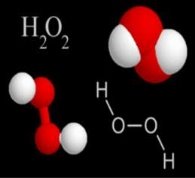
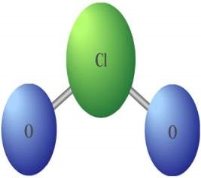
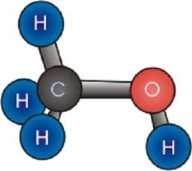
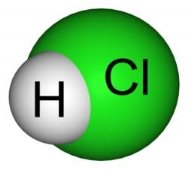











































-

Kiriyenko Olena
10.09.2023 в 11:24
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Головата Настя
28.07.2020 в 17:34
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Совпель Ольга Вікторівна
27.04.2020 в 18:12
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

фертак наталя
27.04.2020 в 15:45
Щиро вдячна за матеріал. Цікаво. Творчих успіхів
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Шумейко Марина Володимирівна
26.11.2019 в 20:44
дуже допоміг ваш матеріал. велике дякую. натхнення вам і вільного часу для нових розробок і відпочинку!!!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

шилюк ростислав
17.11.2019 в 17:38
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Ципльонок Валентина Володимирівна
26.09.2019 в 21:26
Спасибі велике за Ваш неоціненний труд!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Холина Лариса
07.09.2019 в 12:17
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Іванченко Ніна Павлівна
11.09.2018 в 21:23
дуже добре
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 6 відгуків