Презентація з хімії на тему: "Озон. Озонові дири"
Хоча людством були вжито заходи з обмеженню викидів хлор- і бромвмісних фреонів шляхом переходу на інші речовини, наприклад фторвмісні фреони (CFC), процес відновлення озонового шару триватиме декілька десятиріч. Перш за все це зумовлено величезним об'ємом вже накопичених в атмосфері фреонів, які мають час життя десятки і навіть сотні років. Тому затягування озонової діри не варто чекати раніше 2048 року.


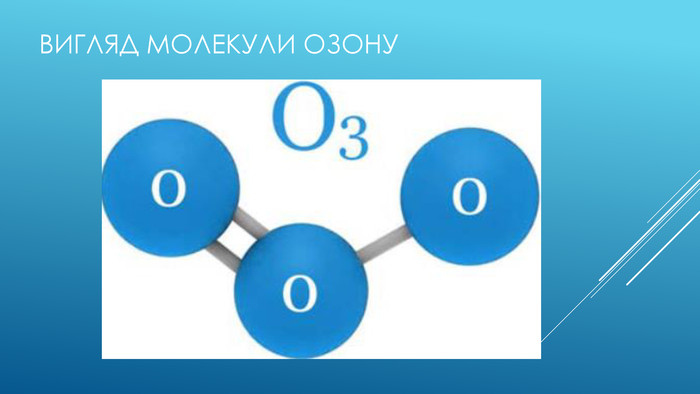








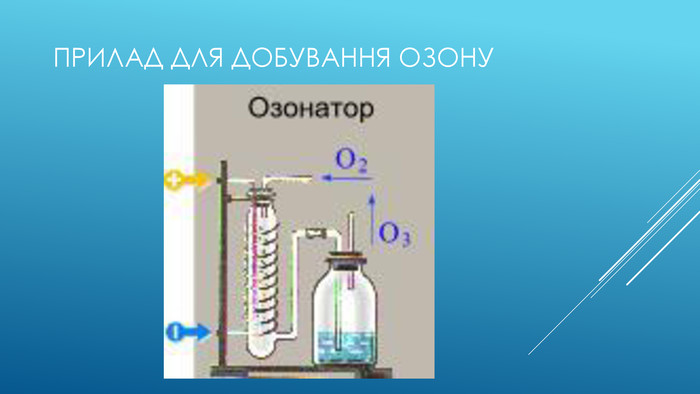

















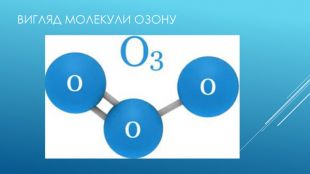
ЩО таке озон. Озо́н (з грецької той що пахне) — Алотропна модифікація кисню (О3). Тобто складається з тих самих атомів, але відрізняются хімічною будовою, і від цього проявляють різні фізичні властивості. В нижніх шарах атмосфери його вміст незначний. Найбільша його концентрація в стратосфері між висотами 10 і 40 км. Озон значно поглинає ультрафіолетове випромінюваня .
Історія відкриття. Вперше озон виявив в 1785 році голландський фізик М. ван Марум за характерним запахом і окислювальним властивостям, які набуває повітря після пропускання через нього електричних іскор. Однак як нова речовина він описаний не був, ван Марум вважав, що утворюється особлива «електрична матерія». Термін озон запропонований німецьким хіміком X. Ф. Шенбейн в 1840 році, увійшов в словники в кінці XIX століття.
Фізичні властивості озону. На відміну від кисню, який не має запаху і кольору, озон це синюватий газ з специфічним запахом схожим на білизну. В десять разів краще кисню розчиняється в воді. В рідкому стані рідина кольору індиго. В твердому стані має чорний колір з синюватим відблискоммолекулярна маса: 47,998 а.е.м .;щільність газу при нормальних умовах: 2,1445 кг / м3. щільність рідини при -183 ° C: 1571 кг / м3;температура кипіння: -111,9 ° C.температура плавлення: -197,2 ± 0,2 ° C (приводиться зазвичай -251,4 ° C помилкова, оскільки при її визначенні не враховувалася велика здатність озону до переохолодження).запах - різкий, специфічний «металевий» (за Менделєєву - «запах раків»). При великих концентраціях нагадує запах хлору. Запах відчутний навіть при розведенні 1: 100000.
Хімічні властивості озону. Хімічні властивості озону визначаються його великою здатністю до окислення. Він швидко діє на багато металоїди і на більшу частину металів; дуже чутлива реакція на ртуть, один пухирець озонованого кисню, що містить 2% за об'ємом озону, змінює виразно фізичні властивості декількох фунтів ртуті, яка втрачає тоді свій блиск і починає прилипати до скла; навіть срібло окислюється озоном, покриваючись чорним шаром пероксиду. Окисляє багато неметалів. Продуктом реакції в основному є кисень.
Деякі хімічні реакції приучасті озону. За допомогою озону можна отримати сірчану кислоту як з елементарної сірки, так і з двоокису сірки: S + H2 O + O3 - H2 SO43 SO2 + 3 H2 O + O3 - 3 H2 SO4 Озон реагує з вуглецем при нормальній температурі з утворенням двоокису вуглецю: C + 2 O3 - CO2 + 2 O2 Озон не реагує з амонієвими солями, але реагує з аміаком з утворенням нітрату амонію:2 NH3 + 4 O3 - NH4 NO3 + 4 O2 + H2 O
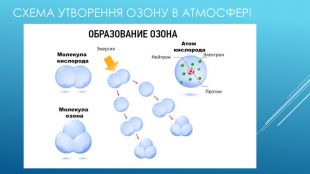
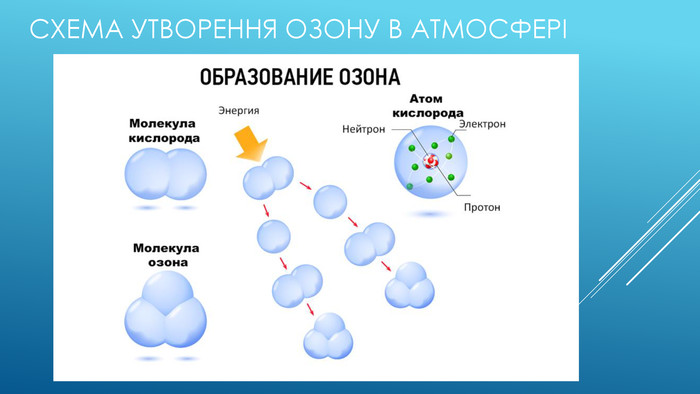
Як озон утворюється в атмосфері Озон є єдиним газом в атмосфері, який утворений за допомоги хімічної реакції. Озон утворюється коли на кисень в стратосфері діє космічна радіація, слабкі молекули кисеню розпадаються на два Оксигена і одразу ж утворюють більш стійку речовину озон. Після дощу ми не одноразово відчуваємо запах чистоти, насправді цей запах є запахом наявності озону. Під час блискавки - потужного електричного удару, кисень іонозується і перетворюється на озон.
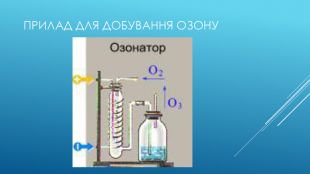
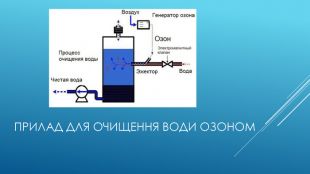
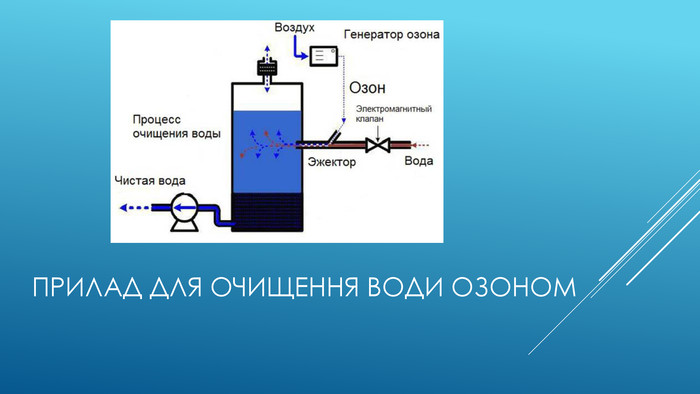
Використання озону. Застосування озону зумовлене його властивостями:1. сильного окисляє агента:для стерилізації виробів медичного призначення;при отриманні багатьох речовин в лабораторної та промислової практиці;для відбілювання паперу;для очищення олій.2. сильного дезинфікуючого засобу:для очищення води і повітря від мікроорганізмів (озонування);для дезінфекції приміщень та одягу;для озонування інфузійних розчинів застосовуються в медицині, як для внутрішньовенного, так і для контактного застосування. Одним з істотних переваг озонування, у порівнянні з хлоруванням, є відсутність токсинів після обробки, тоді як при хлоруванні можливе утворення суттєвої кількості токсинів і отрут, наприклад, діоксину.
Застосування рідкого озону. Давно розглядається застосування озону в якості високоенергетичного і разом з тим екологічно чистого окислювача в ракетній техніці. Загальна хімічна енергія, що звільняється при реакції згоряння за участю озону, більше, ніж для простого кисню приблизно на одну чверть (719 ккал / кг). Більше буде, відповідно, і питомий імпульс. У рідкого озону більшу питому вагу, ніж у рідкого кисню (1,35 і 1,14 відповідно), а його температура кипіння вище (-112 ° і -183 ° C відповідно), тому в цьому відношенні перевагу в якості окислювача в ракетній техніці більше у рідкого озону. Однак перешкодою до цього є хімічна нестійкість і вибухонебезпечність рідкого озону. При вибуху виникає рухома з величезною швидкістю - за деякими даними більше 200 км / сек - детонационная хвиля і розвивається руйнівний детонационное тиск більше 4000 атм., Що робить застосування рідкого озону неможливим при нинішньому рівні техніки.
Властивості озону в атмосферіЗдатність поглинати біологічно небезпечне ультрафіолетове випромінювання Сонця. - Озон – найсильніший окислювач (просто кажучи – отрута), тому приземний озон небезпечний. - Здатність поглинати інфрачервоне випромінювання земної поверхні. - Здатність прямим і непрямим чином впливати на хімічний склад атмосфери.
Що таке озонова діра Озо́нова діра́ — локальний спад концентрації озону в стратосфері на 10-40%. Простіше: Озонові діри - це області в озоновому шарі Землі, де вміст газу озону, що захищає планету від радіації, дуже мало. Зазвичай процес їх утворення пов`язують з діяльністю людини, але є думка, що походження озонових дір абсолютно природно.
Що таке фреони. Фрео́ни — група галогеномістких речовин (тобто, ті що містять хімічні елементи 17 групи : Флуор (F), Хлор (Cl), Бром (Br), Йод (I) і Астат (At).), що киплять при кімнатній температурі. Високолеткі, інертні біля поверхні Землі, використовуються в холодильній промисловості і як розпилювачі в аерозольних упаковках. Наприклад, фреон дифлуородихлорометан CF2 Cl2 — рідина, що кипить при -29,8°С. Фреон не отруйний, не реагує при звичайній температурі з металами; при випаровуванні його поглинається велика кількість тепла. Застосовується в холодильних машинах.
Як з’являються галогени Основні джерела галогенів( хімічні елементи групи 17, або за старою класифікацією, VII групи головної підгрупи. періодичної системи елементів: Флуор (F), Хлор (Cl), Бром (Br), Йод (I) і Астат (At).) природні, а не антропогенні(ті, що створили люди): Є думка, що природні джерела галогенів. Проте природні з'єднання менш стійкі, ніж фреони, наприклад метилхлорид (CH3 Cl) має атмосферний час життя всього порядка року, в порівнянні з десятками і сотнями років для фреонів. Тому їх внесок в руйнування стратосферного озону досить малий. Навіть рідкісне за своєю силою виверження вулкана Пінатубо в червні 1991 року викликало падіння рівня озону не за рахунок галогенів, що вивільняються, а за рахунок утворення великої маси сірчанокислих аерозолів (SO42+), поверхня яких каталізувала реакції руйнування озону. На щастя, вже через три роки практично вся маса вулканічних аерозолів була видалена з атмосфери.
Згубна дія фреонів. У стратосфері фреони піддаються фотохімічному розкладу з виділенням іонів хлору, які є каталізатором хімічних реакцій, що руйнують молекули озону. Фреони дуже важкі, щоб досягти стратосфери: Іноді стверджується, що оскільки молекули фреонів набагато важчі за азот (N2) і кисень (O2), то вони не можуть досягти стратосфери в значних кількостях. Проте атмосферні гази перемішуються повністю, а не розшаровуються або сортуються по вазі.
Історія дослідження озонових дір Озонова діра діаметром понад 1 000 км вперше була відкрита 1985 року в Південній півкулі над Антарктидою групою британських вчених. Вона з'являлася у серпні і до грудня або січня зникала. Над Північною півкулею в Арктиці утворювалася інша діра, значно менших розмірів.
Антарктична озонова діра. Антарктична «озонова діра» існує не постійно. Низькі температури антарктичної зими приводять до утворення полярного вихору. Повітря усередині цього вихору рухається здебільшого замкнутими траєкторіями навколо Південного полюса. В цей час полярна область не освітлюється Сонцем, і там озон не утворюється. З настанням літа кількість озону збільшується і знову приходить до норми. Тобто коливання концентрації озону над Антарктикою — сезонні.
Позитивні наслідки утворення озонових дір. Саме завдяки гігантської озонової діри над Антарктидою гальмується процес нагрівання планети. Втім, в даний час озоновий шар на півдні Землі відновлюється та швидкість вітру там знижується. Грунтуючись на цій інформації, фахівці прогнозують поступове потепління в Південній півкулі. Такі висновки зроблені на основі даних метеорологів, що збиралися протягом 20 років. Як стверджують фахівці Наукового комітету досліджень Антарктиди (SCAR), події дійсно пішли б за найпесимістичнішим сценарієм, якби не та сама озонова діра. Але тепер вона, як згадано вище, скорочується, і це може посприяти прискоренню потепління.
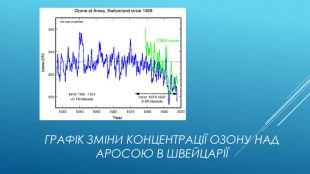
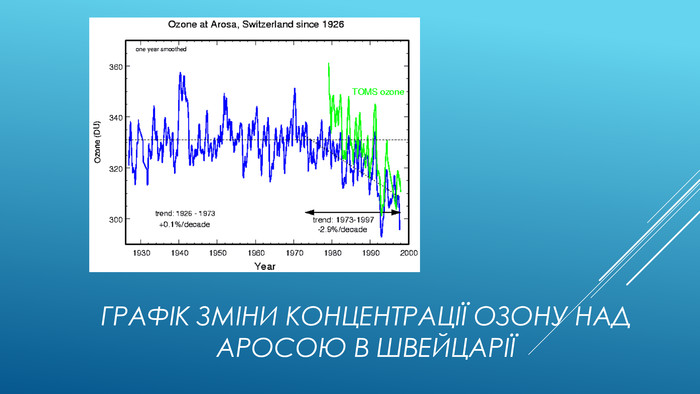
Упередження стосовно озоновових дір. Озонова діра повинна розташовуватися над джерелами фреонів: Багато хто не розуміє, чому озонова діра утворюється в Антарктиці, у той час як основні викиди фреонів відбуваються в Північній півкулі. Річ у тому, що фреони добре перемішані в тропосфері і стратосфері. З причини малої реакційної здатності вони практично не витрачаються в нижніх шарах атмосфери і мають термін життя в декілька років або навіть десятиріччя. Тому вони легко досягають верхніх шарів атмосфери. Зруйнуємо міф: Озон руйнується тільки над Антарктикою: Це неправильно, бо рівень озону падає всюди. Це показують результати довготривалих вимірювань концентрації в різних точках планети. Ви можете подивитися на графік зміни концентрації озону над Аросою в Швейцарії на наступному слайді.
Як відновлюють озон в стратосферіХоча людством були вжито заходи з обмеженню викидів хлор- і бромвмісних фреонів шляхом переходу на інші речовини, наприклад фторвмісні фреони (CFC), процес відновлення озонового шару триватиме декілька десятиріч. Перш за все це зумовлено величезним об'ємом вже накопичених в атмосфері фреонів, які мають час життя десятки і навіть сотні років. Тому затягування озонової діри не варто чекати раніше 2048 року.


про публікацію авторської розробки
Додати розробку