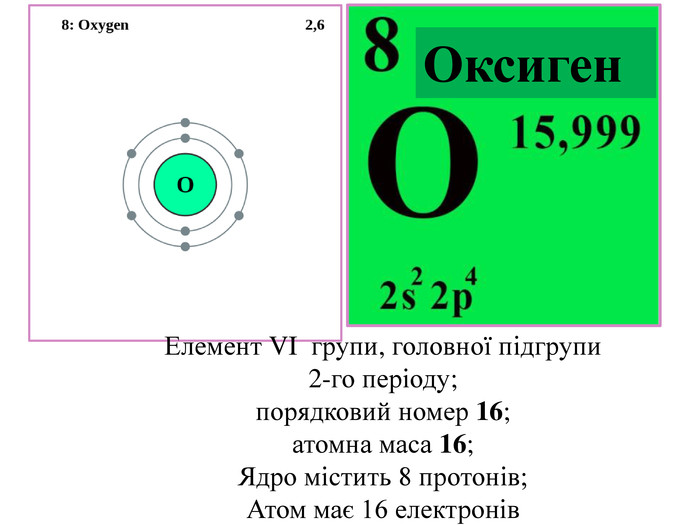
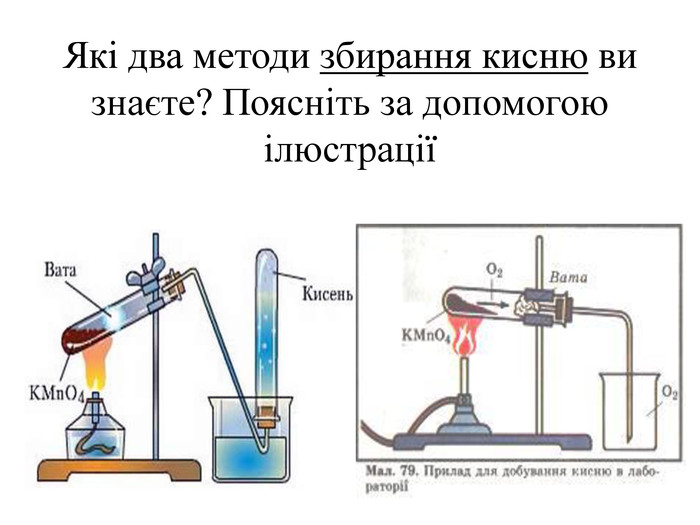
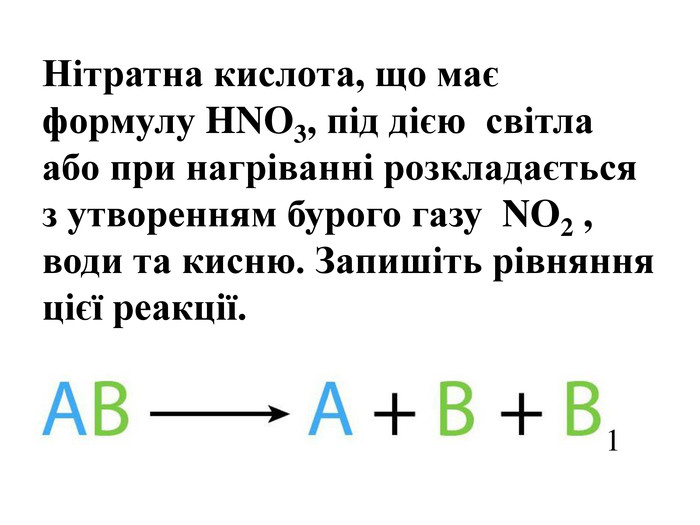
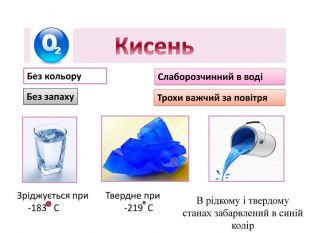
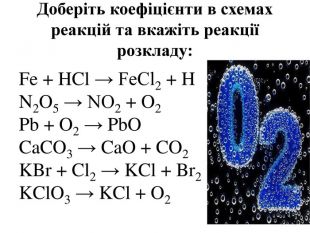
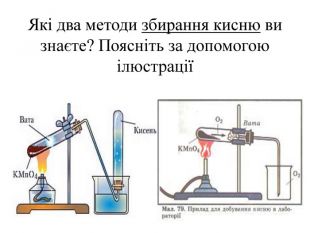
Добування кисню у лабораторії
Про матеріал
Готова презентація, з допомогою якої, вам, дорогі вчителі, легко провести урок узагальнення знань із теми "Добування та збирання кисню." Презентація унаочнена схемами та малюнками. Використано завдання різного рівня складності.
Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку