«Дослідження природніх об’єктів в якості кислотно-основних індикаторів»
ПРОЄКТ
з хімії на тему:
 «Дослідження природніх об’єктів в якості кислотно-основних індикаторів»
«Дослідження природніх об’єктів в якості кислотно-основних індикаторів»
Підготував роботу:
учень 9 класу
Угорського НВК
Чорнобай Артем.
2020р.
Тема: Дослідження природніх об’єктів в якості кислотно-основних індикаторів.
Мета: дослідити природні об’єкти у якості кислотно основних індикаторів.
Хід роботи:
План:
- Повідомлення про кислотно-основні індикатори;
- Таблиця К.-о.і.;
- Зміна забарвлення К.-о.і.;
- Підрозділяння К.- о.і.;
- Концентрація К.- о.і.;
- Висновок.
 1.КИСЛОТНО-ОСНОВНІ ІНДИКАТОРИ (рН-індикатори) — речовини, які змінюють забарвлення залежно від рН середовища. Застосовуються для фіксування кінця реакції між кислотами та основами (в основному в кислотно-основному титруванні) та інших реакцій, що супроводжуються зміною концентрації Н+-іонів, а також для вимірювання рН-середовища колориметрично. К.-о.і. мають відповідати таким вимогам: 1) забарвлення індикатора при різних значеннях рН повинно чітко розрізнятися; 2) зміна забарвлення індикатора має відбуватися у чітко визначеному вузькому інтервалі значень рН; 3) забарвлення індикатора повинно бути інтенсивним; 4) кількість титранту, необхідного для зміни забарвлення індикатора, має бути настільки малою, щоб не спотворювати результати титрування; 5) зміна забарвлення індикатора повинна мати оборотний характер.
1.КИСЛОТНО-ОСНОВНІ ІНДИКАТОРИ (рН-індикатори) — речовини, які змінюють забарвлення залежно від рН середовища. Застосовуються для фіксування кінця реакції між кислотами та основами (в основному в кислотно-основному титруванні) та інших реакцій, що супроводжуються зміною концентрації Н+-іонів, а також для вимірювання рН-середовища колориметрично. К.-о.і. мають відповідати таким вимогам: 1) забарвлення індикатора при різних значеннях рН повинно чітко розрізнятися; 2) зміна забарвлення індикатора має відбуватися у чітко визначеному вузькому інтервалі значень рН; 3) забарвлення індикатора повинно бути інтенсивним; 4) кількість титранту, необхідного для зміни забарвлення індикатора, має бути настільки малою, щоб не спотворювати результати титрування; 5) зміна забарвлення індикатора повинна мати оборотний характер.
-
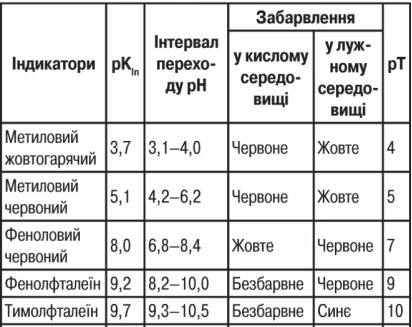
 Найважливіші К.-о.і. наведені в таблиці.
Найважливіші К.-о.і. наведені в таблиці.
К.-о.і. — слабкі органічні кислоти або основи, що становлять супряжену пару, кислотна та основна форма яких розрізняється за кольором. К.-о.і. — більш слабкі кислоти чи основи, ніж речовини, що титруються, тому вони вступають у реакцію з титрантом після того, як основна маса аналізованої речовини вже прореагує.
3. Зміна забарвлення К.-о.і. пов’язана зі зміною структури їх молекул у зв’язку з віддачею чи приєднанням Н+-іонів — появою нових хромоформних груп або їх заміною. У водному розчині К.-о.і. існує рухома рівновага: Ina+Н2O 2arrow.eps Inв+Н3O+, де Ina, Inв — кисла та основна форма К.-о.і., забарвлених по-різному. Константа рівноваги процесу дисоціації KIn=[Inв]∙[Н3O+]/[Ina] називається константою К.-о.і. Забарвлення розчину визначається співвідношенням [Inв]/[Ina]. Вважають, що колір однієї форми К.-о.і. превалює, якщо її концентрація в 10 разів вища, ніж іншої форми, тобто відношення [Inв]/[Ina]=[Н3O+]/KIn становить 0,1 чи 10 або при значенні рН=KIn±1. Значення рН, при якому відбувається зміна забарвлення К.-о.і., називається інтервалом переходу К.-о.і. Значення рН, при якому перехід забарвлення найбільш виразний, тобто той момент, коли титрування закінчується, називається показником титрування рТ, який не є точною характеристикою індикатора, а його величина близька до рKIn і знаходиться приблизно посередині інтервалу переходу індикатора. Для кислотно-основного титрування вибирають К.-о.і., у якого інтервал переходу включає значення рН у точці еквівалентності. Якщо це значення відрізняється від рТ К.-о.і., то виникає індикаторна помилка, тобто К.-о.і. змінює забарвлення дещо раніше чи пізніше за точку еквівалентності. 
4.К.-о.і. підрозділяють на: чутливі до кислот — інтервал переходу знаходиться в лужному середовищі (фенолфталеїн, алізариновий жовтий, тимолфталеїн); чутливі до основ — інтервал переходу — у кислому середовищі (метиловий жовтогарячий, бромфеноловий синій); чутливі до кислот і основ або нейтральні індикатори — інтервал переходу — в нейтральному середовищі (бромтимоловий синій, нейтральний червоний). При визначенні сильних кислот або основ використовуються практично будь-які К.-о.і., слабких кислот — К,-о.і., чутливі до кислот; слабких основ — К.-о.і., чутливі до основ. Для збільшення чіткості переходу забарвлення К.-о.і. застосовують змішані індикатори — суміші двох індикаторів, кольори яких доповнюють один одного (тимоловий синій, фенолфталеїн) або суміші індикатора і нейтрального барвника, що не змінює свого забарвлення при різних значеннях рН (нейтральний червоний, метиленовий синій).
Для визначення рН розчинів використовують універсальні К.-о.і. (суміші К.-о.і.), які змінюють своє забарвлення у межах 1–14 одиниць рН.
 Забарвлення К.-о.і. залежить від його концентрації, концентрації СО2 у розчині, природи розчинника, температури, присутності індиферентних електролітів, колоїдних часток тощо. Як К.-о.і. використовують індикатори, які змінюють забарвлення та інтенсивність флуоресценції залежно від рН-середовища; індикатори помутніння — речовини, що утворюють оборотні колоїди, які коагулюють у вузькому інтервалі рН; іон-обмінні смоли, адсорбати-барвники, радіоактивні ізотопи тощо. При титруванні у неводних розчинниках поряд з електрометричним визначенням кінцевої точки титрування використовують К.-о.і. При аналізі основ частіше використовують кристалічний фіолетовий у безводній СН3СООН, нейтральний червоний в етанолі; при визначенні кислот — бромтимоловий синій у метанолі, о-нітроанілін у бензолі.
Забарвлення К.-о.і. залежить від його концентрації, концентрації СО2 у розчині, природи розчинника, температури, присутності індиферентних електролітів, колоїдних часток тощо. Як К.-о.і. використовують індикатори, які змінюють забарвлення та інтенсивність флуоресценції залежно від рН-середовища; індикатори помутніння — речовини, що утворюють оборотні колоїди, які коагулюють у вузькому інтервалі рН; іон-обмінні смоли, адсорбати-барвники, радіоактивні ізотопи тощо. При титруванні у неводних розчинниках поряд з електрометричним визначенням кінцевої точки титрування використовують К.-о.і. При аналізі основ частіше використовують кристалічний фіолетовий у безводній СН3СООН, нейтральний червоний в етанолі; при визначенні кислот — бромтимоловий синій у метанолі, о-нітроанілін у бензолі.
К.-о.і. широко використовують для кількісного визначення ЛП: розчину амоніаку концентрованого, аргініну, валіну, галоперидолу, діазепаму тощо.
Джерела інформації: сайт:
https://www.pharmencyclopedia.com.ua/article/3549/kislotno-osnovni-indikatori
Висновок: дослідив природні об’єкти у якості кислотно основних індикаторів.


про публікацію авторської розробки
Додати розробку
