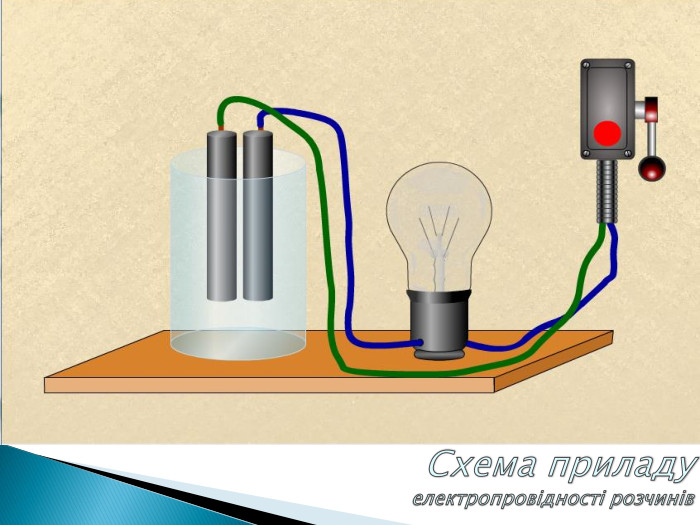
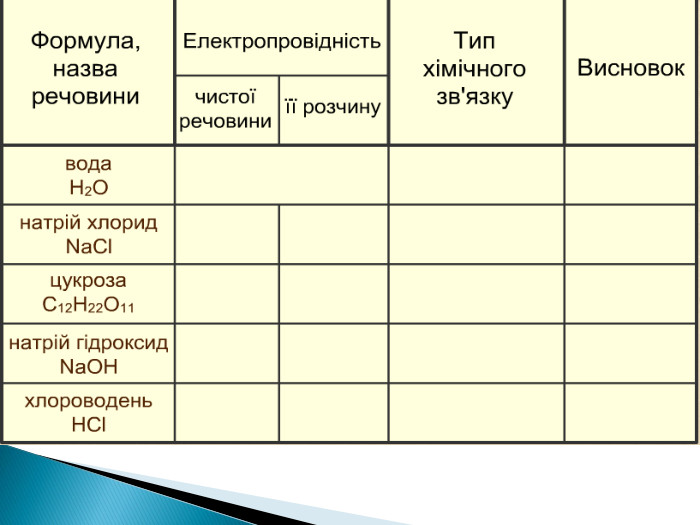
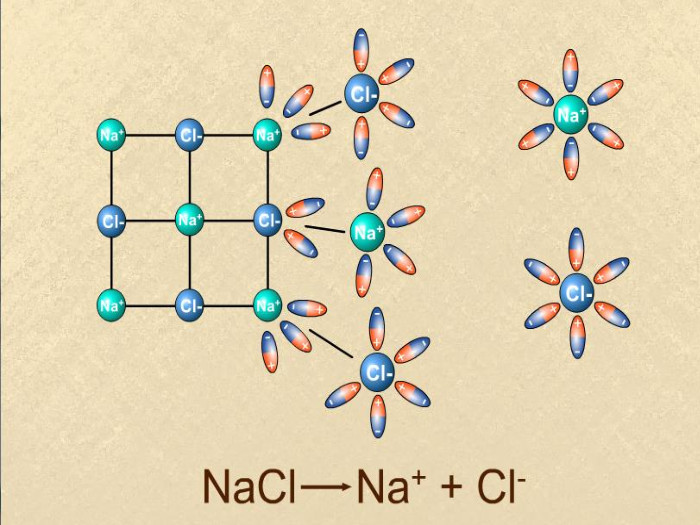
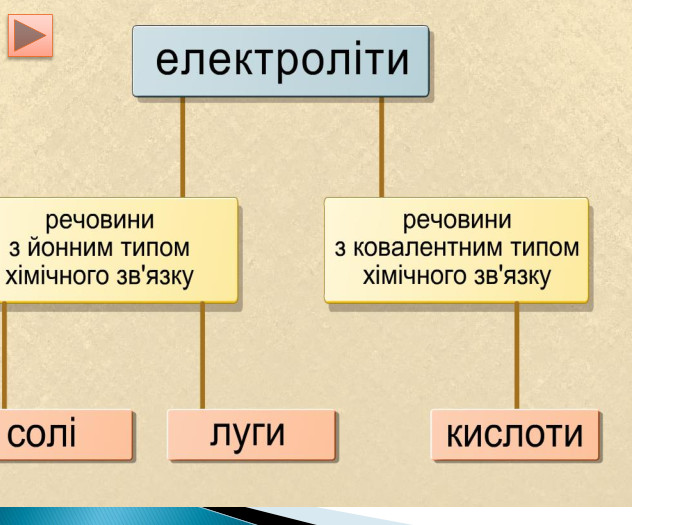
Електроліти,неелектроліти .Теорія електролітичної дисоціації.
Про матеріал
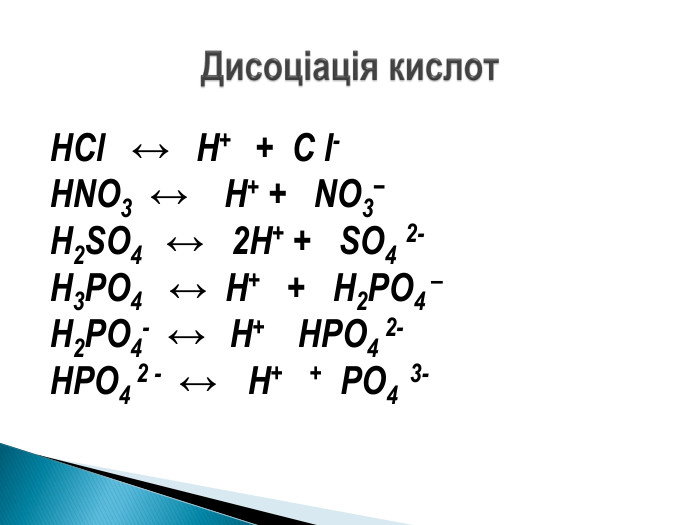
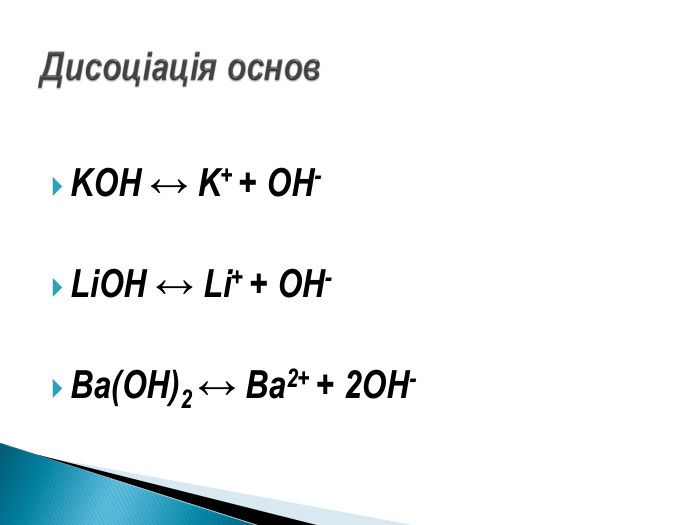
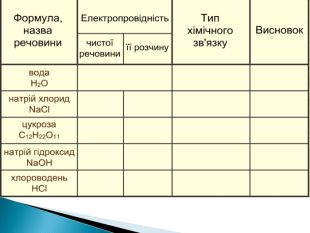
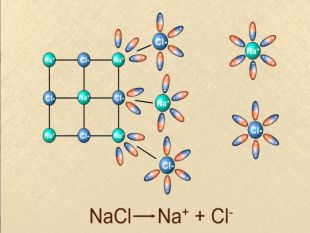
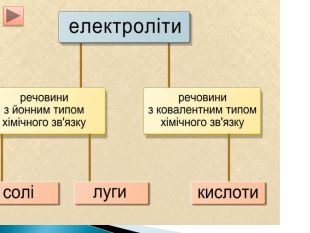
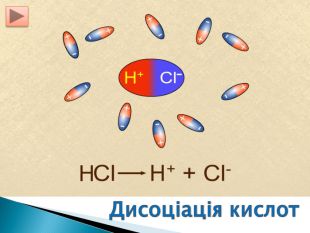
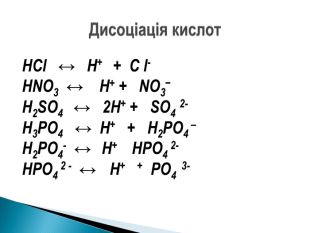
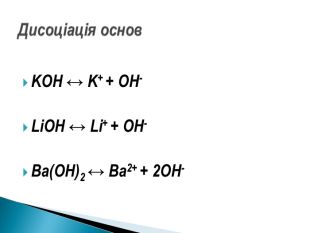
Презентація ознайомить учнів з етапами розвитку теорії електролітичної дисоціації, допоможе засвоїти основні положення теорії, сформульовані С.Арреніусом, з’ясувати , що являють собою кислоти, основи , солі з погляду теорії електролітичної дисоціації. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку