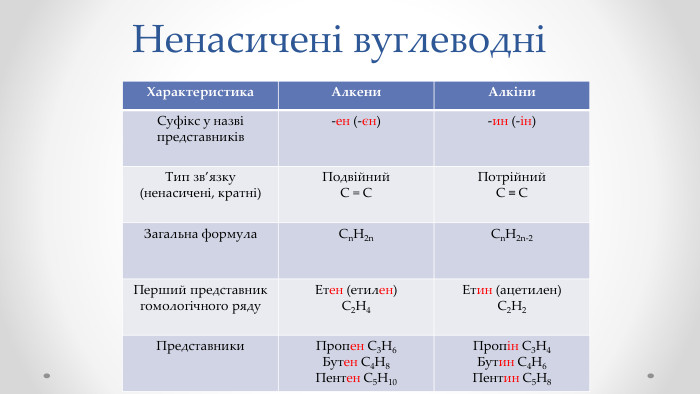
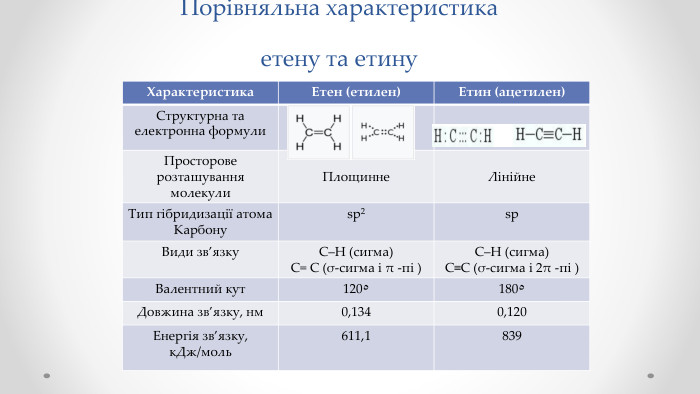
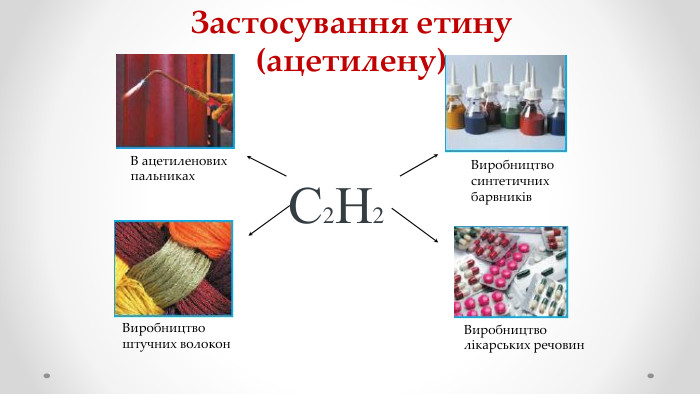
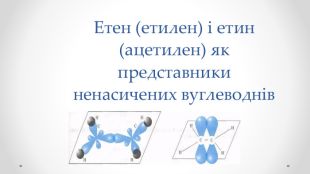
Етен (етилен) і етин (ацетилен) як представники ненасичених вуглеводнів
Про матеріал
Розробка уроку містить інформаційний матеріал з теми "Етен (етилен) і етин (ацетилен) як представники ненасичених вуглеводнів" Перегляд файлу
Зміст слайдів
pptx
До підручника
Хімія 9 клас (Березан О.В.)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку