План-конспект уроку з хімії за темою «Значення окисно-відновних процесів у житті людини, природі й техніці»
Посилання на інтерактивний аркуш wizer.me https://app.wizer.me/learn/4DZ03H
План-конспект уроку з хімії за темою
«Значення окисно-відновних процесів у житті людини, природі й техніці»
(9 клас)
Тема: Значення окисно-відновних процесів у житті людини, природі й техніці
Мета: удосконалювати навички складання рівнянь окисно-відновних реакцій методом електронного балансу; з'ясувати практичне значення окисно-відновних реакцій у природі , в живих організмах промисловості;
розвивати в учнів навички розумових дій: наочно-образної, індукції, рефлексії, абстрагування, уміння працювати з інформацією; формування умінь працювати у співпраці; аналізувати і критично оцінювати соціально-економічні події; формувати екологічну грамотність та культуру, ціннісне ставлення до власного здоров'я, виховувати в учнів прагнення до саморозвитку та самореалізації. Розглянути особливість науково-технічного прогресу з позиції охорони довкілля.
Тип уроку: засвоєння умінь та навичок учнів Форма проведення уроку: Творча майстерня.
Обладнання: роздатковий матеріал.
Хід уроку
1. Мотивація навчальної діяльності І. Організаційний етап.
1. Емоційне налаштування на урок. - У народі існує думка: якщо посміхнутися перехожому – він усміхнеться у відповідь. Якщо посміхнутися небу – розійдуться хмари і засвітить сонце. Якщо посміхнутися Всесвіту – трапиться щось казкове. Тож давайте посміхнемося один одному, щоб нас чекав успіх на уроці.
ІІ. Актуалізація опорних знань учнів.
Проблемне питання: А що було б, якби зникли окисно –відновні реакції?
1. Бліц-опитування.
1. За якими ознаками класифікують хімічні реакції?
2. Що таке вихідні речовини і продукти хімічної реакції?
3. Які реакції називаються реакціями сполучення?
4. Які реакції називаються реакціями розкладу?
5. Які реакції називаються реакціями заміщення?
6. Які реакції називаються реакціями обміну?
7. Що таке ступінь окиснення?
8. Які реакції називаються окисно-відновними?
9. Що таке відновник?
10. Що таке окисник?
11. Коли ступінь окиснення понижується?
12. Коли ступінь окиснення підвищується?
13. Що таке електронегативність?
14. Які є типи хімічного зв’язку?
2. Навчальна гра «Редактор»
Вставити недостаючи факти в місця пропусків (Відповіді на завдання пов’язані з цікавими фактами з курсу біології).
а) Fe+2....... → Fe+3(кількість електронів, відданих або прийнятих в представленому рівнянні відповідає тій кількості сантиметрів, на яку людина стає нижче до вечора через стиснення суглобів протягом дня) (1 см, -1е-)
б) Mn +2....... → Mn +6(кількість електронів, відданих або прийнятих в представленому рівнянні відповідає числу міліметрів, які складають довжину найкоротшої кістки в тілі людини. Стремінце-кісточка, яка передає коливання барабанної перетинки до чутливих клітин внутрішнього вуха) (4 мм, -4е-)
в) Cl2 0....... → 2Cl -1 (кількість електронів, відданих або прийнятих в представленому рівнянні відповідає загальній вазі (в кілограмах) бактерій, що живуть в організмі людини) (2 кг, + 2е-)
3. Яка з реакцій наведених нижче є окисно-відновною? Доведіть чому?
HClO3 → HClO2 + HCl
HClO3→ HClO4 + HCl
Електрон завоював фізику, а потім і хімію, ставши для цієї науки майже ідолом. Окисно-відновні реакції знаходяться у владі електронних переходів від одного атома до іншого як всередині молекули, так і між молекулами.
Переміщення електронів супроводжується змінами ступеня окислення атомів, що беруть участь в цих процесах.
ІІІ. Повідомлення теми, мети уроку.
1. Повідомлення теми уроку.
2. Інтерактивна вправа «Відкритий мікрофон»
Постановка завдань та мети уроку учнями з корекцією вчителя.
Окисно-відновні реакції відіграють величезну роль в природі і техніці. Без цих реакцій неможливе життя. Дихання, обмін речовин, синтез рослинами клітковини з вуглекислого газу і води - усе це окислювально-відновні процеси. У техніці за допомогою реакцій цього типу отримують такі важливі речовини, як аміак (NH3), сульфатну (H2SO4) і хлорну (HCl) кислоти і багато інших продуктів. Усі реакції горіння є окислювально-відновними.
У живих організмах можуть відбуватися й небажані процеси окиснення, наслідком чого можуть бути мутації ДНК та захворювання, зокрема рак.
Що пророкують експерти - ріст числа хворих до 70%.
4 основні фактори ризику:
1. Куріння
2. Специфічне харчування та ожиріння
3. Споживання алкоголю
4. Брак фізичної активності
Для запобігання цьому існують речовини-антиоксиданти, що виявляють відновні властивості. Вони взаємодіють з надлишковими окисниками в організмі й «нейтралізують» їх. Найпоширенішим антиоксидантом є вітамін С.
Більшість хімічних реакцій, що відбуваються в природі - окисно-відновні.
ІІІ. Первинне застосування отриманих знань і умінь.
1. Інтерактивний метод «Кейс-метод»
Об'єднання учнів у групи (5-6 учнів), розподіл обов’язків між членами груп, або індивідуальна робота з кейсом.
Опрацювати матеріали кейсу та виконати завдання до нього (письмово).
КЕЙС №1 Окисно-відновні реакції у природі
Що спільного між такими процесами, як виверження вулканів, згоряння метеоритних тіл, грозові розряди в атмосфері? (завжди супроводжувалися окисновідновними реакціями).
Гроза - одне з небезпечних, якщо не найнебезпечніше, явище погоди. На земній кулі 44000 гроз у добу або 1800 гроз на рік, а кожну хвилину виблискує 100 блискавок. Енергія всіх гроз складає одну тисячу частин цієї енергії, яка йде на
землю від сонця.
Потужна гроза може принести з собою до мільярда кубометрів води, але лише мала частина вологи випадає на землю у вигляді опадів. Все інше залишається в атмосфері, коли грозові хмари розсіюються. Під час погрози температура в зоні електричного розряду становить 2000 °С, внаслідок чого азот і кисень, що знаходяться у повітрі, взаємодіють між собою. Утворюється нітроген (ІІ) оксид. Однак продукт цієї реакції є не стійкою речовиною й легко розкладається на реагенті.
Н 2 + O 2 → НІ Грози відбуваються не тільки на Землі, а й на інших планетах з досить щільними для цієї атмосфери. На газових гігантах, таких як Сатурн і Юпітер, вони взагалі можуть досягти неймовірних масштабів.
Джерело: https://interes-fakti.com/cikavi-fakti-pro-grozu/
Виверження вулканів є стихійним лихом для всього живого.Вони руйнують міста, перетворюють рельєф, зростають на грунтово-рослинний покрив і змінюють ландшафт, а також ресурс геологічного простору загалом. З вулканічною активністю багато дослідників пов'язують епоху зледеніння четвертого періоду й навіть розглядають її як одну з причин переходу від людиноподібної мавпи до
людини.
Вулканічний попіл містить потрібні рослинам поживні елементи (Ν, Р, К, S) і за рахунок своєї консистенції швидко перемішується з ґрунтом. Фермери в Індонезії, Японії, Італії та на Філіппінах навіть за постійної загрози раптових вивержень відмовляються від переїзду з місцевостей поблизу вулканів.
Склад вулканічних газів різний у різних вулканів, переважно вони містять (за зменшенням концентрації) водяну пару, оксиди Карбону(ІІ), Карбону(ІV), Сульфуру(ІV), Сульфуру(VІ), Нітрогену(ІV), сірку, гідроген сульфід, гідроген хлорид, гідроген флуорид, водень, метан, аргон.
Під час виверження вулкана відбувається низка хімічних реакцій, зокрема: кальцій карбонат ![]() кальцій оксид + ... ↑; магній карбонат
кальцій оксид + ... ↑; магній карбонат ![]() ... + карбон(IV) оксид↑; карбон(ІV) оксид + вода карбонатна кислота; водень + кисень —>... ; сульфур(ІV) оксид + кисень —> сульфур(VІ) оксид, ; сірка + кисень —> сульфур(IV) оксид, ; сірка + водень
... + карбон(IV) оксид↑; карбон(ІV) оксид + вода карбонатна кислота; водень + кисень —>... ; сульфур(ІV) оксид + кисень —> сульфур(VІ) оксид, ; сірка + кисень —> сульфур(IV) оксид, ; сірка + водень ![]() гідроген сульфід; гідроген сульфід + кисень —> сірка + вода; сульфур(ІV) оксид + вода
гідроген сульфід; гідроген сульфід + кисень —> сірка + вода; сульфур(ІV) оксид + вода ![]() ...;
...;
сульфур(VІ) оксид + вода ![]() ... ;
... ;
сульфур(ІV) оксид + гідроген сульфід —> сірка + вода; нітроген(ІV) оксид + вода —> нітратна кислота + нітритна кислота.
Перетворіть схеми реакцій на хімічні рівняння. Класифікуйте реакцію за повною ознакою. Для окисно-відновних реакцій складіть електронний баланс, зазначте окисник і відновник. Складіть повні й скорочені йонні рівняння між електролітами в розчинах. Яка ще реакція між речовинами — складниками вулканічних газів? Складіть відповідні хімічні рівняння.
Внаслідок вулканічних вивержень у стратосфері утворюється аерозоль сульфатної кислоти, на поверхні якого руйнується озон. У бульбашках повітря, заморожених у товщу антарктичного льоду, українські дослідники виявили речовини, подібні за складом до промислових фреонів (флуорохлоровуглеводнів) у концентраціях, які можна порівнювати із сучасною. Однак їхнє залягання відповідало глибині періоду тисячолітньої давності.
Поясніть, про наявність аерозолів сульфатної кислоти в товщах антарктичних льодів.
З травня 2018 року активний вулкан Кілауеа став причиною масових руйнувань на Великому острові (Гаваї). Виверження вулкана викликало рясні кислотні дощі та
змог.  Вог - вулканічний смог.
Вог - вулканічний смог.
Джерело: https://uahistory.co/pidruchniki/gilberg-natural-sciences-11-class-2019-part2/13.php
КЕЙС №2
Горіння та гниття. У житті ми дуже часто зустрічаємося з процесами горінням та гниття: розпалюємо багаття в лісі, спалюємо природний газ або дрова в печі; стикаємося з гнилими овочами та фруктами.
Гниття також є окисно-відновним процесом, що відбувається за участь бактерій. У результаті гниття виділяється енергія, необхідна для життєдіяльності цих бактерій. Мільйони років тому завдяки цим процесам сформувалися корисні копалини, якби не процес гниття нашої земної кулі була вкрита мертвими організмами шаром у 8 м завтовшки.
Як тільки люди навчилися добувати вогонь, він став для них символом життя. У первісних людей вогонь був "батьком, хранителем і рятівником племені". Сьогодні ми отримуємо вогонь за допомогою простого сірника. До складу голівки сірника входить сірка, а на бічній стінці коробки - суміш червоного фосфору з KClO3.
Шкірний розрив мій окислювально-відновні реакції:
P+KClO3→ P2 O5+ KCl
S+ KClO3→ KCl+SO2
Не завжди взаємодія речовин із киснем супроводжується горінням, але при цьому завжди виділяється теплота. Такі процеси називаються повільним окисненням. Прикладами повного окиснення є:
- іржавіння заліза: залізні предмети з часом покриваються іржею – продуктом повного окиснення металу киснем повітря ,
- потемніння металевих виробів;
- скидання молока, або соку
- якщо залізти у свіжий стіг сіна, то можна відчути теплоту та запах речовини, що виділяється під час припинення вологої трави. Відтік тепла ускладнений у великих купах, тоді гніюча речовина сильно розігрівається.
- у парниках як джерело тепла використовується повне окиснення гною. - у кам'яновугільних шахтах, незважаючи на посилення вентиляції, завжди збільшується вміст вуглекислого газу, який утворюється там за рахунок повного окиснення вугілля.
- в організмі людини,тварин теж відбувається процес повного окиснення, це процес окиснення поживних речовин (їжі) в організмі;
При цих процесах горіння не відбувається. Це безкисневе горіння, тобто хімічна реакція з виділенням тепла , але без кисню.
Повільне окиснення здатне за певних умов перейти в горіння. Тліючий сірник, кинутий у лісі, може стати причиною великої пожежі. На підприємствах просочене машинним маслом ганчір'я після обтирання верстатів заборонено накопичувати в купах. У середній такій купі процеси повного окиснення з виділенням тепла настільної купи настільки підвищують температуру, яка може відбутися самозайматися.
З вогнем жартувати не можна, необхідно обережно і дбайливо поводитися з ним, тому що його сила не лише творити, але і руйнує, здатна згубити все живе. Бродіння — ще один приклад природних окисно-відновних реакцій. Цей процес відбувається для участі грибів, які таким чином отримують необхідну енергію. Людина використовує бродіння для виготовлення квашених овочів, дріжджового тіста, кисломолочних продуктів, сиру, пива тощо.
Урівнюйте методом електронного балансу та розставте коефіцієнти в таких окісно-відновних процесах:
а) Вироби зі срібла у разі зберігання протягом тривалого часу тьмяніють внаслідок утворення на поверхні нерозчинного арґентуму (І) сульфіду чорного кольору. Відновити блиск срібла можна кип'ятінням виробу в розчині соди разом з алюмінієвою фольгою. Яка речовина в цьому випадку буде окисником, а яка — відновником?
Потемніння срібних виробів:
Ag + H2S + O2 → Ag2S + H2O;
б) Відновлення блиску срібла :
Аg2 S +Al+NaOH+H2 O →Ag+Na[Al(OH)4] + NaHS в) Знезараження овочесховища:
H2S + O2 → S + H2O;
г) Рівнянська реакція, що відображає процес горіння метану
СН4 + O2 → CO2 ↑ + H2O
КЕЙС №3
Піротехніка
Окисно-відновні реакції підлягають застосуванню і у військових цілях для виготовлення зброї, снарядів, сигнальних ракет і запальних сумішей, виготовлення вогнетривких матеріалів, техніки і так
далі. 
З давніх-давен людей приваблює вогонь. Багато народів надають особливе, священне значення вогнищам і феєрверкам. Салюти стали невід'ємною частиною виконання багатьох ритуалів і традицій. День народження, весілля і взагалі, будьяке свято стає особливим, незабутнім, коли в небі розцвітають різнокольорові магічні вогні. Усі затамовують подих і захоплено дивляться в небо, відбувається захоплююче дійство.
Порох - основний компонент феєрверку, це багатокомпонентна тверда вибухова суміш, здатна до закономірного горіння паралельними шарами без доступу кисню ззовні з утворенням газоподібних продуктів, енергія яких використовується для метання снарядів, руху ракети.
Порох був винайдений в Китаї більше тисячі років тому, там же зародилося мистецтво управління вогнем - піротехніка. Даоські ченці в 9 столітті, займаючись пошуками еліксиру безсмертя, змішували різноманітні компоненти і випадково отримали чорний легко займистий порошок, в даний час відомий як димний порох. Цей порошок - основний компонент усіх феєрверків. Формула чарівної речовини не змінюється вже багато століть.
Порох складається із суміші калієвої селітри, деревного вугілля і сірки у ваговому співвідношенні 75:15:10. Мабуть, чорний порох залишається практично єдиною хімічною сумішшю , в такій же пропорції і яка виготовляється за такою ж технологією, як і в часі Колумба.
Колір феєрверку залежить від спалювання елементів різних металів. Згоряння різних елементів породжує різні кольори. Наприклад, барій горить зеленим полум'ям, натрій — жовтим, літій і стронцій — червоним.
Піротехніки можуть створювати різні звуки феєрверку. Наприклад, алюмінієва і залізна стружки можуть створювати шиплячі звуки, а титановий порошок — високий вибух. Найскладніший для створення піротехнікою колір — це синій. Також через багато століть ніхто не зміг придумати ідеальний спосіб створення яскраво-синього феєрверку. У той же час отримати червоного, зеленого, оранжевого і білого кольорів дуже просто....
Однак рідко такі забавки призводять до трагічних наслідків.
Аби святкові веселощі та радість не обернулися на біду, необхідно бути гранично обережними під час використання піротехнічних виробів, неухильно дотримуючись заходів безпеки. Пам'ятайте, що окрім матеріальних збитків, можливої пожежі, можуть статися більш трагічні наслідки – травмування та загибель людей.
Завдання до Кейс 3
Побудуйте свою відповідь за планом:
Яка реакція називається окисно-відновними.
Визначте число відданих електронів у наступних перетвореннях:
Mg0 → Mg +2
Fe0→ Fe +3
K0 → K +1
Визначити ступінь окиснення елементів у сполуках:
K2S; N2; SiO2; Zn(NO3)2NH3; H2; NaCl; Fe2(SO4)3
● Урівняйте методом електронного балансу та розставте коефіцієнти в таких окисно-відновних процесах:
Основні окислювально-відновні реакції, використовувані в піротехніці а) Реакція горіння чорного пороху :
KNO3 + C + S→N2 + CO2 + K2S
б) Реакція горіння активних металів (бенгальські )
Mg+O2 → MgO
КЕЙС №4
https://youtu.be/21Q2CW1OJAw?si=VcsvyA8Mt-kzMdDY
ІСТОРІЯ ЗАСТОСУВАННЯ ХІМІЧНОЇ ЗБРОЇ
Хімічна зброя — це хімічна зброя масового пошкодження, розроблена урядом для військового використання; містять токсичні речовини (які призначені для спричинення серйозної шкоди здоров’ю або смерті).

Токсичні речовини, що застосовуються в хімічній війні, поділяються на 4 основні класи:
- Речовини, що мають нервово-паралітичну дію
- Інгаляційні речовини
- Системні асфіксанти (отруйні речовини загальноотруйної дії)
- Везиканти (отруйні речовини шкірно-наривної дії).
 Зарин — це створений людиною бойовий хімічний агент, який класифікується як нервово-паралітична речовина. Він представляє собою прозору, безбарвну рідину, яка в чистому вигляді не має запаху та смаку. Однак зарин може перетворюватися в пару (газ) і поширюватися в навколишнє середовище.
Зарин — це створений людиною бойовий хімічний агент, який класифікується як нервово-паралітична речовина. Він представляє собою прозору, безбарвну рідину, яка в чистому вигляді не має запаху та смаку. Однак зарин може перетворюватися в пару (газ) і поширюватися в навколишнє середовище.
Вона може вражати людину як при пропуску на витрати, так і при вдиханні парів.
Ця речовина є смертельною — якщо залишити одну маленьку краплинку на продаж, може бути достатньо для того, щоб людина померла.
У Сирії люди не розуміють, що почалася хімічна атака
Досвід Сирії, коли російська армія використовувала нервово-паралітичні речовини, показав, що люди не розуміють, що почалася хімічна атака до того моменту, коли в них вже не почалися симптоми. Тому це і є велика проблема. Сигнал хімічної атаки — один гудок короткий, а другий довгий
Треба розуміти, що сигнал хімічної тривоги дають тоді, коли вже буде виявлена хімічна атака.
Подається хімічна зброя за допомогою ракет (крилаті або балістичні), снарядів артилерійських, але вони відрізняються від звичайних. Звичайні вибухають сильно, руйнують будівлю і вбивають людей за рахунок вибуху. Хімічні ракети вибухають слабше. Звук вибуху слабкий, тому що вони створені не для руйнування, а для того, щоб розбризкати зарин у вигляді аерозолю. Тому характер вибухів теж може свідчити про те, що щось тут не так.
Масова загибель малих тварин, птахів і комах — ознака хімічної атаки Важливий фактор, який помічали люди також і в Сирії: масова загибель малих тварин, птахів і комах, тому що ці тварини мають малу масу тіла і будуть гинути першими, ще до того, поки люди почнуть мати симптоми.
Останній фактор – масовий прояв ознак отруєння нервово-паралітичними речовинами у людей. Перша ознака, яка майже завжди виявляється – це міоз, звучання зіниць. Це відбувається, коли людина вдихає випари зарину.
Друге – сіпання м’язів на тих ділянках тіла, куди потрапили найдрібніші частки зарину.
Третье – загальна слабкість, млявість. Важливий фактор ще – сльозотеча, слиновиділення, тече з носа. Якщо це важке отрування, то: втрата свідомості, піна з рота, зупинка дихання і смерть.
Як захиститися
Якщо людина без захисту опиниться в епіцентрі враження бойової хімічної речовини, то шансів побачити немає. Менш ніж за хвилину вона втратила свідомість, почалися конвульсії і смерть. Але якщо не потрапити в центр уражень, то вижити дуже великі шанси. Головне — не опинитися на відкритій місцевості.
Ідеальний варіант – бомбосховище, штатне бомбосховище з системою фільтрації повітря, або метрополітен. Але навіть квартира може стати досить гарним прихистком під час хімічної атаки. Особливо, якщо вона оснащена металопластиковими вікнами, які щільно закриваються. Під час хімічної атаки найкраще ізолювати себе від навколишнього середовища, щоб не дати можливості аерозолю і випарам зарину потрапити в середину. Тому у квартирі щільно закриваємо вікна, двері, герметизуємо всі щілини, закриваємо вентиляційні отвори і не користуємося кондиціонером. Це дуже важливо.
Зарін важчий за повітря, тому ідеальний варіант, якщо ваша квартира на високих поверхнях. Туди випари зарину пропускають тільки в невеликий вміст. Фосфорні боєприпаси ,
 начинені білим фосфором. Температура його
начинені білим фосфором. Температура його
горіння — близько 800 °C. Запальна суміш може розповсюджуватися значною територією, до кількох сотень метрів. За свою дію фосфорні бомби нагадують напалм, розповідає Суспільному військовий експерт Сергій Згурець.
«Білий фосфор забезпечує високу температуру горіння, яка погано гаситься. Така бомба може знищувати велику площу і наносити велику шкоду живій силі і техніці», — пояснює Згурець.
Фосфор, який використовується у боєприпасах — самозапальний. Він спалахує від контакту із киснем, тому загасити його складно.
Допомога під час ураження білим фосфором
У випадку внесення потрібно якнайшвидше скинути одяг, до якого прилипли частки фосфору. А до пошкоджених ділянок тіла потрібно перекрити доступ кисню, для прикладу помітити рани великою кількістю води. «Але висока температура суттєво ускладнює гасіння таких боєприпасів із сумішшю», — каже Сергій Згурець.
Якщо фосфор потрапив на предмети, їх можна загасити рясно поливаючи водою, чи засипаючи піском або підставою, поки до фосфору не перестає надходити кисень.
Складіть рівняння хімічних реакцій генетичного ряду сірки та фосфору:
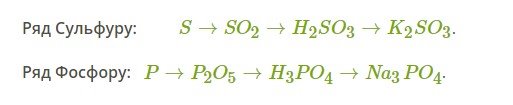
Класифікуйте реакцію за повною ознакою. Для окисно-відновних реакцій складіть електронний баланс, зазначте окисник і відновник. Складіть повні й скорочені йонні рівняння між електролітами в розчинах.
VI. Презентація напрацювань груп, чи окремих робіт. V. Підведення підсумків уроку.
1.Формування висновків, щодо значення окисно-відновних реакцій.
2. Сульфур і окиснюється, і відновлюється в хімічній реакції, схема якої
А) Na2SO4 + H2SO4 → NaHSO4 + SO2 + H2O
Б) S + NaOH → Na2SO3 + Na2S + H2O
ІV. Підведення підсумків уроку.
1. Виставлення балів в листи взаємооцінювання. Корекція балів вчителем.
2. https://learningapps.org/display?v=p89z0rtuc22
Перейдіть за посиланням і поділіться своїми враженнями від уроку


про публікацію авторської розробки
Додати розробку
