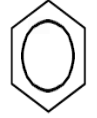
"Фенол:склад і будова молекули,фізичні та хімічні властивості."

- Феноли – це похідні ароматичних вуглеводнів, що містять одну або декілька гідроксильних груп біля атомів карбону бензольного кільця.
![]()
![]()
![]()
![]()
 ФЕНОЛИ
ФЕНОЛИ
![]()
ОДНОАТОМНІ ДВОХАТОМНІ ТРЬОХАТОМНІ
ОН (Ареноли) ОН (Арендіоли) ОН (Арентріоли)
![]()
![]()
![]()
![]()
![]()
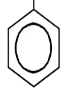
 ОН
ОН 
НОМЕНКЛАТУРА ТА ІЗОМЕРІЯ
Можливі два типи ізомерії:
- Ізомерія положення замісників в бензольному кільці
- Ізомерія бічного ланцюга (будова алкільного радикала і числа радикалів)
С6Н5ОН - Фенол (гидроксібензол)
![]()
![]()

СН3С6Н4ОН - Крезоли (метилфеноли, гідроксітолуоли)
![]()
![]()
![]() ОН ОН ОН
ОН ОН ОН
![]()
![]()
![]()
![]()
![]()



![]()
О – Крезол М – Крезол n - Крезол
(О – гідроксітолуол) (М – гідроксітолуол) (n – гідроксітолуол)
ЕЛЕКТРОННА БУДОВА
Феноли являють собою сполуки полярні (диполі). Бензольне кільце – від’ємний кінець диполя, група ОН – позитивний.
![]()
|
|
ОН група, зв’язана з ароматичним радикалом.
|
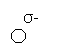
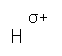
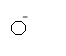 Фенол дисоціює в водних розчинах по кислотному типу:
Фенол дисоціює в водних розчинах по кислотному типу:
![]()
![]()
![]()
![]()
![]()
![]()
![]()


Фенолят-йон
Фенол являється слабкою кислотою. В цьому і є головна відмінність фенолів від спиртів, які являються неелектролітами.
В молекулах фенолу має місце взаємний вплив атомів, що впливає на властивості фенолу. Як приклад – у бензольному ядрі підвищується електронна густина у положеннях 2, 4, 6, де і відбувається заміщення атомів Гідрогену.
ФІЗИЧНІ ВЛАСТИВОСТІ
С6Н5ОН – фенол (карболова кислота) – безбарвна кристалічна речовина (t0 плавл. = 430С, t0 кип. = 1820С). На повітрі окиснюється , і стає розовою. При звичайній температурі обмежено розчинний у воді, а вище 660С змішується з водою в любих співвідношеннях. Фенол – токсична речовина, викликає обпіки шкіри, являється антисептиком.
ХІМІЧНІ ВЛАСТИВОСТІ
Хімічні властивості фенолів обумовлені наявністю в їх молекулах функціональних груп – ОН та бензольного кільця.
І. Реакції за участі гідроксильної групи ОН:
- Дисоціація у водних розчинах з утворенням фенолят-йонів:
![]()
![]() С6Н5ОН С6Н5О- + Н+
С6Н5ОН С6Н5О- + Н+
фенолят-йон
Фенол слабкіша кислота, ніж Н2СО3 і Н2S.
- Взаємодія з активними металами з утворенням фенолятів:
![]()
2С6Н5ОН + 2Na = 2C6H5ONa + H2
- Взаємодія з лугами (Відмінність від спиртів!)
C6H5OH + NaOH = C6H5ONa + H2O
Феноляти розкладаються слабкими кислотами
C6H5ONa + СО2 + Н2О = C6H5OH + NaНСО3
- ! Якісна реакція на фенол:
![]() 3C6H5OH + FeCl3 [C6H5O]3Fe + 3HCl
3C6H5OH + FeCl3 [C6H5O]3Fe + 3HCl
фіолетовий розчин
ферум (ІІІ) феноляту
- Феноляти використовують в якості вихідних речовин для добування ефірів фенолу
![]() C6H5O[Na + С2Н5[Br C6H5O-C2H5 + NaBr
C6H5O[Na + С2Н5[Br C6H5O-C2H5 + NaBr
брометан етилфеніловий
ефір
ІІ. Реакції за участі бензольного кільця:
- Реакції заміщення:
а) галогенування:
![]()
![]()
![]() ОН ОН
ОН ОН
![]()
![]()
![]()
![]()
![]()
![]()
![]()

![]()


Br (білий осад
2, 4, 6 трибромфенол)
б) нітрування:
ОН ОН
![]()
![]()
![]()
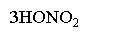
![]()
![]()
![]()
![]()
![]()
![]()
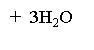


NO2
2,4,6 тринітрофенол
Пікринова кислота
(жовта кристалічна
вибухонебезпечна
речовина)
в) сульфурування:
ОН ОН
![]()
![]()
![]()
![]()
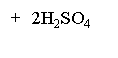
![]()
![]()
![]()


O – фенолсульфокислота
- Реакції приєднання:
гідрування:
![]()
![]() ОН ОН
ОН ОН
![]()
![]()
![]()
![]()

циклогексанол
ДОБУВАННЯ ФЕНОЛУ
- Із кам’яновугільної смоли.
Кам’яновугільну смолу обробляють розчином луг, а потім кислотою:
![]() C6H5OH + NaOH C6H5ONa + H2O
C6H5OH + NaOH C6H5ONa + H2O
![]() C6H5ONa + H2SO4 C6H5OH + NaHSO4
C6H5ONa + H2SO4 C6H5OH + NaHSO4
- Сплавлення солей аренсульфокислот з лугами:
![]()
![]() SO3Na OH
SO3Na OH
![]()
![]()
![]()
![]()


- Взаємодія галоген похідних ароматичних ВВ з лугами:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()


Хлорбензол
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()


Хлорбензол
ЗАСТОСУВАННЯ
![]() Синтетичні смоли Антисептик - 3-5% - й
Синтетичні смоли Антисептик - 3-5% - й
розчин для дезінфекції
![]()
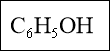
![]()
![]() Барвники Синтез лікарських
Барвники Синтез лікарських
препаратів
![]()
Вибухонебезпечні
речовини
Додаток
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ
- Напишіть структурні формули наступних сполук:
а) п – нітрофенол;
б) М – бромфенол;
в) О – крезол;
г) 2, 6 диметилфенол;
д) 1, 2, 4 тригідроксібензол.
- Напишіть рівняння реакцій лужного гідролізу наступних сполук:
а) хлорбензол;
б) 2, 4, 6 тринітрохлорбензол.
Назвіть продукти реакцій.
- Напишіть рівняння реакцій наступних перетворень:
![]()
![]()
![]()
![]()
![]() ОН
ОН
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()




Br
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()




NO2
4) Задача:
На нейтралізацію суміші фенола з етанолом затратили розчин об’ємом 50мл. з масовою часткою гідроксиду натрію 18% і густиною 1,2г.мл. Така ж маса суміші прореагувала з металічним натрієм, масою 9,2г. Визначте масові частки фенолу та етанолу в суміші.
5) Здійснити перетворення:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() СН4 А В C D X
СН4 А В C D X
Де застосовується речовина Х?


про публікацію авторської розробки
Додати розробку