Ферменти, їхня роль в клітині
Біологія 9 клас
Дата:
Урок №7
Тема. Ферменти, їхня роль в клітині.
Лабораторне дослідження: властивостей ферментів. Іструктаж з БЖД.
Мета: ознайомити з функціями білків, проаналізувати їх особливості будови та хімічні властивості, що дозволяють їм виконувати власні функції; звернути особливу увагу на значення всіх білків для життєдіяльності організмів; пояснити причини їх багатофункціональності, довести, що білки є основою життя; поглибити знання про ферменти, вивчити їх особливості та механізм дії; розвинути вміння робити висновки з власних спостережень.
Тип уроку: комбінований.
Обладнання і матеріали: пробірки, невеликі кубики сирої і вареної картоплі, гідроген пероксид з холодильника, гідроген пероксид, що має кімнатну температуру, підручники і зошити.
Базові поняття і терміни: білки, амінокислоти, каталізатори, ферменти, транспортна функція, захисна функція, структурна функція, каталітична, запасаюча.
Хід уроку
І. Організаційний етап
Привітання вчителя і учнів. Перевірка готовності до уроку. Перевірка присутніх.
ІІ. Актуалізація опорних знань
- Фронтальне опитування:
- Що таке білки? Які білки називаються простими, а які складними?
- Що таке амінокислоти? Яка їхня будова? Які амінокислоти ми називаємо замінними, а які незамінними?
- Яким чином сполучаються амінокислоти у поліпептидні ланцюги?
- Які ви знаєте структури білків?
2) Виконання тестового завдання:
1. Мономерами білка є:
А - амінокислоти, Б - моносахариди, В - нуклеотиди, Г - пептиди.
2. Амінокислоти відрізняються одна від одної хімічною будовою:
А - аміногрупи, Б - карбоксилу, В - радикалу, Г - радикалу і карбоксилу,
Д - карбоксилу і аміногрупи.
3. Рівнів структурної організації білкової молекули існує:
А - 4, Б - 3, В - 2.
4. Вторинну структуру білка підтримують зв'язки:
А - водневі,Б - гідрофобні, В - іонні.
5. Скільки з відомих амінокислот беруть участь у синтезі білків?
А - 20, Б - 23, В - 100.
6. Вторинна структура білків має вигляд:
А - глобули,
Б - декількох сполучених між собою білкових молекул,
В - спіралі,
Г - ланцюга амінокислотних залишків.
7. Первинна структура білків має вигляд:
А - глобули, Б - декількох сполучених між собою білкових молекул,
В - спіралі, Г - ланцюга амінокислотних залишків.
8. Під час утворення білкового полімеру відбувається зчеплення амінокислот і виділяється речовина:
А - амоніак, Б - вода, В - карбон (IV) оксид, Г - вуглеводень.
9. Третинна структура білків має вигляд:
А - глобули, Б - спіралі, В - ланцюга амінокислотних залишків.
10. Гемоглобін має:
А - первинну структуру, Б - вторинну структуру,
В - третинну структуру, Г - четвертинну структуру.
11.Амінокислоти у поліпептидний ланцюг сполучаються зв’язком:
А – водневим, Б – пептидним, В – ковалентним, Г – гідрофобним.
12.Процес порушення природної структури білка це:
А – деструкція, Б – денатурація, В – ренатурація.
ІІІ. Мотивація навчальної діяльності
Одне з визначень життя таке: «Життя — це спосіб існування білкових тіл...»
Проблема: Білки — основа життя?
Сьогодні на уроці ми маємо розв'язати це питання, дослідивши біологічну роль білків.
ІV. Вивчення нового матеріалу
1.Функції білків.
1. Будівельна (структурна) – Основний будівний матеріал клітини: мембран, органоїдів (калоген, кератин).
2. Захисна – Білки-антитіла здатні «розпізнавати» і знешкоджувати хвороботворні мікроорганізми. Білки ядра – гістони захищають молекули ДНК від ушкоджень. Білкові фактори згортання крові захищають організм від крововтрат (фібриноген).
3. Регуляторна (гуморальна, гормональна) – Поряд із нервовою системою гормони білкової природи керують роботою різних органів і всього організму через систему хімічних реакцій (інсулін, глюкагон).
4. Сигнальна – Окремі білки клітинних мембран здійснюють прийом сигналів і передачу їх всередину клітини (глікопротеїни).
5. Скорочувальна (рухова) – Усі види рухів виробляються особливими видами скорочувальних білків (актин, міозин).
6. Транспортна – Транспортні білки крові переносять кисень та органічні речовини (гемоглобін).
7. Енергетична – При окисненні 1 г білка вивільняється 17,2 кДж
8. Рецепторна-Багато білків на поверхні плазматичної мембрани клітин здатні пізнавати молекули певної структури. Білкові рецептори на поверхні клітин імунної системи здатні пізнавати чужорідний антиген і запускати реакцію його знищення.
9. Резервна - Деякі білки відкладаються про запас і слугують запасом поживних речовин для організу (яйцеклітини тварин ендосперм у рослин).
10. Ферментативна (біокаталіз) – Ферменти забезпечують перебіг хімічних реакцій у клітині за низьких температур, невисокого тиску і дуже малих концентрації (каталаза, пепсин).
Білки є основою життя, бо завдяки різноманітності їх будови і функцій усі життєво важливі процеси в організмах відбуваються лише за наявності білків.
2.Ферменти.
Усі ферменти є білками. Кожний фермент каталізує одну або декілька однотипних реакцій, тому зв'язування фермента із субстратом (речовиною, що піддається ферментативному перетворенню) високоспецифічне. Ділянка молекули білка, яка відповідає за зв'язування із субстратом, називається активним центром, а комплекс, що утворився при цьому,— фермент-субстратним комплексом. Суть каталізу полягає у зменшенні ферментом енергії активації (енергії, необхідної для вступу субстрату до реакції). Після завершення реакції комплекс розпадається. У процесі реакції фермент не піддається ані якісним, ані кількісним змінам.
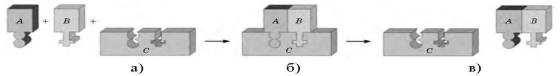
Схема ферментативної реакції:
а) фермент (C) і субстрати (А, В); б) фермент-субстратний комплекс (ABC), в) фермент (C) і продукт реакції (AB)
Ферменти мають дуже високу активність, вони здатні послідовно каталізувати тисячі й навіть мільйони реакцій за секунду. При цьому вони функціонують у дуже вузькому інтервалі умов середовища й у разі їхньої зміни інактивуються.
Назви ферментів утворюються від назви субстрату з додаванням закінчення -аза, наприклад пероксидаза, лактаза.
Властивості ферментів:
- діють за певної температури (35-39°С);
- діють за певного кислотно-лужного балансу (пепсин у шлунку діє за кислого середовища, амілаза у ротовій порожнині за лужного);
- є високоспецифічними (окремий фермент каталізує «свою» реакцію).
Використання ферментів у різних галузях.
Ферменти використовують у різних галузях:
- у харчовій промисловості - сироварінні, хлібопеченні, виноробстві й пивоварінні;
- в медицині - у діагностиці для визначення рівня холестерину в сироватці крові, для лікування артритів, хвороб серця, у трансплантації.
Відомо 200 хвороб, які пов′язані з дефіцитом ферментів. При введенні штучно створених ензимів у організм людину вдається вилікувати;
- за допомогою ферментів виготовляють антибіотики; у тваринництві - при виробництві кормів.
V. Узагальнення і систематизація знань
Інструктаж з БЖД
Лабораторне дослідження: властивостей ферментів.
Мета: практично виявити та дослідити різні властивості ферментів та вплив на них різноманітних фізичних факторів.
Обладнання й матеріали: пробірки, невеликі кубики сирої і вареної картоплі, гідроген пероксид з холодильника, гідроген пероксид, що має кімнатну температуру, підручники і зошити.
Хід роботи
В даній роботі властивості всіх ферментів розглядаються на прикладі ферменту пероксидази, який міститься в клітинах картоплі. В випадку контакту пероксидази із гідроген пероксидом проходить розклад пероксиду на воду і кисень, який виділяється в вигляді невеликих пухирців газу.
1. Для початку візьміть 3 пробірки та помістіть в них невеликі кубики картоплі. В перші 2 помістіть кубики сирої картоплі, а в 3-тю — вареної.
2. Після чого залийте 1-шу пробірку розчином гідроген пероксиду, що перед цим знаходився в холодильнику.
3. Уважно спостерігайте виділяються пухирці газу чи ні. Зазначте інтенсивність їхнього виділення.
4. Залийте 2-гу та 3-тю пробірки розчином гідроген пероксиду, що має кімнатну температуру.
5. Уважно спостерігайте, виділяються пухирці газу чи ні. Відзначте інтенсивність їхнього виділення.
6. Зробіть відповідний висновок, в якому зазначте результати спостережень і поясніть, яким чином вплинули низька температура і теплова обробка на роботу ферменту пероксидази. (Внаслідок кипятіння чи охолодження ферменти неактивні).
VІ. Домашнє завдання.
Опрацювати
2) Виконання тестового завдання:
1. Мономерами білка є:
А - амінокислоти, Б - моносахариди, В - нуклеотиди, Г - пептиди.
2. Амінокислоти відрізняються одна від одної хімічною будовою:
А - аміногрупи, Б - карбоксилу, В - радикалу, Г - радикалу і карбоксилу,
Д - карбоксилу і аміногрупи.
3. Рівнів структурної організації білкової молекули існує:
А - 4, Б - 3, В - 2.
4. Вторинну структуру білка підтримують зв'язки:
А - водневі,Б - гідрофобні, В - іонні.
5. Скільки з відомих амінокислот беруть участь у синтезі білків?
А - 20, Б - 23, В - 100.
6. Вторинна структура білків має вигляд:
А - глобули,
Б - декількох сполучених між собою білкових молекул,
В - спіралі,
Г - ланцюга амінокислотних залишків.
7. Первинна структура білків має вигляд:
А - глобули, Б - декількох сполучених між собою білкових молекул,
В - спіралі, Г - ланцюга амінокислотних залишків.
8. Під час утворення білкового полімеру відбувається зчеплення амінокислот і виділяється речовина:
А - амоніак, Б - вода, В - карбон (IV) оксид, Г - вуглеводень.
9. Третинна структура білків має вигляд:
А - глобули, Б - спіралі, В - ланцюга амінокислотних залишків.
10. Гемоглобін має:
А - первинну структуру, Б - вторинну структуру,
В - третинну структуру, Г - четвертинну структуру.
11.Амінокислоти у поліпептидний ланцюг сполучаються зв’язком:
А – водневим, Б – пептидним, В – ковалентним, Г – гідрофобним.
12.Процес порушення природної структури білка це:
А – деструкція, Б – денатурація, В – ренатурація.
2) Виконання тестового завдання:
1. Мономерами білка є:
А - амінокислоти, Б - моносахариди, В - нуклеотиди, Г - пептиди.
2. Амінокислоти відрізняються одна від одної хімічною будовою:
А - аміногрупи, Б - карбоксилу, В - радикалу, Г - радикалу і карбоксилу,
Д - карбоксилу і аміногрупи.
3. Рівнів структурної організації білкової молекули існує:
А - 4, Б - 3, В - 2.
4. Вторинну структуру білка підтримують зв'язки:
А - водневі,Б - гідрофобні, В - іонні.
5. Скільки з відомих амінокислот беруть участь у синтезі білків?
А - 20, Б - 23, В - 100.
6. Вторинна структура білків має вигляд:
А - глобули,
Б - декількох сполучених між собою білкових молекул,
В - спіралі,
Г - ланцюга амінокислотних залишків.
7. Первинна структура білків має вигляд:
А - глобули, Б - декількох сполучених між собою білкових молекул,
В - спіралі, Г - ланцюга амінокислотних залишків.
8. Під час утворення білкового полімеру відбувається зчеплення амінокислот і виділяється речовина:
А - амоніак, Б - вода, В - карбон (IV) оксид, Г - вуглеводень.
9. Третинна структура білків має вигляд:
А - глобули, Б - спіралі, В - ланцюга амінокислотних залишків.
10. Гемоглобін має:
А - первинну структуру, Б - вторинну структуру,
В - третинну структуру, Г - четвертинну структуру.
11.Амінокислоти у поліпептидний ланцюг сполучаються зв’язком:
А – водневим, Б – пептидним, В – ковалентним, Г – гідрофобним.
12.Процес порушення природної структури білка це:
А – деструкція, Б – денатурація, В – ренатурація.


про публікацію авторської розробки
Додати розробку
