Физические свойства оксидов. Распространенность в природе и использование оксидов. Влияние на окружающую среду и здоровье человека.
Тема: Физические свойства оксидов. Распространенность в природе и использование оксидов. Влияние на окружающую среду и здоровье человека.
Цель:
1) образовательная – познакомить учащихся с физическими свойствами оксидов, их распространением в природе и использованием, влияние на окружающую среду и здоровье человека;
2) воспитательная – воспитывать добросовестность, способность к преодоление трудностей, трудолюбие, экологическую культуру;
3) развивающая – развитие умения классифицировать неорганические вещества, составлять названия веществ по формуле и наоборот; развивать умение анализировать, сравнивать, выделять главное и делать выводы, устанавливать зависимость между составом и свойствами вещества; формировать самообразовательную, информативную и творческую компетентность.
Тип урока: комбинированный урок.
Оборудование: периодическая система химических элементов Д. И. Менделеева, компьютер, образцы оксидов как демонстрационный материал.
Демонстрации:
7. Образцы оксидов.
Ход урока
І. Организационный момент
Сегодняшний урок я хочу начать словами одного из самых выдающихся физиков XX века, лауреата Нобелевской премии Альберта Эйнштейна: Logic will get you from A to B. Imagination will take you anywhere. Логика может привести Вас от пункта А к пункту Б, а воображение – куда угодно…
Поэтому я всем вам желаю уверенности, добросовестного труда и успехов на сегодняшнем уроке.
На сегодняшнем уроке действует необычная система баллов. За правильные ответ вы будете получать не оценки, а вкусняшки.
ІІ. Проверка домашнего задания. Актуализация опорных знаний
А теперь, представьте: середина XIII века, старинный замок, а в нем разместилась огромная химическая лаборатория, в которой день и ночь работают выдающиеся алхимики того времени, и они позволили нам поработать в этом замке. Но, перед тем как отправиться в замок и начать там работу, мы должны убедиться, хватит ли у вас знаний. Давайте вспомним, что вы изучали на прошлых уроках.
1. Индивидуальное задание
Среди предложенных веществ выберите отдельно оксиды, кислоты, основания, соли и запишите их в соответствующие колонки таблицы:
К2O, H2S, CO, Fe(OH)2, Na2SО3, SO2, HNO3, Al2(SO4)3, ZnO, NaOH
|
Оксиды |
Кислоты |
Основания |
Соли |
|
|
|
|
|
2. Беседа «Мозговой штурм»
1. Распределите вещества на 2 группы. Какие особенности веществ вы для этого использовали?
Mg, O2, BaO, C, FeSO4, CuO, H2CO3, NaOH, Al, H2, Fe2O3.
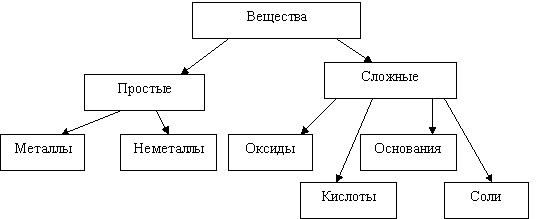
2. Что такое простые вещества?
3. Как классифицируют простые вещества?
4. Что такое сложные вещества?
5. С какими сложными веществами вы встречались раньше?
6. Какие вещества называют оксидами?
ІІІ. Мотивация учебной деятельности
На дворе зима. Наш организм для повышения иммунитета нуждается в витамине С, то есть аскорбиновой кислоте, содержащейся в цитрусовых, шиповнике, смородине. В морозную погоду необходимо в свой рацион включить калорийные продукты такие как: мясо, рыбу, разнообразные супы и бульоны, но не забывайте к ним добавить натрий хлорид. Не злоупотребляйте газированными напитками, так как они негативно действуют на зубную эмаль и желудок ... Наверняка вы догадались, что упомянутые мной соединения относятся к...(основным классам неорганических соединений). Но сегодня мы детальнее остановимся на одном из них. Запишите тему урока «Физические свойства оксидов. Распространенность в природе и использование оксидов. Влияние на окружающую среду и здоровье человека».
Цель:
На сегодняшнем уроке мы познакомимся с физическими свойствами оксидов, их распространением в природе и использованием, а также узнаем как они влияют на окружающую среду и здоровье человека. Мы будем воспитывать в себе экологическую культуру Будем развивать умения классифицировать неорганические вещества, составлять названия веществ по формуле и наоборот; развивать умение анализировать, сравнивать, выделять главное и делать выводы, устанавливать зависимость между составом и свойствами вещества;
ІV. Изучение нового материала
- Что такое оксиды? (Оксиды – это сложные вещества, состоящие из атомов двух химических элементов, один из которых – Оксиген).
- Какие типы химической связи в неорганических веществах вам известны?
- Какие типы кристаллических решеток вам известны?
- Каким образом свойства веществ зависят от типа кристаллической решетки?
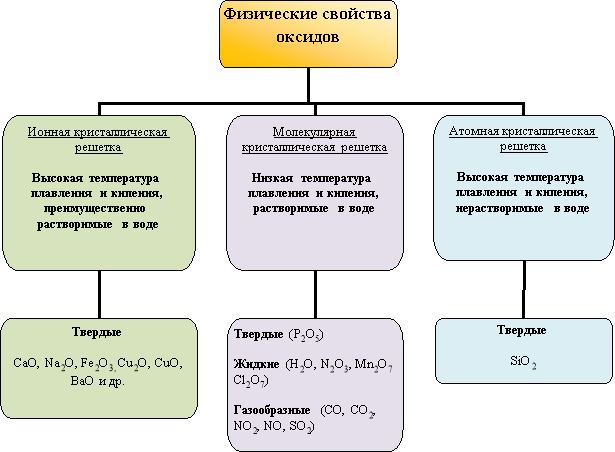
Свойства оксидов, как и других веществ, зависят от их строения, то есть от того, из каких частиц они состоят (атомов, молекул, ионов).
В ионных оксидах противоположно заряженные ионы сильно притягиваются между собой, поэтому эти оксиды при обычных условиях являются твердыми, имеют высокую температуру плавления, большинство нерастворимые в воде, другие с ней реагируют.
Между молекулами притяжения очень слабое, поэтому оксиды с молекулярным строением характеризуются невысокими температурами плавления и кипения, различным агрегатным состоянием при обычных условиях, растворимости в воде, некоторые имеют запах.
Оксиды с атомной строением являются твердыми, с высокими температурами плавления и кипения, нерастворимые в воде.
Ионные оксиды (СаО, Na2O), молекулярные (H2O, SO2, CO2), атомные (SiO2).
Совместное составление опорной схемы.
 1. Демонстрация образцов оксидов: CuO, Cr2O3, Fe2O3, SiО2, MnO2.
1. Демонстрация образцов оксидов: CuO, Cr2O3, Fe2O3, SiО2, MnO2.
Сравните представлены образцы оксидов. Чем они отличаются?
По окраске (MnO2 и CuO – черные, Fe2O3 – бурый, Cr2O3 – зеленый, SiО2 – темно-коричневый)
2. Использование и распространение оксидов (с. 154-155)
Работа в парах. Проработайте материал учебника «Использование и распространение оксидов» и установите соответствие.
1. Н2О
2. Al2O3
3. SiO2
4. CO2
5. SO2
6. NO2
7. Fe2O3
8. СаО
9. MgО
10. ZnO
А) Производство стекла.
В) Изготовление лекарственных препаратов;
Д) Содержится в воздухе в виде водяного пара;
Т) Образуется при извержений вулканов.
Ж) Для обработки металлических поверхностей;
И) Участвует в процессе фотосинтеза;
О) Причина возникновения кислотных дождей;
З) Изготовление ферромагнитных покрытий;
Э) Основа для изготовления белой краски.
Ь) Производство извести.
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
д |
ж |
а |
и |
т |
о |
з |
ь |
в |
э |
3. Игра «Шифровальщик». Необходимо как можно быстрее расшифровать выражение о самом распространенном оксиде. Принцип шифрования – каждая цифра означает букву. Используйте для этого ответ из предыдущего задания.
|
9 |
6 |
1 |
3 |
– |
10 |
5 |
6 |
|
2 |
4 |
7 |
н |
8 |
! |
|
в |
о |
д |
а |
э |
т |
о |
ж |
и |
з |
ь |
Остановимся болем детально на этом оксиде. Так как вода нужна абсолютно всем живым существам – людям, животным, насекомым, растениям. Но больше всех используем воду мы – люди: не только для гигиены и приготовления пищи, но и для изготовления лекарств, производства различных вещей необходимых человеку. Без воды невозможно обойтись ни на одном предприятии – фабрике или заводе.
Как видите без воды жизнь была бы невозможна.
Вы уже знаете что именно деятельность человека способствует загрязнению воды (отходы промышленных предприятий, плохие очистные сооружения, бытовой мусор, сточные воды, утечка нефти при добыче на берегах и с судов, ядохимикаты и минеральные удобрения, дождь смывает с полей). Поэтому именно человеку и нужно исправить это положение.
А сейчас время новостей! У нас прямое включение с телеканалом 1+1. Давайте послушаем, что нам подготовили корреспонденты.
4. Видео
5. Физкультминутка
А теперь перерыв, проведем спортивный химический диктант, который поможет проверить, насколько хорошо вы усвоили то, что мы изучали на сегодняшнем уроке.
Вопросы:
1. Если вода – это сложное вещество, то хлопните в ладоши. (Да)
2. Если вода самое распространенное вещество на планете, топнете ногой. (Да)
3. Если карбон(IV) оксид выделяется в атмосферу в результате дыхания организмов, подморгните. (Да)
4. Если силиций(IV) оксид содержится в воздухе в виде пара, взмахните руками. (Нет)
5. Если магний оксид используют для изготовления лекарственных препаратов, пожмите руку своему соседу. (Да)
6. Если алюминий оксид причина возникновения кислотных дождей, закройте правый глаз ладонью. (Нет)
7. Если нитроген(IV) оксид образуется при извержении вулканов, во время грозы и в результате техногенной деятельности, то помашите нашим гостям левой рукой. (Да)
V. Обобщение и систематизация знаний
1. Письмо с Новой почты:
1. Карбон (II) оксид известный в народе как угарный газ. Он блокирует действие гемоглобина, вызывая удушье. Где будет размещаться угарный газ в помещении. Ответ подтвердите расчетами.
Mr(воздуха)=29
Mr(СО)=28
2. Рубин издавна считается классическим ювелирным камнем и решается в каратах. Наибольший ювелирный рубин имел массу 400 каратов (1 карат-0,2 г). Определите массу алюминия, который находился в данном рубине.
2. QR-код. Запишите химические формулы оксидов, исторические названия которых:
негашеная известь,
«сухой лед»,
угарный газ,
углекислый газ.
Дайте им научные названия.
Оксид кальция (окись кальция, негашёная известь) – белое кристаллическое вещество, формула CaO. CaO еще называют – «кипелка». Именно отсюда вошло в обиход понятие «кипельно белый цвет», что значит белее белого. Такой цвет имеет негашеная известь, которая буквально «кипит» при взаимодействии с водой, выделяя при этом большое количество тепла.
«Сухой лёд» – твёрдый карбон (ІV) оксид CO2, при обычных условиях (атмосферном давлении и комнатной температуре) переходящий в газообразное состояние, минуя жидкую фазу. По внешнему виду напоминает лёд (отсюда название).
Карбон(II) оксид – (угарный газ, окись углерода, оксид углерода(II)) – бесцветный чрезвычайно токсичный газ без вкуса и запаха, легче воздуха (при нормальных условиях). Химическая формула – CO.
Карбон(IV) оксид (диоксид углерода или двуокись углерода, также углекислый газ, углекислота, оксид углерода(IV), угольный ангидрид) – бесцветный газ (в нормальных условиях), почти без запаха (в больших концентрациях с кисловатым «содовым» запахом), с химической формулой CO2.
3. «Химическая ловушка»
ТБ – Ты в химкабинет пришел,
Так запомни, кроха
Безопасность хорошо!
Быть безруким плохо!
Если ты во все подряд
окунаешь пальчик,
Про такого говорят:
«Бестолковый мальчик!»
Если пробуешь на вкус
Ты все непременно,
Может, мальчик, ты не трус,
Но глупец отменный!
Не подумайте, что я
С мальчиками строже:
Что мальчишкам здесь нельзя
И девчонкам тоже!
1. Как вы думаете, можно ли потушить пожар силой мысли?
NaHCO3 + CH3COOH = CH3COONa + CO2 + H2O
Применение углекислого газа особенно востребовано в системах пожаротушения. Он заполняется в углекислотные газовые огнетушители и при возгорании позволяет изолировать очаг пожара от источника кислорода. Горение не может долго продолжаться без подпитки воздухом, а газификация углекислотой не даст ему проникнуть к огню.
2. (NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
Реакция термического разложения дихромата аммония с образованием азота, хром(III) оксида и воды. Реакция протекает при температуре 168-185°C.
Лабораторный метод получения азота – «Вулкан Беттгера»
VI. Домашнее задание
1. 1-6 баллов – §29, с. 153-156 прочитать, с. 157 №5, 7
2. 7-9 баллов – подготовится к диспуту «Влияние оксидов на окружающую среду и здоровье человека»:
І вариант – положительное влияние оксидов;
ІІ вариант – негативное влияние оксидов.
3. 10-12 баллов – «Химическая ловушка» – придумать рекламу хром(ІІІ) оксида.
VII. Подведение итогов урока
Я желаю, чтобы хорошее настроение не покидало вас. А для этого:
- Ешьте бананы. В их мякоти содержатся вещества, благодаря которым возникает чувство радости и спокойствия. Это происходит благодаря входящему в состав бананов триптофану, который преобразуется в организме в серотонин. А серотонин известен, в первую очередь, тем, что расслабляет, повышает настроение и заставляет человека чувствовать себя счастливее.
- Ешьте апельсины. Они стабилизируют настроение, устраняют депрессию, печаль, тревогу.
- И, конечно, шоколад. Он улучшает настроение и успокаивает «исстрадавшуюся» нервную систему. Организм реагирует на сладкое лакомство усиленной выработкой гормонов счастья (серотонина) и эндорфинов (которые снимают психологическое напряжение и боль).
- Старайтесь смотреть на вещи оптимистично. УЛЫБАЙТЕСЬ! Учителя, которые улыбаются и которым улыбаются, живут на 4 года дольше!
Дополнительное задание 1. Составьте уравнение реакций горения магния, лития и углерода в кислороде. Укажите названия полученных оксидов.


про публікацію авторської розробки
Додати розробку
