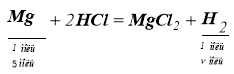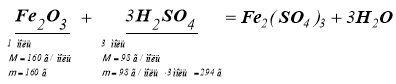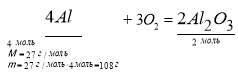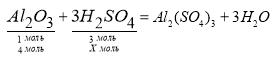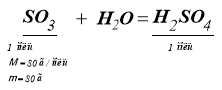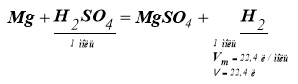Урок"Тема Хлоридна кислота : властивості, добування і застосування"
Міністерство освіти і науки України
Відділ освіти Жашківської райдержадміністрації
Районний методичний кабінет
Інноваційні підходи до організації роботи сільської школи,
 зокрема малокомплектної
зокрема малокомплектної
Урок хімії у 8 класі 
Урок підготувала і провела:
 учитель біології і хімії
учитель біології і хімії
вищої кваліфікаційної
категорії
загальноосвітньої школи
І-ІІ ступенів с. Леміщиха
Бондаренко
Галина Володимирівна
Жашків
Тема Хлоридна кислота : властивості, добування і застосування
Мета: ознайомитися з хімічними властивостями хлоридної(хлороводневої) кислоти й
хлороводню, з якісною реакцією на хлоридну кислоту та її солі; закріпити
навички проведення хімічного експерименту, складання хімічних рівнянь;
сформувати вміння робити висновки за результатами хімічних досліджень;
розглянути застосування хлоридної кислоти, виховувати пізнавальну
зацікавленість до предмета.
ТИП УРОКУ : засвоєння і набуття нових знань
МЕТОДИ УРОКУ : розповідь з елементами бесіди, демонстрація.
ОСНОВНІ ПОНЯТТЯ : кислоти, солі, , індикатори, якісна реакція.
МІЖПРЕДМЕТНІ ЗВ’ЯЗКИ : біологія — входить до складу шлункового соку
(майже 0,3 %), сприяє перетравлюванню їжі й убиває хвороботворні бактерії;
медицина—ліки для нейтралізації надлишку хлоридної кислоти в шлунку.
ОБЛАДНАННЯ: Прилади для добування кислоти, комп’ютер
Реактиви: кристалічний хлорид натрію NaCl ( кухонна сіль),
концентрована сульфатна кислота, метали: магній, цинк, мідь.
ХІД УРОКУ
І. ОРГАНІЗАЦІЯ КЛАСУ.
ІІ. АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ.
Робота з картками
І варіант Самостійна робота
- .Допишіть рівняння можливих реакцій, поясніть ваше розв’язання.
а) Zn + HCl → . . . ; б) Cu + HCl→ . . . ; в) Al+ HCl→ . . . ;
г) Ag + HCl→ . . . ; д ) Ni + H2SO4→ . . . ; е) Fe + HCl→ . . . ;
- Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення: P → P2O5 → H3PO4 → Mg3(PO4)2
ІІ варіант
1. Допишіть рівняння можливих реакцій, поясніть ваше розв’язання.
а) Zn + HCl → . . . ; б) Au + HCl→ . . . ; в) Li + H2SO4→ . . . ;
г) Mn + HCl → . . . ;д) Hg + HCl → . . . ; е) Ba + HCl → . . . ;
2. Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення: S→ SO2 → SO3 → H2SO4 →BaSO4 .
ІІІ варіант Задача.
- Яку масу ортофосфорної кислоти можна одержати з 1,5 моль фосфор (V) оксиду й води?
Завдання біля дошки
Завдання 1.
- Складіть формули кислот за кислотними залишками: SO3, , PO4, Br, F. Дайте назви відповідним кислотам.
- Напишіть формули хлороводневої, бромоводневої, йодоводневої, сірководневої кислот. До якого класу ( оксигеновмісні чи безоксигенові) вони належать. Наведіть формули кислот різної основності.
- Напишіть рівняння реакцій, що характеризують властивості кислот.
Завдання 2.
1 .Складіть формули кислот за кислотними залишками: SO4 , SiO3, S, Cl. Дайте назви відповідним кислотам.
- Дано оксиди : SO3, SO2, CO2, N2O5, P2O5 . Які кислоти можна з них одержати? Напишіть рівняння відповідних реакцій. Назвіть оксиди й кислоти.
- Дано дві пробірки з прозорими розчинами. Відомо, що в одній з них вода, а в іншій — кислота. Запропонуйте метод визначення вмісту кожної пробірки.
Робота з класом
Якщо написана формула, потрібно записати назву речовини, і якщо написано назву — формулу:
Хлоридна кислота, натрій оксид, CO2, сульфатна кислота, CaO, магній оксид, сульфур (IV) оксид, ферум (ІІІ) оксид, H3PO4, алюміній оксид, карбонатна кислота, нітратна кислота.
Якщо написана формула, потрібно записати назву речовини, і якщо написано назву — формулу:
HCl, сульфідна, H2CO3, ортофосфатна, H2SiO3, сірчана, HF, метафосфорна, H2SO3, азотна , HBr, йодидна.
ІІІ. МОТИВАЦІЯ НАВЧАЛЬНОЇ ДІЯЛЬНОСТІ
На основі знань про хімічні властивості кислот, ви конкретизуєте свої знання про хлоридну кислоту, сформуєте вміння і навички в проведенні експерименту, навчитеся спостерігати. На сьогоднішньому уроці ви навчитеся якісно вирізняти хлоридну кислоту серед інших кислот, ознайомитеся з лабораторним способом добування хлоридної кислоти. На основі пророблених дослідів і спостережень, зробите висновки і узагальнення. Робота з кислотами вимагає дотримання безпеки, уваги й акуратності.
ІV . ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
Ми будемо працювати за таким планом:
- Загальна характеристика
- Добування (демонстрація)
- Фізичні властивості
-
Хімічні властивості
- Дія на індикатори
- Взаємодія з металами ( лабораторна робота №4)
- Взаємодія з оксидами металів
5. Застосування
- Загальна характеристика
Хлоридну кислоту за часів середньовіччя називали соляним спиртом. Уперше вона згадується у творах німецького алхіміка Василая Валентина в другій половині ХУ століття. Ним описаний метод одержання соляного спирту шляхом сухої перегонки суміші, яка складається з купоросу, галуну й кухонної солі. Алхіміки вивчали дію соляного спирту на метал й оксиди. Склад цієї речовини тривалий час був для вчених загадкою.
З усіх безоксигенових кислот хлороводнева, або хлоридна чи соляна, кислота має особливе значення . Вона є розчином газоподібної речовини — хлороводню HCI у воді . Отже, щоб дістати хлоридну кислоту, треба спочатку добути хлороводень.
2. Добування (демонстрація)
У лабораторних умовах хлороводень НCl добувають із кристалічного хлориду натрію NaCl ( кухонна сіль) під час нагрівання його з концентрованою кислотою.
В разі слабкого нагрівання не весь Гідроген сульфатної кислоти обмінюється не весь Натрій , тому утворюється гідросульфат натрію NaНSО4, так звана кисла сіль:
NaCl + H2SO4 = NaНSO4 + HCl
В разі сильного нагрівання — сульфат натрію ( нормальна сіль):
2 NaCl + H2SO4 = Na2SO4 + 2 HCl
3 . Фізичні властивості
Хлороводень НCl — безбарвний газ з різким запахом, трохи важчий за повітря, у вологому повітрі «димить» дуже добре розчиняється у воді : при 0 0С в одному об’ємі води розчиняється 500 об’ємів хлороводню. Якщо добутий газ поглинати водою ( пропускати через воду) , то при цьому можна дістати розбавлений розчин хлороводневої кислоти.
Концентрована хлороводнева кислота(масова частка HCl до 40 %) це безбарвний розчин, який “димить ” у вологому повітрі .Чому? (Попадаючи в повітря молекули хлороводню притягують водяну пару, над кислотою утворюється «туман» з найдрібніших крапельок соляної кислоти), з різким запахом унаслідок виділення хлороводню, має високу хімічну активність . Вона виявляє загальні властивості , характерні для більшості кислот.
4. Хімічні властивості
- Зміна забарвлення індикаторів
Лакмус з фіолетового — червоніє
Метиловий оранжевий з оранжевого — рожевим
Фенолфталеїн залишається безбарвним
б) Взаємодія з металами
Zn + 2 HCl = ZnCl2 + H2
утворюючи при цьому солі – хлориди та водень
( лабораторна робота №4)
Діти виконують лабораторна робота №4 ( повторити правила т/б)
Лабораторна робота №4
“Взаємодія хлороводневої кислоти з металами”
(Ст. 112 підручник)
Хід роботи:
- зроби висновок – чи всі метали реагують з хлоридною кислотою?
- Спостерігай за випарюванням розчину, що утворився в реакції між Zn і HCl, зроби висновок про склад продукту.
в)Взаємодія з оксидами металів
Fe2O3 + 6 HCl = 2 FeCl3 + 3 H2O
При цьому в результаті реакції обміну утворюється сіль – хлорид феруму (ІІІ) та вода.
г) Якісною реакцією на хлоридну кислоту та її солі є взаємодія з розчином аргентум нітрату AgNO3. При цьому випадає білий сирнистий осад (схожий на звурджене молоко) AgCl, який не розчиняється ні у воді, ні в кислотах:
HCl + AgNO3 = AgCl + HNO3
NaCl + AgNO3 = AgCl + NaNO3
Цією особливою властивістю користуються, щоб розпізнати хлоридну кислоту серед інших кислот.
Аргентум нітрат AgNO3 – реактив на хлоридну кислоту та її солі, хлориди.
5. Застосування хлоридної кислоти
З усіх безоксигенових кислот хлоридна кислота має особливо важливе значення. Вона широко використовується в суспільному господарстві. Її застосовують для добування хлоридів металів (Цинку, Феруму, Мангану), для очищення поверхні металів від оксидів перед лудінням (вкриття оловом), нікелюванням, хромуванням. Щоб сам метал при цьому не реагував з кислотою, до неї добавляють спеціальні речовини – інгібітори (сповільнювачі реакцій), які захищають метал від руйнування в кислоті, але не перешкоджають оксидам з нею взаємодіяти.
Хлоридна кислота використовується в медицині. Вона входить до складу шлункового соку (майже 0,3 %), сприяє перетравлюванню їжі й убиває хвороботворні бактерії. За нестачі в шлунковому соку хлоридної кислоти лікар призначає вживати її всередину (розбавлений розчин). Якщо ж вміст HCl у шлунковому соку підвищений, відчувається печія. У такому разі людина вживає ліки для нейтралізації надлишку хлоридної кислоти в шлунку.
Хлоридну кислоту перевозять у скляних суліях або стальних посудинах, вкритих зсередини гумою. Якщо ж до кислоти додати інгібітори, то її можна перевозити і в стальних цистернах.
Висновки
Хлоридна кислота являє собою водний розчин хлороводню. Вона має високу хімічну активність. За стандартних умов виявляє властивості, характерні взагалі для кислот: змінює забарвлення індикаторів, взаємодіє з металами та оксидами металів.
Особливою хімічною властивістю хлоридної кислоти є здатність взаємодіяти з аргентум нітратом AgNO3, утворюючи білий осад AgCl, який не розчиняється ні у воді, ні в кислотах. Ця реакція використовується для розпізнавання хлоридної кислоти та її солей, тому називається якісною.
V. Узагальнення і систематизація знань учнів.
Тести для самоконтролю
- З наведених металів не взаємодіють з хлоридною кислотою
магній
+ мідь
цинк
+срібло
- Внаслідок випарювання отриманого в реакції між Zn і HCl розчину на склі залишається
цинк
цинк оксид
+цинк хлорид
хлоридна кислота
- Взаємодія між магнієм і хлоридною кислотою належить до реакцій
+заміщення
обміну
сполучення
розкладу
- Напиши рівняння реакції між нітратною кислотою та алюміній оксидом. Сума коефіцієнтів у цьому рівнянні становить
11
9
8
+12
Задачі для самостійного розв’язування
Задача 1
Який об’єм водню (н. у.) можна добути внаслідок дії хлоридної кислоти на магній кількістю речовини 5 моль?
|
Дано: v (Mg) = 5 моль HCl |
Розв’язування: 1) З рівняння реакції:
v (H2) = 5 моль 2) V(H2) = v · Vm = 5 моль · 22,4 л/моль = 112 л |
|
V (H2) = ? |
Відповідь: можна добути водень об’ємом 112 л.
Задача 2
Яка маса сульфатної кислоти потрібна для реакції з Ферум(III) оксидом масою 8 г?
|
Дано: m (Fe2O3) = 8 г
|
Розв’язування:
1) 160 г Fe2O3 взаємодіє з 294 г кислоти 8 г Fe2O3 взаємодіє з Х г кислоти m (H2SO4) = Х = 14,7 г. |
|
m (H2SO4) = ? |
Відповідь: потрібно 14,7 г сульфатної кислоти.
Задача 3
Яка кількість речовини сульфатної кислоти необхідна для взаємодії з тим алюміній оксидом, який утворився внаслідок взаємодії з киснем алюмінію масою 216 г.
|
Дано: m (Al) = 216 г О2 |
Розв’язування: 1) Знайдемо кількість речовини алюміній оксиду, що утвориться при спалюванні алюмінію:
З 108 г алюмінію утворюється 2 моль Al2O3 З 216 г алюмінію утворюється X моль Al2O3 v (Al2O3)=Х = 4 моль. 2) Розрахуємо кількість речовини сульфатної кислоти, яка взаємодіє з утвореним алюміній оксидом:
v (H2SO4) = Х = 12 моль. |
|
v (H2SO4) = ? |
Відповідь: необхідно 12 моль сульфатної кислоти.
Задача 4
Який об’єм водню (н.у.) виділиться при взаємодії з магнієм тієї кількості сульфатної кислоти, що утворилась в результаті сполучення з водою сульфур(VI) оксиду масою 20 г ?
|
Дано: m (SO3) = 20 г H2O |
Розв’язування: 1) Знайдемо масу утвореної кислоти:
1) З 80 г SO3 утворюється 1 моль H2SO4 З 20 г SO3 утворюється Х моль H2SO4 Х = v (H2SO4) = 0,25 моль. 2) Розрахуємо об’єм водню:
З кислоти кількістю речовини 1 моль виділяється водень об’ємом 22,4 л З кислоти кількістю речовини 0,25 моль виділяється водень об’ємом Х л V (H2) = Х = 5.6 л. |
|
V (H2) = ? |
Відповідь: виділиться водень об’ємом 5,6 л.
VІ. Підсумок уроку.
VІІ . Домашнє завдання
Опрацювати §29
вивчити властивості кислоти;
Виконати завдання № 3,4,7 після §29 ст.114


про публікацію авторської розробки
Додати розробку