Фізичні та хімічні властивості основ





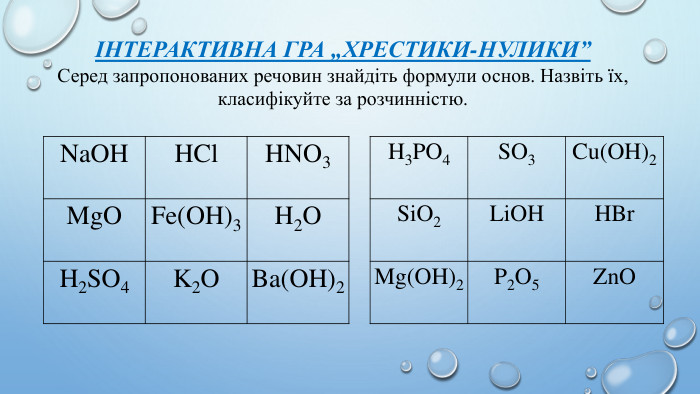















Мотивація навчальної діяльностіІнтерактивна вправа «Незакінчене речення»Основи – це складані речовини, які складаються з …… Основи поділяються на дві групи …… Дайте назви основам… Nа. OH, Cа(OH)2, Al(OH)3, KOH, Cu(OH)2, Bа(OH)2, Fe(OH)3 Луги це - …… барій гідроксид, купрум(II)гідроксид, калій гідроксид, алюміній гідроксид, цинк гідроксид, натрій гідроксид, магній гідроксид. Нерозчинні основи це - …… купрум(II)гідроксид, літій гідроксид, алюміній гідроксид, цинк гідроксид, натрій гідроксид
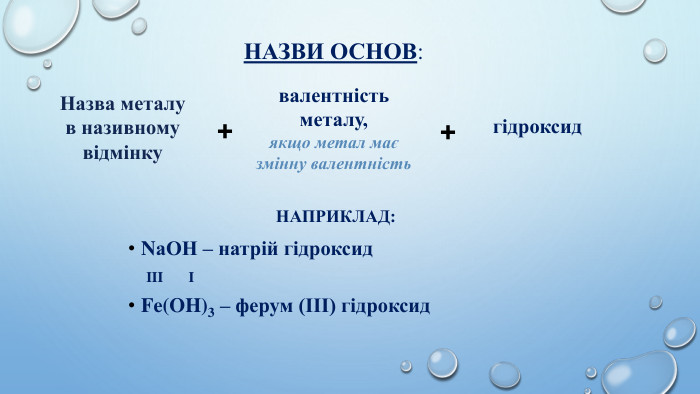
Основи – це складні речовини, молекули яких містять атоми металів і гідроксильну групу ОН. Що ж таке основи?Гідроксильна група є ОДНОВАЛЕНТНОЮ, тому кількість гідроксильних груп в молекулі основи залежить від валентності металу. Загальна формула основ: Ме(ОН)x. Де - ОН – гідроксильна група, з валентністю І; x - валентність металу.
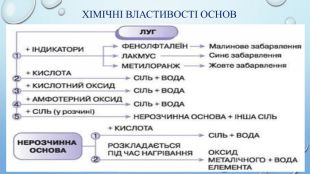
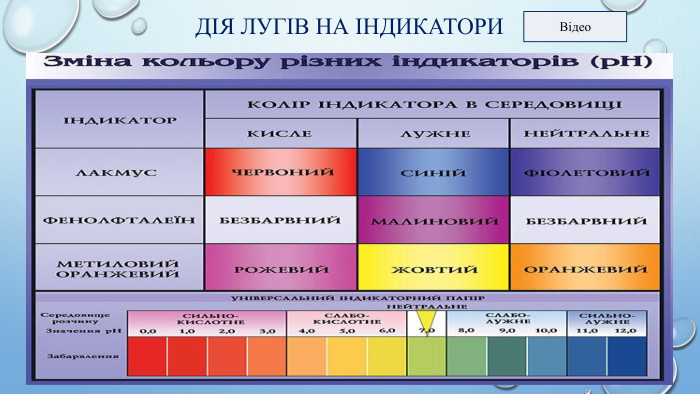
Фізичні властивості основ. За нормальних умов луги — тверді речовини, білого кольору, без запаху, мильні на дотик, їдкі, роз’їдають шкіру та тканини. Нерозчинні основи — тверді забарвлені речовини. 1. Натрій гідроксид - розчин і гранули 2. Кальцій гідроксид: порошок і суспензія - вапняне молоко
Безпека під час роботи з лугами. Луги – їдкі речовини, вони роз’їдають шкіру, деревину, папір. Милкі на дотик, спричиняють опіки шкіри, слизових оболонок, сильно вражають очі;Працюючи з розчинами лугів, будьте особливо обережними;Треба оберігати очі захисними окулярами; При потраплянні на шкіру промити великою кількістю проточної води та змастити розчином оцтової кислоти (або борної кислоти);Звернутися за допомогою до вчителя або лаборанта. Правила ТБ
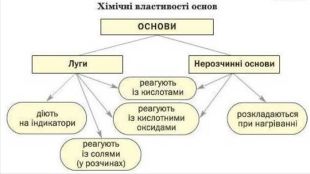
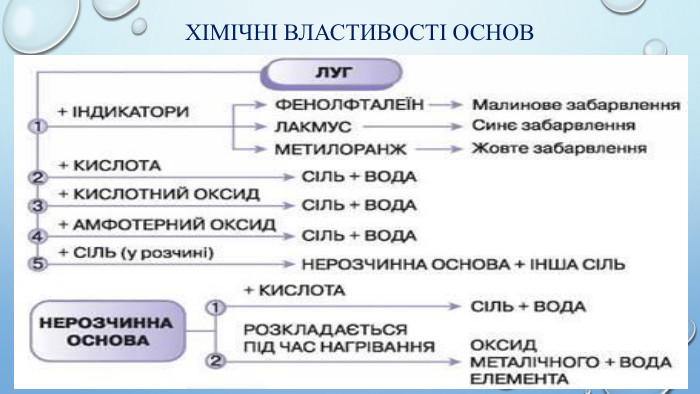
Взаємодія лугів з кислотними оксидами. Під час взаємодії лугів з кислотними оксидами утворюється сіль тієї кислоти, що відповідає даному кислотному оксиду та вода. Ме(ОН)х + Ех. Оу → Мех. КЗу + Н2 ОЛуг + кислотний оксид → сіль + вода. Демонстрація взаємодії лугів з кислотними оксидами. Са(ОН)2 + СО2 = Ca. CO3 + Н2 О
Взаємодія лугів та нерозчинних основ з кислотами. Розчинні і нерозчинні основи мають спільну властивість – реагують з кислотами, утворюючи сіль і воду. Під час взаємодії основи з кислотою сполуки обмінюються складовими компонентами – відбуваються реакції обміну. Реакції обміну між основою і кислотою називають нейтралізацією. Ме(ОН)х + Нх. КЗ → Мех. КЗу + Н2 ООснова + кислота → сіль + вода. Демонстрація взаємодії лугів з кислотами. Демонстрація взаємодії нерозчинних основ з кислотами. КОН + Н2 SО4 = K2 SO4 + H2 OCu(OH)2 + H2 SO4 = Cu. SO4 + H2 OFe(OH)2 + H2 SO4 = Fe. SO4 + H2 O
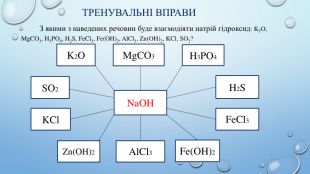
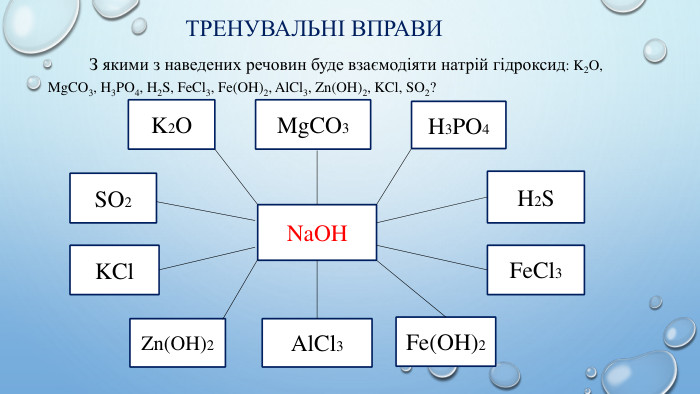
Взаємодія лугів із солями. Взаємодія лугу з сіллю є реакцією обміну, яка відбувається в розчині. Продукти такої реакції - інша основа та сіль. Сіль-реагент має бути розчинною у воді, а нова основа чи сіль – нерозчинною. Ме1(ОН)х + Ме2х. КЗу = Ме1х. КЗу + Ме2(ОН)х. Основа1 + сіль1 → сіль2 + основа2 Демонстрація взаємодії лугів з солями. Cu. SO4 + Na. OH = Cu(OH)2 + Na2 SO4 Al. Cl3 + Na. OH = Al(OH)3 + Na. Cl. Fe. SO4 + Na. OH = Fe(OH)2 + Na2 SO4
Термічний розклад основ. Майже всі основи (крім гідроксидів натрію і калію, лужних металів) у результаті нагрівання легко розкладаються на відповідний оксид і воду.𝑀𝑒𝑂𝐻𝑥→𝑀𝑒𝑥𝑂𝑦+𝐻2𝑂Основа → оксид металу + вода. Демонстрація термічного розкладу нерозчинної основи. Cu(OH)2 = Cu. O + H2 O
Способи добування основ1. Розчинні гідроксиди (луги) можна добути взаємодією активних металів та їх оксидів з водою:2 Na + 2 H2 O = 2 Na. OH + H2↑;Na2 O + H2 O = 2 Na. OH.2. Взаємодією розчинів солей з лугами можна також використати для добування деяких розчинних основ. Якщо на розчини солей натрію, літію та деяких інших металів подіяти гідроксидом барію або кальцію, то внаслідок реакції утвориться розчинна основа і нерозчинна сіль, яку можна легко відокремити від розчину: Na2 CO3 + Ca(OH)2 = 2 Na. OH + Ca. CO3↓;Li2 SO4 + Ba(OH)2 = 2 Li. OH + Ba. SO4↓.3. Луги можна добути електролізом водних розчинів солей.4. Нерозчинні гідроксиди можна добути реакцією обміну між сіллю (найчастіше сіллю малоактивного металічного елемента) та лугом у розчині: Fe. Cl3 + 3 Na. OH = 3 Na. Cl + Fe(OH)3↓.
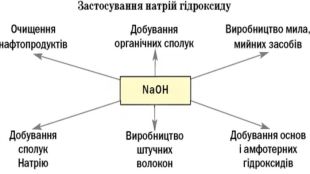
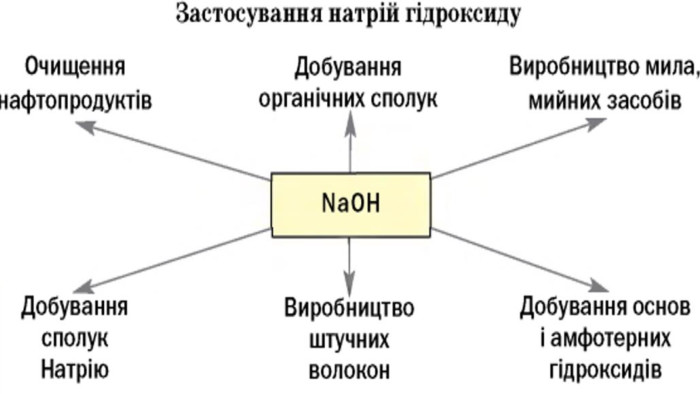
Практичне застосування деяких основ. Na. OH - у великій кількості використовується у нафтовій промисловості для очищення нафтопродуктів переробки нафти, в миловарній, паперовій, текстильній промисловостях, у виробництві штучного шовку та в ряді інших виробництв. Кип’ятінням деревини з Na. OH добувають целюлозу. Обробка бавовняних тканин натрій гідроксидом поліпшує їх здатність до фарбування. Натрій гідроксид – важливий реактив у аналітичній хімії. КОН – застосовують у миловарній промисловості для виготовлення рідкого мила. Внаслідок великої гігроскопічності його використовують як осушувач, для вбирання вуглекислого газу, у хірургії для припікання, як вихідний продукт для добування різних солей калію.
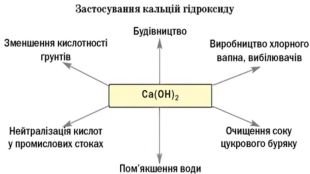
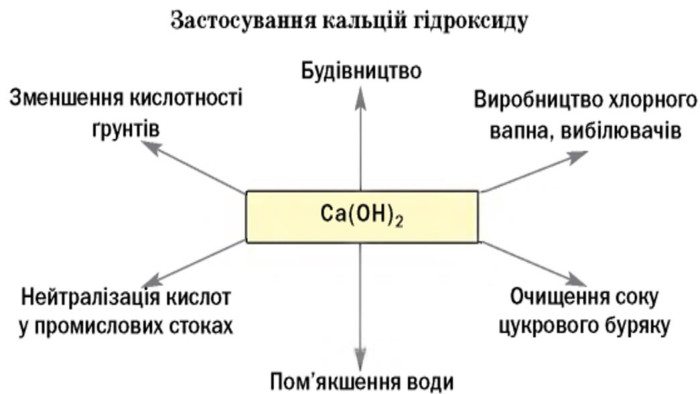
Ca(OH)2 – відомий під назвою «гашене вапно», широко використовують у будівництві. Суміш гашеного вапна з піском і водою називають вапняним розчином і використовують для скріплення цегли під час мурування цегляних стін, а також як штукатурка. Вапняний розчин твердне спочатку внаслідок випаровування води, а потім – внаслідок вбирання гашеним вапном з повітря вуглекислого газу й утворення кальцій карбонату. Ca(OH)2 використовують для добування хлорного вапна. Як «вапняну воду» застосовують для білення, у медицині проти опіків або як протиотруту при отруєннях сульфатною чи оксалатною кислотами. Ba(OH)2 – насичений водний розчин відомий як «баритова вода», є важливим лабораторним реактивом для виявлення СО2, йонів SO42– та СO32– та відносно дешевою розчинною основою.
Тренувальні вправи. Вибрати твердження, що стосуються властивостей основ: Усі основи діють на індикатори. Реакції взаємодії основ з кислотами називаються реакціями нейтралізації. Луги взаємодіють із кислотними оксидами. Луги здатні до термічного розкладу. Усі основи взаємодіють із солями. Луги взаємодіють із основними оксидами. Під час термічного розкладу основ утворюються оксид металу і вода.


про публікацію авторської розробки
Додати розробку