Презентація з теми "Фізичні властивості середніх солей. Склад і номенклатура."
Про матеріал
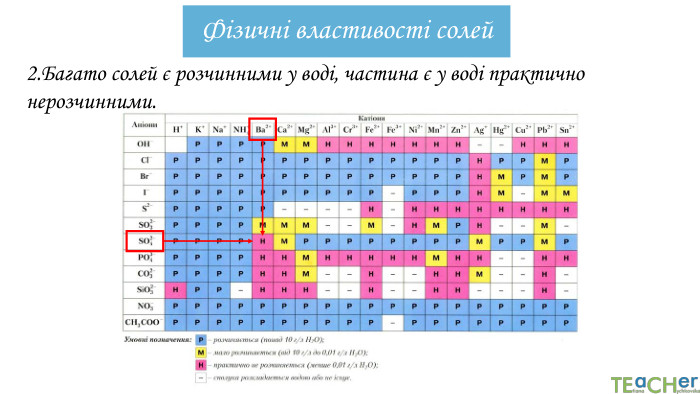
Презентація містить інформацію як називати солі, як за валентністю правильно складаи формули солей, а також цікаву рефлексію в стилі тіктоку. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку