Фізичні та хімічні властивості основ. Застосування основ.
Про матеріал
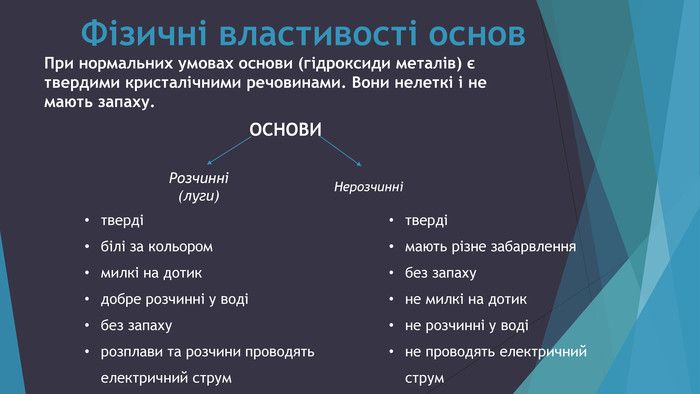
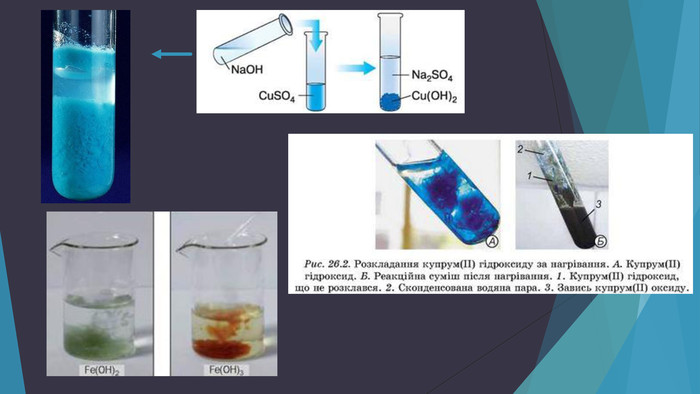
У презентації подано фізичні та хімічні властивості основ, правила роботи з лугами та застосування основ. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку