Фізичні та хімічні властивості солей. Поширеність в природі.
Про матеріал
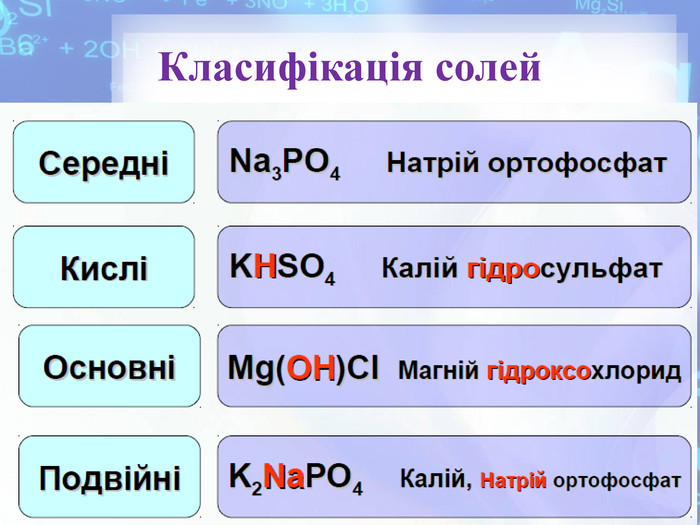
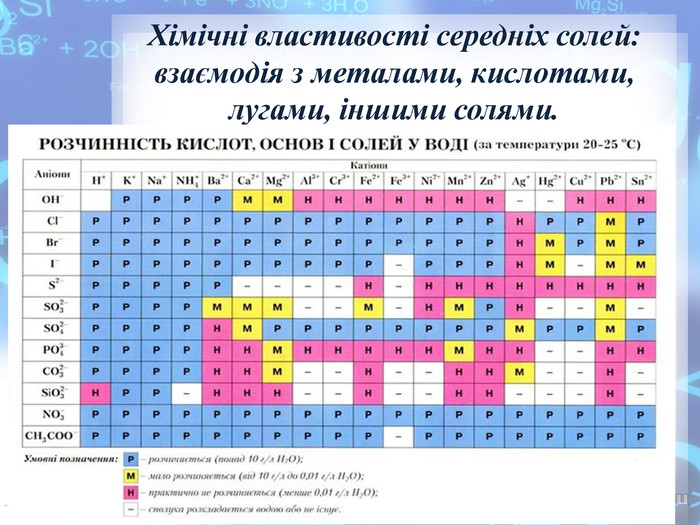
Фізичні та хімічні властивості солей. Поширеність в природі. Рівняння реакцій хімічних властивостей, приклади деяких солей та їх властивості. класифікація солей. Перегляд файлу
Зміст слайдів

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку