Фізичні властивості оксидів
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
ЦЕНТРАЛЬНОУКРАЇНСЬКИЙ ДЕРЖАВНИЙ ПЕДАГОГІЧНИЙ УНІВЕРСИТЕТ ІМЕНІ ВОЛОДИМИРА ВИННИЧЕНКА
“ЗАТВЕРДЖУЮ”
Груповий методист : Форостовська Т. О
Вчитель хімії: ________
«____»________________2022 р
КОНСПЕКТ УРОКУ
з хімії у 8 –Б класі
з теми : «Фізичні властивості оксидів. Класифікація оксидів.»
студентки - практикантки IV курсу
факультету математики, природничих наук та технологій
спеціальність 014 Середня освіта (Біологія та здоров’я людини)
Осікової Марини Володимирівни
Дата проведення:
“______” _________________ 2022 року
Оцінка вчителя _______ ____________
(підпис вчителя)
Урок 1. Тема: Фізичні властивості оксидів. Класифікація оксидів.
Мета:
навчальна: ознайомити учнів з фізичними властивостями оксидів; розвивати вміння класифікувати складні неорганічні речовини, оксиди; за назвою речовини складати її формулу;
розвивальна: активізувати пізнавальну активність учнів, сприяти розвитку логічного мислення, формувати вміння використовувати придбані знання на практиці;
виховна: творче ставлення до справи, старанність, працьовитість, відповідальність за результати своєї роботи; комунікабельність, вміння працювати самостійно і в колективі.
Тип уроку: вивчення нового матеріалу.
Методи уроку:
• словесні: бесіда, розповідь, пояснення.
• наочні: використання презентації.
• практичні: розв’язування завдань, укладання опорного конспекту.
Обладнання: зразки оксидів, періодична система хімічних елементів Д. І. Менделєєва, комп’ютер.
Терміни та поняття: оксиди, класифікація оксидів.
Структура уроку та хронометраж:
І. Організація класу (2 хв.)
ІІ. Актуалізація опорних знань (6 хв.)
III. Мотивація навчальної діяльності, повідомлення теми та мети (4 хв.)
IV. Вивчення нового матеріалу (20 хв.)
V. Узагальнення та систематизація знань (10 хв.)
VI. Підбиття підсумків уроку (2 хв.)
VIІ. Домашнє завдання (1 хв.)
Хід уроку
І. Організація класу.
(привітання, перевірка наявності учнів; організація уваги учнів до уроку).
ІІ. Актуалізація опорних знань
Бесіда за запитаннями:
- Що таке солі?
- Напишіть загальну формулу солей?
- Що таке кислотний залишок?
- Яка валентність кислотного залишку?
- На які види класифікують солі?
Серед запропонованих формул виберіть формули оксидів та запишіть їх :
MnO2, H2SO4, NaOH, Ca(OH)2, CuSO4, N2O5, HNO3, Al2(SO4)3:
III. Мотивація навчальної діяльності, повідомлення теми та мети
Класифікація оксидів заснована не тільки на їх складі, але й на їх властивостях, на їх зв’язку з іншими класами неорганічних сполук. Оксиди можна назвати родоначальниками деяких інших класів сполук. В залежності від елемента, що утворює оксид, з них можуть утворюватися кислоти чи основи.
- Як ви вважаєте, якщо до складу оксиду входить неметалічний елемент, то яка речовина з нього може утворитися: кислота чи основа? Як можна назвати такий оксид?
- Якщо до складу оксиду входить металічний елемент, то яка речовина з нього може утворитися: кислота чи основа? Як можна назвати такий оксид?
Сьогодні ми з вами поглибимо свої знання про оксиди, отже запишемо з вами тему уроку: Фізичні властивості оксидів. Класифікація оксидів.
IV. Вивчення нового матеріалу
Оксиди — це складні речовини, що складаються з атомів двох хімічних елементів, один з яких Оксиген.
Номенклатура оксидів
Для назви сполуки оксиду спочатку вказують елемент, що входить до складу оксиду у називному відмінку, потім додают слово «оксид»:
наприклад: Na2O — натрій оксид, Al2O3 — алюміній оксид.
Якщо елемент, який утворює оксид, має змінну валентність, то в назві оксиду вказується його валентність римською цифрою в дужках відразу після назви .
Наприклад: Cu2O — купрум(I) оксид, CuO — купрум(II) оксид, FeO — ферум(II) оксид, Fe2O3 — ферум(III) оксид, Cl2O7 — хлор(VII) оксид.
Інколи використовують й інші найменування оксидів.
За кількістю атомів Оксигену: якщо оксид містить лише один атом Оксигену, то його називають монооксидом або моноокисом, якщо два — диоксидом або двоокисом, якщо три — то триоксидом або триокисом, тощо.
Наприклад: карбон монооксид CO, карбон двоокис CO2, сульфур триоксид SO3.
Також поширені історично сформовані (тривіальні) назви оксидів, наприклад, чадний газ CO, сірчаний ангідрид SO3, СаО і SO2 — «негашене вапно» і «сірчистий газ».1
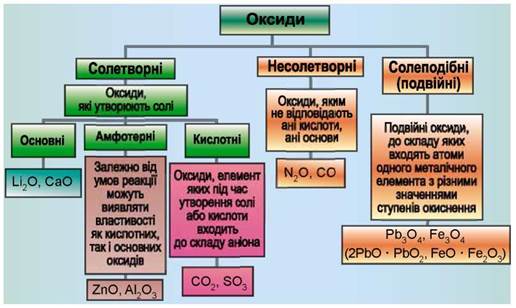
1. Класифікація оксидів
Оксиди прийнято групувати в залежності від їх здатності реагувати з кислотами і основами. Розрізняють три найважливіші групи оксидів: основні, кислотні та амфотерні.
Усі кислотні оксиди, за винятком силіцій оксиду SiO2, реагують із водою. Продукти реакції також виявляють кислотні властивості і є кислотами:
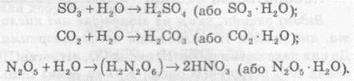
Оксиди, яким відповідають кислоти, називають кислотними оксидами.
Більшість кислотних оксидів — це оксиди неметалічних елементів. Але кислотні оксиди здатні утворювати й металічні елементи, якщо ці елементи можуть виявляти дуже високі валентності, вищі, аніж 4. Так, до кислотних оксидів належать СrO3, Мn2O7.
Кислотні оксиди ще називають ангідридами кислот. Слово «ангідрид» буквально означає безводнена кислота (від ан — «без» та грец. гідор — «вода»). Слова «ангідрид» та «кислотний оксид» — синоніми. Кожній оксигеновмісній кислоті відповідає кислотний оксид.
Кислоти й відповідні ангідриди
|
Кислоти |
Кислотний оксид (ангідрид) |
Кислота |
Кислотний оксид (ангідрид) |
|
H2SiO3 |
SiO2 |
HClO4 |
Cl2O7 |
|
H2SO4 |
SO3 |
Н2СrO4 |
СrO3 |
|
H3PO4 |
P2O5 |
НМnO4 |
Мn2O7 |
Основні оксиди
Оксиди, яким відповідають основи, називають основними оксидами.
До основних оксидів належать оксиди металічних елементів. Це, як правило, оксиди одно-, дво- і тривалентних металів.
Більшість основних оксидів з водою не взаємодіють. У реакцію з водою вступають лише ті оксиди, яким відповідають луги:
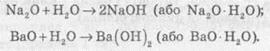
Основні оксиди й відповідні основи
|
Основні оксиди |
Відношення до води |
Основи |
|
Na2O |
Взаємодіють із водою |
NaOH |
|
K2O |
КОН |
|
|
SrO |
Sr(OH)2 |
|
|
ВаО |
Ва(ОН)2 |
|
|
Ag2O |
Не взаємодіють із водою |
AgOH |
|
CuO |
Cu(OH)2 |
|
|
Fe2O3 |
Fe(OH)3 |
Амфотерними називають оксиди, які реагують як з кислотами, так і з основами, утворюючи солі.
Амфотерні властивості проявляє цинк оксид ZnO, алюміній оксид Al2O3, берилій оксид BeO.
Несолетворні оксиди
Відомі оксиди, яким не відповідає ані кислота, ані основа, їх називають несолетворними. До них належать карбон(ІІ) оксид СО, нітроген(ІІ) оксид NO, нітроген(I) оксид N2O та деякі інші. Вони являють собою гази, малорозчинні у воді, і не вступають із нею в хімічні реакції. Усі інші оксиди (кислотні й основні) називають солетворними.
2. Фізичні властивості оксидів. Властивості оксидів, як і інших речовин, залежать від їхньої будови, тобто від того, з яких частинок вони складаються (атомів, молекул, йонів). У йонних оксидах протилежно заряджені йони сильно притягуються між собою, тому ці оксиди за звичайних умов є твердими, мають високу температуру плавлення, більшість нерозчинні у воді, інші з нею реагують. Між молекулами притягання дуже слабке, тому оксиди з молекулярною будовою характеризуються невисокими температурами плавлення і кипіння, різним агрегатним станом за звичайних умов, розчинністю у воді, деякі мають запах. Оксиди з 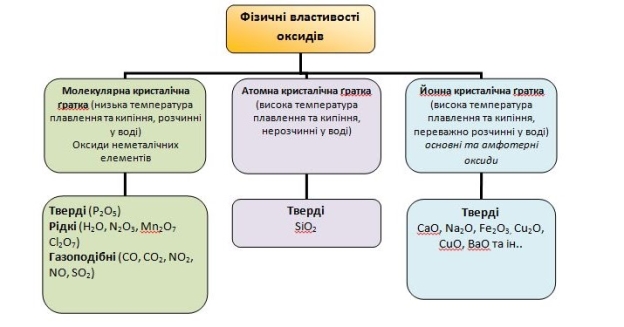 атомною будовою є твердими, із високими температурами плавлення і кипіння, нерозчинні у воді. Йонні оксиди (СаО, Na2O), молекулярні (H2O, SO2, CO2), атомні (SiO2).
атомною будовою є твердими, із високими температурами плавлення і кипіння, нерозчинні у воді. Йонні оксиди (СаО, Na2O), молекулярні (H2O, SO2, CO2), атомні (SiO2).
Демонстрація 7. Зразки оксидів
Колір оксидів може бути найрізноманітнішим.
![Гірський кришталь-камінь: [фото, властивості і характеристики] • NRV UA](/uploads/files/1561015/289959/317622_html/images/289959 5.jpeg) Безбарвним, наприклад, є силіцій оксид у вигляді кварцу або гірського кришталю.
Безбарвним, наприклад, є силіцій оксид у вигляді кварцу або гірського кришталю.
 З рідких оксидів кольору не має вода. Більшість газоподібних оксидів також не має забарвлення.
З рідких оксидів кольору не має вода. Більшість газоподібних оксидів також не має забарвлення.
Купрум(I) оксид Cu2O — речовина червоного кольору.
Купрум(I) оксид

Купрум(II) оксид CuO — речовина чорного кольору.
Купрум(II) оксид
 Магній оксид MgO — речовина білого кольору.
Магній оксид MgO — речовина білого кольору.
Магній оксид

Хром(III) оксид Cr2O3 — речовина темно-зеленого кольору.
Хром(III) оксид

Нітроген(IV) оксид NO2 — газоподібна речовина бурого кольору. Такий самий колір у твердого ферум(III) оксиду Fe2O3.
Нітроген(IV) оксид
V. Узагальнення та систематизація знань
- Випишіть формули кислотних оксидів та назвіть їх: CO2, FeO, MgO, BaO, P2O5, SO2, Сl2О7, CrO3.
- Випишіть формули основних оксидів та назвіть їх: Cl2O7, SO3, ВаО, MgO, SiO2, Na2O, SrO, Мn2O7.
- Від чого залежать фізичні властивості оксидів? Наведіть приклади оксидів, що за звичайних умов перебувають у твердому, рідкому й газоподібному станах.
VI. Підбиття підсумків уроку
Вправа «Незакінчене речення»
На уроці я …
- дізнався, дізналась …
- найбільше сподобалось…
VIІ. Домашнє завдання
Опрацювати §22.
Виконати завдання №152, 153 (ст. 126), № 156, 157, 158 (ст. 127)


про публікацію авторської розробки
Додати розробку
