Фосфор. Алотропні модифікації фосфору






![Окисні властивості фосфор проявляє у реакціях з активними металами: 3 Na+P = Na3 P Отримані сполуки називаються фосфідами (Na3 P— натрій фосфід). На відміну від азоту фосфор не сполучається з воднем. Фосфор може мати ІІІ чи V валентність. Для нього найбільш характерні наступні ступені окиснення: +5 (напр. фосфатна кислота H3 PO4), +3 (напр. фосфітна кислота H2[PO3 Н], фосфор трихлорид PCl3) і –3 (напр. фосфін PH3). Чорний фосфор. Хімічний зв’язок фосфору з сусідніми атомами переважно ковалентний. Хімічні властивості різних алотропних модифікацій фосфору є подібними. Білий фосфор є більш активним і легше вступає у реакції. Відновлювальні властивості фосфор проявляє у реакції з киснем. Білий фосфор самозаймається на повітрі, а червоний загоряється при нагріванні. При цьому утворюється густий білий дим фосфор(V) оксиду: 4 P+5 O2 = 2 P2 O5 Червоний фосфор використовується при виготовленні сірників. Окисні властивості фосфор проявляє у реакціях з активними металами: 3 Na+P = Na3+P Отримані сполуки називаються фосфідами (Na3 P— натрій фосфід). На відміну від азоту фосфор не сполучається з воднем. Відновлювальні властивості фосфор проявляє у реакції з киснем. Білий фосфор самозаймається на повітрі, а червоний загоряється при нагріванні. При цьому утворюється густий білий дим фосфор(V) оксиду: 4 P+5 O2 = 2 P2 O5 Червоний фосфор використовується при виготовленні сірників. Окисні властивості фосфор проявляє у реакціях з активними металами: 3 Na+P = Na3 P Отримані сполуки називаються фосфідами (Na3 P— натрій фосфід). На відміну від азоту фосфор не сполучається з воднем. Фосфор може мати ІІІ чи V валентність. Для нього найбільш характерні наступні ступені окиснення: +5 (напр. фосфатна кислота H3 PO4), +3 (напр. фосфітна кислота H2[PO3 Н], фосфор трихлорид PCl3) і –3 (напр. фосфін PH3). Чорний фосфор. Хімічний зв’язок фосфору з сусідніми атомами переважно ковалентний. Хімічні властивості різних алотропних модифікацій фосфору є подібними. Білий фосфор є більш активним і легше вступає у реакції. Відновлювальні властивості фосфор проявляє у реакції з киснем. Білий фосфор самозаймається на повітрі, а червоний загоряється при нагріванні. При цьому утворюється густий білий дим фосфор(V) оксиду: 4 P+5 O2 = 2 P2 O5 Червоний фосфор використовується при виготовленні сірників. Окисні властивості фосфор проявляє у реакціях з активними металами: 3 Na+P = Na3+P Отримані сполуки називаються фосфідами (Na3 P— натрій фосфід). На відміну від азоту фосфор не сполучається з воднем. Відновлювальні властивості фосфор проявляє у реакції з киснем. Білий фосфор самозаймається на повітрі, а червоний загоряється при нагріванні. При цьому утворюється густий білий дим фосфор(V) оксиду: 4 P+5 O2 = 2 P2 O5 Червоний фосфор використовується при виготовленні сірників.](/uploads/files/4643450/362080/416810_images/9.jpg)
![Фосфор може мати ІІІ чи V валентність. Для нього найбільш характерні наступні ступені окиснення: +5 (напр. фосфатна кислота H3 PO4), +3 (напр. фосфітна кислота H2[PO3 Н], фосфор трихлорид PCl3) і –3 (напр. фосфін PH3). Окисні властивості фосфор проявляє у реакціях з активними металами: 3 Na+P = Na3 P Отримані сполуки називаються фосфідами (Na3 P— натрій фосфід). На відміну від азоту фосфор не сполучається з воднем. Відновлювальні властивості фосфор проявляє у реакції з киснем. Білий фосфор самозаймається на повітрі, а червоний загоряється при нагріванні. При цьому утворюється густий білий дим фосфор(V) оксиду: 4 P+5 O2 = 2 P2 O5 Червоний фосфор використовується при виготовленні сірників. Поширення фосфору в природі. Зустрічається тільки в хімічно зв’язаному вигляді в організмах і мінералах. В живих організмах фосфор міститься в формі фосфоліпідів (наприклад, лецитин в нервовій і мозковій речовині), фосфопротеїдів (ферменти), різних ефірів ортофосфорної кислоти і кальцій ортофосфату (в кістках і зубах). Екскременти птахів утворюють природну фосфоровмісну речовину – гуано. Зокрема фосфати містяться в деяких рудах заліза. Хімічний зв’язок фосфору з сусідніми атомами переважно ковалентний. Хімічні властивості різних алотропних модифікацій фосфору є подібними. Білий фосфор є більш активним і легше вступає у реакції. Фосфор може мати ІІІ чи V валентність. Для нього найбільш характерні наступні ступені окиснення: +5 (напр. фосфатна кислота H3 PO4), +3 (напр. фосфітна кислота H2[PO3 Н], фосфор трихлорид PCl3) і –3 (напр. фосфін PH3). Окисні властивості фосфор проявляє у реакціях з активними металами: 3 Na+P = Na3 P Отримані сполуки називаються фосфідами (Na3 P— натрій фосфід). На відміну від азоту фосфор не сполучається з воднем. Відновлювальні властивості фосфор проявляє у реакції з киснем. Білий фосфор самозаймається на повітрі, а червоний загоряється при нагріванні. При цьому утворюється густий білий дим фосфор(V) оксиду: 4 P+5 O2 = 2 P2 O5 Червоний фосфор використовується при виготовленні сірників. Поширення фосфору в природі. Зустрічається тільки в хімічно зв’язаному вигляді в організмах і мінералах. В живих організмах фосфор міститься в формі фосфоліпідів (наприклад, лецитин в нервовій і мозковій речовині), фосфопротеїдів (ферменти), різних ефірів ортофосфорної кислоти і кальцій ортофосфату (в кістках і зубах). Екскременти птахів утворюють природну фосфоровмісну речовину – гуано. Зокрема фосфати містяться в деяких рудах заліза. Хімічний зв’язок фосфору з сусідніми атомами переважно ковалентний. Хімічні властивості різних алотропних модифікацій фосфору є подібними. Білий фосфор є більш активним і легше вступає у реакції.](/uploads/files/4643450/362080/416810_images/10.jpg)


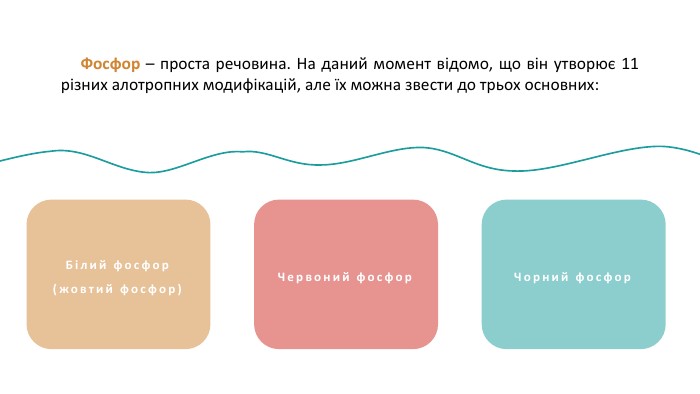
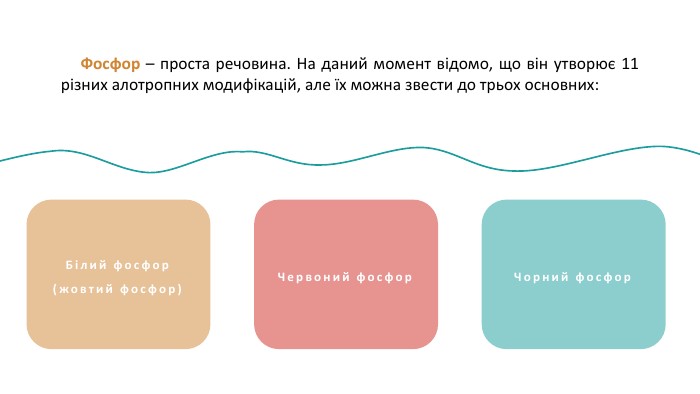
Фосфор (P) — хімічний елемент, неметал, що розташований під 15 номером у 5 групі, 3 періоді періодичної системи хімічних елементів. Атом фосфору складається з позитивно зарядженого ядра (+15) та трьох електронних оболонок, на яких знаходиться 15 електронів. PФосфор30, 974153s23p3 ОСФОРБудоваатома :+152е8е5е1s22s22p63s23p3123 Чорний фосфор. Білий фосфор(жовтий фосфор) Фосфор – проста речовина. На даний момент відомо, що він утворює 11 різних алотропних модифікацій, але їх можна звести до трьох основних:
Фосфор – проста речовина. На даний момент відомо, що він утворює 11 різних алотропних модифікацій, але їх можна звести до трьох основних: Білий фосфор(жовтий фосфор)Червоний фосфор. Чорний фосфор Фосфор (P) — хімічний елемент, неметал, що розташований під 15 номером у 5 групі, 3 періоді періодичної системи хімічних елементів. Атом фосфору складається з позитивно зарядженого ядра (+15) та трьох електронних оболонок, на яких знаходиться 15 електронів. P
Білий фосфор(жовтий фосфор) Білий фосфор має молекулярну решітку, в вузлах якої знаходяться тетраедричні молекули Р4. Дуже активна, м’яка воскоподібна речовина білуватого (блідо-жовтого) кольору, з неприємним часниковим запахом, розчинна у сірковуглецеві і бензолі, нерозчинна в рідкій воді, але з водяною парою утворює газову суміш. Дуже отруйна. Чорний фосфор. Червоний фосфор Фосфор – проста речовина. На даний момент відомо, що він утворює 11 різних алотропних модифікацій, але їх можна звести до трьох основних:
Червоним фосфором можуть називатися кілька алотропних модифікацій, які розрізняються по щільності і забарвленню: воно коливається від помаранчевого до темно-червоного чи фіолетового. Червоний фосфор Червоний фосфор менш активний, порівняно з білим, не розчиняється у воді і сірковуглецю, не світиться в темряві, є абсолютно нешкідливим. Білий фосфор(жовтий фосфор)Чорний фосфор Фосфор – проста речовина. На даний момент відомо, що він утворює 11 різних алотропних модифікацій, але їх можна звести до трьох основних:
Білий фосфор(жовтий фосфор)Червоний фосфор Фосфор – проста речовина. На даний момент відомо, що він утворює 11 різних алотропних модифікацій, але їх можна звести до трьох основних: Чорний фосфор Чорний фосфор утворюється при підвищеному тиску в білому фосфорі. Це найстійкіша модифікація фосфору. Кристалічний чорний фосфор так само має кілька модифікацій. Ромбічна модифікація побудована з гексагональних кілець Р6, упакованих в шари, причому кільця не є плоскими. Хімічний зв’язок фосфору з сусідніми атомами переважно ковалентний. Хімічні властивості різних алотропних модифікацій фосфору є подібними. Білий фосфор є більш активним і легше вступає у реакції.
Окисні властивості фосфор проявляє у реакціях з активними металами: 3 Na+P = Na3 P Отримані сполуки називаються фосфідами (Na3 P— натрій фосфід). На відміну від азоту фосфор не сполучається з воднем. Фосфор може мати ІІІ чи V валентність. Для нього найбільш характерні наступні ступені окиснення: +5 (напр. фосфатна кислота H3 PO4), +3 (напр. фосфітна кислота H2[PO3 Н], фосфор трихлорид PCl3) і –3 (напр. фосфін PH3). Чорний фосфор. Хімічний зв’язок фосфору з сусідніми атомами переважно ковалентний. Хімічні властивості різних алотропних модифікацій фосфору є подібними. Білий фосфор є більш активним і легше вступає у реакції. Відновлювальні властивості фосфор проявляє у реакції з киснем. Білий фосфор самозаймається на повітрі, а червоний загоряється при нагріванні. При цьому утворюється густий білий дим фосфор(V) оксиду: 4 P+5 O2 = 2 P2 O5 Червоний фосфор використовується при виготовленні сірників. Окисні властивості фосфор проявляє у реакціях з активними металами: 3 Na+P = Na3+P Отримані сполуки називаються фосфідами (Na3 P— натрій фосфід). На відміну від азоту фосфор не сполучається з воднем. Відновлювальні властивості фосфор проявляє у реакції з киснем. Білий фосфор самозаймається на повітрі, а червоний загоряється при нагріванні. При цьому утворюється густий білий дим фосфор(V) оксиду: 4 P+5 O2 = 2 P2 O5 Червоний фосфор використовується при виготовленні сірників.
Фосфор може мати ІІІ чи V валентність. Для нього найбільш характерні наступні ступені окиснення: +5 (напр. фосфатна кислота H3 PO4), +3 (напр. фосфітна кислота H2[PO3 Н], фосфор трихлорид PCl3) і –3 (напр. фосфін PH3). Окисні властивості фосфор проявляє у реакціях з активними металами: 3 Na+P = Na3 P Отримані сполуки називаються фосфідами (Na3 P— натрій фосфід). На відміну від азоту фосфор не сполучається з воднем. Відновлювальні властивості фосфор проявляє у реакції з киснем. Білий фосфор самозаймається на повітрі, а червоний загоряється при нагріванні. При цьому утворюється густий білий дим фосфор(V) оксиду: 4 P+5 O2 = 2 P2 O5 Червоний фосфор використовується при виготовленні сірників. Поширення фосфору в природі. Зустрічається тільки в хімічно зв’язаному вигляді в організмах і мінералах. В живих організмах фосфор міститься в формі фосфоліпідів (наприклад, лецитин в нервовій і мозковій речовині), фосфопротеїдів (ферменти), різних ефірів ортофосфорної кислоти і кальцій ортофосфату (в кістках і зубах). Екскременти птахів утворюють природну фосфоровмісну речовину – гуано. Зокрема фосфати містяться в деяких рудах заліза. Хімічний зв’язок фосфору з сусідніми атомами переважно ковалентний. Хімічні властивості різних алотропних модифікацій фосфору є подібними. Білий фосфор є більш активним і легше вступає у реакції.
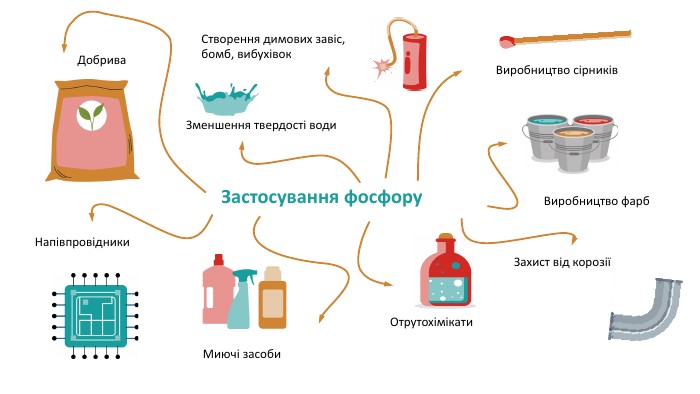
Поширення фосфору в природі. Зустрічається тільки в хімічно зв’язаному вигляді в організмах і мінералах. В живих організмах фосфор міститься в формі фосфоліпідів (наприклад, лецитин в нервовій і мозковій речовині), фосфопротеїдів (ферменти), різних ефірів ортофосфорної кислоти і кальцій ортофосфату (в кістках і зубах). Екскременти птахів утворюють природну фосфоровмісну речовину – гуано. Зокрема фосфати містяться в деяких рудах заліза. Застосування фосфору Окисні властивості фосфор проявляє у реакціях з активними металами: 3 Na+P = Na3 P Отримані сполуки називаються фосфідами (Na3 P— натрій фосфід). На відміну від азоту фосфор не сполучається з воднем. Відновлювальні властивості фосфор проявляє у реакції з киснем. Білий фосфор самозаймається на повітрі, а червоний загоряється при нагріванні. При цьому утворюється густий білий дим фосфор(V) оксиду: 4 P+5 O2 = 2 P2 O5 Червоний фосфор використовується при виготовленні сірників.
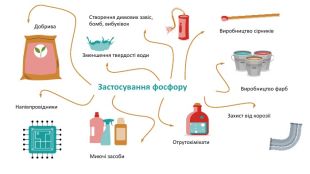
Поширення фосфору в природі. Зустрічається тільки в хімічно зв’язаному вигляді в організмах і мінералах. В живих організмах фосфор міститься в формі фосфоліпідів (наприклад, лецитин в нервовій і мозковій речовині), фосфопротеїдів (ферменти), різних ефірів ортофосфорної кислоти і кальцій ортофосфату (в кістках і зубах). Екскременти птахів утворюють природну фосфоровмісну речовину – гуано. Зокрема фосфати містяться в деяких рудах заліза. Застосування фосфору. Виробництво фарб. Добрива. Напівпровідники. Миючі засоби. Отрутохімікати. Захист від корозіїЗменшення твердості води. Виробництво сірників. Створення димових завіс, бомб, вибухівок. Дякую за увагу!embedded1


про публікацію авторської розробки
Додати розробку