Генетичний зв`язок між класми неорганічних сполук
Методична розробка уроку
вчителя хімії комунального закладу «Середня загальноосвітня школа № 34» Кам’янської міської ради
Похвалит Юлії Анатоліївни (вищої категорії, «старший вчитель»)
Тема уроку: «Генетичний зв’язок між класами неорганічних сполук»
Мета: - закріпити знання про складні речовини, основні класи неорганічних сполук (оксиди, кислоти, основи, солі); розібрати взаємозв’язок процесів утворення і взаємоперетворення неорганічних сполук; розкрити уявлення про єдність речовин, їх різноманітність і генетичний зв’язок;
- розвивати уміння записувати формули неорганічних сполук за назвами, давати назви речовинам за формулами; удосконалити вміння записувати рівняння хімічних реакцій, виконувати схеми перетворень, логічне мислення;
- формувати уміння, навички, компетенції узагальнювати й систематизувати вивчене, оцінювати власні досягнення, науковий світогляд.
Тип уроку: вдосконалення знань, умінь і навичок
Методи навчання: групова робота, фронтальне опитування, робота в парах, робота з опорною схемою.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, ряд активності металів, опорні схеми класів неорганічних сполук, генетичного зв’язку класів неорганічних сполук, програма для інтерактивної дошки White board, інтернет-сервіс освітнього простору Learning Apps.
Хід уроку
І. Організаційний етап
Вчитель:- Що ви очікуєте від сьогоднішнього уроку? Як будете працювати ?
ІІ. Актуалізація опорних знань:
- «Хімічна розминка» (озвучити назви речовин за формулами, перевірити себе, на екрані інтерактивної дошки, перетягнувши за стрілку заховану відповідь)
|
СаО |
Алюміній сульфат |
H3PO4, |
Калій оксид |
|
Cu(OH)2 |
Фосфор (V) оксид |
HCI |
Натрій гідроксид |
|
Na2O |
Магній хлорид |
Fe(OH)3 |
Хлоридна кислота |
|
AL2(SO4)3 |
Нітратна кислота |
Ba(OH)2 |
Кальцій оксид |
|
Fe(OH)2 |
Ортофосфатна кислота |
HNO2 |
Нітроген (V) оксид |
|
P2O5 |
Ферум (ІІІ) гідроксид |
Zn3(PO4)2 |
карбон (ІV)оксид |
|
K2O |
Нітритна кислота |
CO2 |
Натрій оксид |
|
MgCI2 |
Цинк ортофосфат |
H2S |
Купрум (ІІ) гідроксид |
|
HNO3 |
Хлоридна кислота |
KOH |
Сульфур (VІ) оксид |
|
NaOH |
Калій гідроксид |
HCI |
Сульфідна кислота |
|
N2O5 |
Барій гідроксид |
SO3 |
Ферум (ІІ) гідроксид |
- Прийом «Знайди зайве»
(Учні визначають в кожному рядку «зайву» формулу й пояснити свій вибір)
|
Cu(OH)2 |
NaOH |
Fe(OH)2 |
HNO3 |
|
Na2O |
P2O5 |
SO3 |
CO2 |
|
МgO |
CaO |
KOH |
SO2 |
|
MgCI2 |
AL2(SO4)3 |
Zn3(PO4)2 |
HNO3 |
|
HCI |
Fe(OH)3 |
H3PO4 |
H2S |
- Прийом «Знайди помилки» (учні на екрані інтерактивної дошки виправляють помилки)
ALOH3, MgO, H3SO4, LiO2H, H2S3
ZnO2, H2SO3, CO4, Ag2NO3, KOH2
K2O2, HCI, P2O, Ba(OH)3 , H2SO2
- «Озвучте відповідь» (під питаннями заховані відповіді, учні відповідають на питання, відкривають відповідь, самоперевірка)
|
Питання
|
Відповіді |
|
Речовина |
Все з чого складаються фізичні тіла |
|
Класифікують речовини за походженням |
Неорганічні і органічні |
|
Класифікують речовини за складом |
Прості і складні |
|
Складні речовини
|
Складаються із двох і більше хімічних елементів |
|
Як класифікуються складні речовини |
Оксиди, основи, кислоти, солі |
|
Оксиди |
Складні речовини, що складаються із двох хімічних елементів, одним з яких є Оксиген |
|
Основи |
Складні речовини, що складаються із атомів металів і групи ОН |
|
Кислоти |
Складні речовини, які складаються із атомів Гідрогену і кислотного залишку |
|
Солі |
Складні речовини, які утворені атомом металу і кислотного залишку |
- Обговорення схеми класифікації речовин (опрацювання мультимедійної презентації, складання схеми в зошиті)
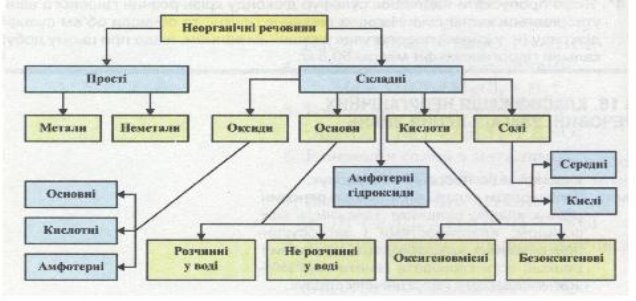
ІІІ. Мотивація навчальної діяльності.
- Повторили класифікацію неорганічних сполук.
Вчитель: З’ясуємо які існують зв’язки між різними класами речовин, чи переходять речовини від одного класу до інших, як змінюються їх властивості.
- Відображення завдання (відповіді та підказки теми уроку)
(На екрані інтерактивної дошки - зашифрована тема уроку, поступово відкривають ключові слова за якими треба здогадатися, яка тема уроку).
«Генетичним зв’язком між класами неорганічних сполук»
ІV. Вивчення матеріалу.
Вчитель: Чому він називається «генетичним»?
(учні відповідають, про взаємозв’язок речовин)
Вчитель: Вірно, розглядаючи хімічні властивості неорганічних сполук, можна простежити споріднений зв’язок між класами неорганічних сполук.
Генетичний зв’язок — це зв’язок між речовинами різних класів, що ґрунтується на взаємоперетворенні речовин і показує походження одних речовин від інших.
Знання генетичних зв’язків пояснює різноманітність класів неорганічних сполук і речовин у природі, відкриває перед ученими перспективи створення нових речовин.
Вчитель: Під час вивчення хімічних властивостей класів неорганічних сполук ви помітили, що їх властивості відрізняються, якщо вони починаються або від металу або від неметалу.
Тому розрізняють два генетичних ряди: генетичний ряд металів та генетичний ряд неметалів.
На вашу думку який вони мають вигляд?
(На екрані інтерактивної дошки закриті генетичні ряди,
при перетягнені квадрату ряди відкриваються)
|
Генетичний ряд металів |
метал → основний оксид → основа (луг) → сіль
|
|
Генетичний ряд неметалів |
неметал → кислотний оксид → кислота → сіль
|
(На екрані інтерактивної дошки генетичний рядок, в якому учні виправляють помилки, розставляють коефіцієнти)
Генетичний ряд металів
1 2 3
Na → Na2O → NaОН → Na2SO4
2Nа + O2 → 2Nа2О;
Nа2О + Н2O → 2NаОН
2NаОН + H2SO4 → Na2SO4 + 2Н2O.
Звернути увагу учнів.
Правило генетичних зв’язків:
Кількість стрілочок у схемі відповідає кількості рівнянь хімічних реакцій, які необхідно скласти.
Сполуки, записані перед стрілочкою, вступити в хімічну реакцію.
Сполуки, записані після стрілочки, утворюються внаслідок реакції.
Hерозчинну основу не можна добути з оксиду, піддавши його взаємодії з водою. Тому генетичний зв’язок ускладнюється на одну ланку:
метал → основний оксид → сіль → основа → інша сіль.
Для заліза та сполук Феруму він має вигляд:
1 2 3 4
Fe → FeO → FeSО4 → Fe(OH)2 → FeCl2
2Fe+O2 → 2FeO
FeO + H2SO4 → FeSO4+H2O
FeSO4+2NaOH → Fe(OH)2 +Na2SO4
Fe(OH)2+2HCl → FeCl2+2H2O
Генетичний ряд неметалів
1 2 3
S → SО2 → Н2SО3 → К2SО3
Н2О + SО2 → Н2SО3;
2 NaОН + Н2SОз → Na2SО3 + 2Н2О.
Схеми можуть змінюватися, ускладнюватися:
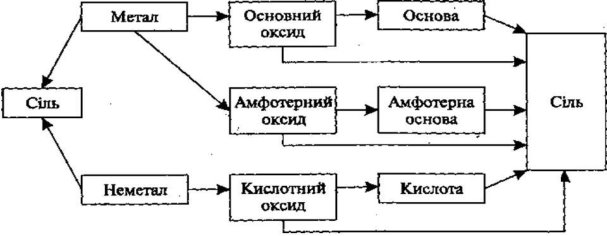
(Учні аналізують можливі шляхи взаємоперетворень класів неорганічних сполук за схемою і доповнюють схему генетичного зв’язку)
Ви ознайомилися з простими, типовими варіантами генетичних ланцюжків металів і неметалів.
V. Узагальнення і систематизація вивченого матеріалу.
1. Робота в парах із взаємоперевіркою.
Випишіть речовини, що утворюють генетичний ряд; складіть схему цього зв’язку, напишіть рівняння реакцій, з допомогою яких можна його здійснити.
(за варіантами: приклади утворених схем)
Аl → Аl2O3 → Аl(ОН)3 → АlСl3
↓
КАlO2
Сu → СuО → СuСl2 → СuSO4 → Сu(ОН)2
(На екрані інтерактивної дошки генетичні рядки, після виконання роботи, учні перевіряють, відкриваючі рядки, якщо правильно розставляють речовини)
2. Експрес опитування
1. Яким стане колір індикатора лакмусу у кислому середовищі.
2. Напишіть формулу амфотерного гідроксиду.
3. Наведіть приклад формули основного оксиду.
4. Напишіть формулу нітратної кислоти.
5. Яким стане колір індикатора лакмусу лужному середовищі.
6. Наведіть приклад формули кислотного оксиду.
7. Напишіть формулу хлоридної кислоти.
8. Визначте Молярну масу сульфур (ІV) оксиду.
9. Складіть формули таких речовин (2 б): Магній оксиду, Натрій сульфату
10. Дописати рівняння та визначити тип реакцій (2 б):
Са+Н2SO4→
ЅО3 + Νа2О →
(Відповіді на питання перевіряються за допомогою
інтернет-сервісу освітнього простору Learning Apps)
3. Розв`язування задач
Укажіть кількість речовини водню, який виділиться під час взаємодії ортофосфатної кислоти з цинком кількістю речовини 0,2 моль.
Яка маса алюмінію вступить у реакцію з хлоридною кислотою, якщо при цьому виділилось 2,24 л водню за н.у.
VI. Підведення підсумків уроку. Рефлексія, самооцінювання, домашнє завдання, його інструктаж


про публікацію авторської розробки
Додати розробку
