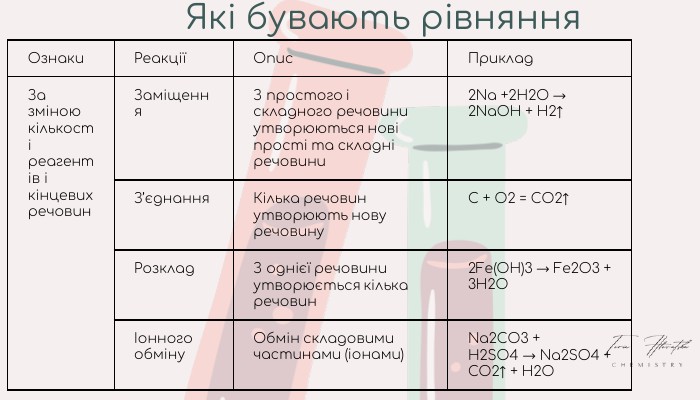
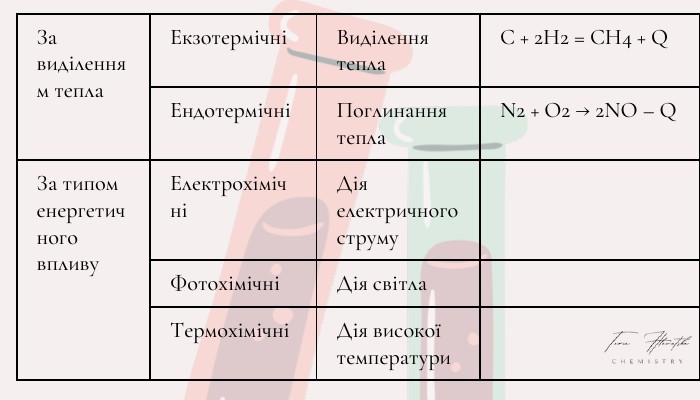
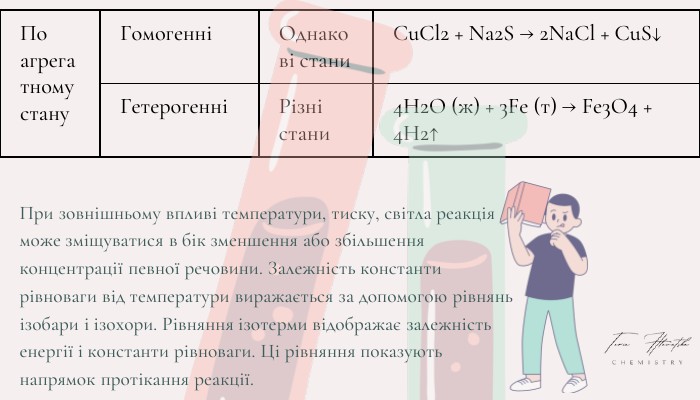
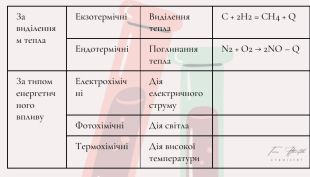
Хімічні реакції. Типи хімічних реакцій
Про матеріал
Хімічні реакції. Типи хімічних реакцій. Хімічна взаємодія особливості творення Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку